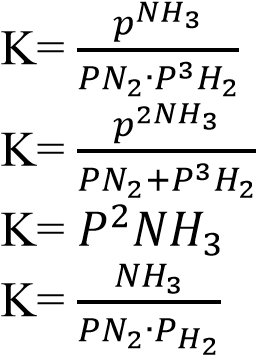ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.04.2024
Просмотров: 27
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
-
Жылу температурасы төмен денеден температурасы жоғары денеге өтпейді-
Термодинамиканың нөлінші заңы -
Лавуазье-Лаплас заңы -
Термодинамиканың екінші заңы -
Термодинамиканың бірінші заңы -
Гесс заңының бірінші салдары
-
-
Термодинамикалық жүйенің бір күйден екінші күйге ауысу кезінде, энергия жоқтан пайда болмайды және жоқ болып кетпейді, тек эквивалентті мөлшерде бір түрден екінші түрге айналады-
Термодинамиканың бірінші заңы -
Лавуазье-Лаплас заңы -
Термодинамиканың екінші заңы -
Гесс заңы -
Термодинамиканың нөлінші заңы
-
-
Термохимия - ол ғылым:-
Жылу эффектісі туралы -
Химиялық реакцияның механизмі туралы -
Химиялық реакцияның механизмі мен жылу эффектісі туралы -
Реакция жылдамдығы туралы -
Кинетикалық қисықтар туралы
-
-
S энтропияға тән сипаттамаларды келтір
1) Жүйенің бір күйден екінші күйге өту жолына тәуелсіз, бірақ жүйенің бастапқы және соңғы күйіне тәуелді
-
Бір күйден екінші күйге өту жолына тәуелді -
Температураға тура пропорционал және жылуға кері пропорционал -
Жылу мен температураға кері пропорционал -
Жүйенің бір күйден екінші күйге өтуіне тәуелді
-
«Дәнекерленген ампуладағы глюкозаның сұйытылған ерітіндісі» қандай термодинамикалық жүйеге жатады-
оқшауланған, гомогенді -
жабық, гомогенді -
ашық -
оқшауланған, гетерогенді -
гетерогенді
-
-
«Ашық ампуладағы изотондық ерітінді» қандай термодинамикалық жүйеге жатады-
оқшауланған -
ашық -
ашық, гомогенді -
гомогенді, оқшауланған -
гетерогенді
-
-
Процестің жүру барысында жүйедегі температура өзгермейді-
кинетикалық -
изохоралық -
изобаралық -
изобаралық-изотермиялық -
изохоралық-изобаралық
-
-
Қайтымды процесс – ол-
Тура және кері жүретін процесс -
Сыртқы әсерсіз жүретін процесс
-
-
Сыртқы әсер арқылы жүретін процесс -
Тура бағытта жүретін процесс -
Кері бағытта жүретін процесс
-
Изобаралық-изотермиялық потенциал-
Изобаралық - изотермиялық жағдайда термодинамикалық жүйенің энергияларының қосындысы -
Ішкі және кинетикалық энергиялардың қосындысы -
Термодинамикалық жүйедегі ретсіздік өлшемі -
Бос энергия өлшемі -
Ішкі және потенциалдық энергия қосындысы
-
-
Изобаралық - изотермиялық жағдайда химиялық реакция нәтижесінде сіңірілетін және бөлінетін жылу мөлшерін айтады-
стандартты түзілу энтальпиясы -
энтальпия -
изобаралық-изотермиялық потенциал -
реакцияның энтропиясы -
меншікті жылусыйымдылық
-
-
Стандартты жағдайда жай заттардан 1 моль күрделі заттың түзілуі нәтижесінде бөлінетін немесе сіңірілетін жылу мөлшерін айтады-
Реакцияның энтропиясы -
Түзілу энтальпиясы -
Стандартты түзілу энтальпиясы -
Реакцияның жылу эффектісі
-
5) Меншікті жылусыйымдылық
-
Стандартты жағдайда 1 моль күрделі заттың жай заттарға ыдырау реакциясында бөлінетін немесе сіңірілетін жылу мөлшерін айтады-
Реакцияның энтропиясы -
Реакцияның энтальпиясы -
Стандартты ыдырау энтальпиясы -
Реакцияның жылу эффектісі -
Меншікті жылусыйымдылық
-
-
Термодинамиканың үшінші заңына бағынады:-
газдар -
сұйық заттар -
қатты заттар -
ерітінділер -
барлығы
-
-
Глюкозаның СО2 және Н2О дейін тотығу ∆????????= - 2879,01 кДж/моль; ∆????????= -2801,69 кДж/моль
тең, сондықтан …
-
Реакция өздігінен жүрмейді -
Реакция қайтымсыз -
Реакция қайтымды -
Экзотермиялық реакция -
Эндотермиялық реакция
-
Тепе - теңдік жағдайы
-
∆Н =0 -
∆????˂????∆???? -
тура және кері процестің жылдамдығы тең -
∆???? < 0 -
∆???? > ????∆????
-
Реакциялар үшін
C+O2 = CO2+Q1
C+1/2O2=CO+Q2
CO+1/2 O2=CO2+Q3 ' дұрыс таңдау жаса
-
Q1=Q2+Q3 -
Q1=Q2-Q3 -
Q3=Q1+Q2 -
Q3=Q1+Q2 -
Q2=Q1+Q3
-
Реакциялар үшін
????2+????2=2NO+ ????1
2NO+????2=2????????2+????2 ????2+2????2=2????????2+????3 дұрыс таңдау жаса
-
Q1=Q2+Q3 -
Q1=Q2-Q3 -
Q3=Q1-Q2 -
Q3=Q1+Q2 -
Q2=Q1+Q3
-
Гиббс-Гельмгольц теңдеуі-
∆G=∆H+Т(∂G/∂T)р -
∆G=∆H+Т(∂G/∂T)v -
∆G=∆U+Т(∂G/∂T)р -
∆G=0 -
∆F=0
-
-
а± – дегеніміз …-
Электролиттің орташа иондық активтілігі -
Электролит активтілігі -
Еріткіш активтілігі -
Ерітінді активтілігі -
Активтілік коэффициенті
-
-
± – дегеніміз …-
Электролиттің орташа активтілік коэффициенті -
Электролиттің активтілік коэффициенті -
Еріткіштің активтілік коэффициенті -
Ерітіндінің активтілік коэффициенті -
Активтілік
-
-
????2+3H2↔2NH3 реакциясы үшін тепе -теңдік константасының теңдеуін көрсет -
2)
3)
4)
5)
-
Энтропия өседі-
Газ тәрізді өнімдердің көлемінің өсуімен жүретін реакциялар -
Газ тәрізді өнімдердің көлемінің төмендеуімен жүретін реакциялар -
Газ тәрізді өнімдердің көлемінің өзгеруінсіз жүретін реакциялар -
Сұйықта тұну процесі -
Сұйық заттағы кристализациялану процесі
-
-
Энтропия төмендейді-
Газ тәрізді өнімдердің көлемінің өсуімен жүретін реакциялар -
Газ тәрізді өнімдердің көлемінің төмендеуімен жүретін реакциялар -
Газ тәрізді өнімдердің көлемінің өзгеруінсіз жүретін реакциялар -
Сұйықтың булану процесі -
Будың конденсациялану процесі
-
-
Энтропия шамасы келесі процестерде өседі
-
Сұйықтардың конденсациясы -
Газ көлемінің азаюы -
Кристалдардың балқуы -
Қатты фазаның (тұнба) түзілуі -
Сұйық заттардың кристалдануы
-
Энтропия шамасы келесі процестерде төмендейді-
сұйықтардың конденсациясы -
сублимация -
балқу -
сұйықтардың булануы -
газ көлемінің өсуі
-
-
Гибстің бос энергиясы (G) – жүйенің термодинамикалық күй функциясы, ол....-
изохоралық-изотермиялық жағдайда процестің өздігінен жүру мүмкіндігі -
изобаралық-изотермиялық жағдайда процестің өздігінен жүру мүмкіндігі -
абсолютті шамасы нөлге тең -
өздігінен жүретін процестің оң шамасына тең -
жүйенің ретсіздік өлшемі
-
-
Изобаралық- изотермиялық потенциал (G) – жүйенің термодинамикалық күй функциясы, ол...-
жүйенің бос энергиясының өлшемі -
изобаралық - изотермиялық процестің өздігінен өтуін сипаттайды -
жүйеге жұмсалатын күштің абсолютті шамасы -
өздігінен өтетін процестің оң мәніне ие -
егер жүйе термодинамикалық теп -теңдікте болса, оның мәні 0 -ге тең болады
-
-
(F) Гельмгольцтің бос энергиясы – жүйенің термодинамикалық күй функциясы, ол….-
изохоралық-изотермиялық жағдайда процестің өздігінен жүру мүмкіндігі -
изобаралық-изотермиялық жағдайда процестің өздігінен жүру мүмкіндігі -
Сыртқы күшке қарсы жүретін, абсолютті шамасы жұмысқа тең шама -
Өздігінен жүрмейтін процестің теріс мәніне тең -
Жүйедегі байланысқан энергияның өлшемі
-
-
Стандартты жағдайда жүретін реакцияның 2С+ЗН2 + 1/2О2 =С2Н5ОН жылу эффектісін атайды-
Көміртегінің стандартты жану жылуы -
Сутегінің стандартты жану жылуы -
Тотығудың стандартты жылуы -
Этанолдың түзілу жылуы -
Этанолдың стандартты түзілу жылуы
-
-
Гиббс энергиясын есептеу теңдеуі
1)∆???? = ∆???? + ????∆????
2)∆???? = ∆???? − ????∆????
-
G=RTlnK -
∆???? = ∆Н − ???????????????????????? -
∆????????= ∑ ∆????өнім − ∑ ∆????бастапқы зат
-
Изохоралық-изотермиялық потенциалды анықтау теңдеуі-
∆???? = ∆???? − ????∆???? -
∆???? = ∆???? − ????∆???? -
∆???? = Н − ???????????????????????? -
∆???? = −???????????????????????? -
∆???????? = ∑ ∆????бастапқы зат − ∑ ???? ????өнім
-
-
Химиялық реакцияның изобара теңдеуі
1
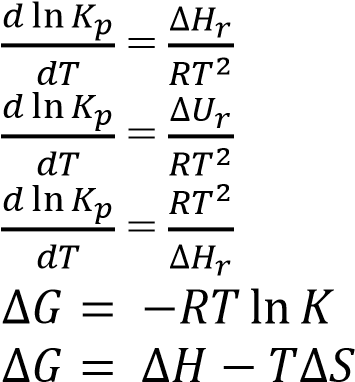 )
)2)
3)
4)
5)
-
Химиялық реакцияның изохора теңдеуі
1)
2)
3)
4
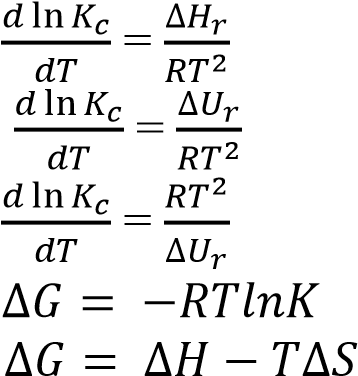 )
)5)
-
Термодинамиканың бірінші заңына сәйкес жүйенің жұмысы тең-
Оған жұмсалған жылу мөлшеріне -
Оған жұмсалған жылудың көп мөлшеріне -
Q = A - ∆U -
A = Q- ∆U -
А= Q+ ∆U
-
-
S энтропия термодинамикалық функция – ол…-
Кез келген дененің кез келген температурада нөлге тең емес -
Дж/моль өлшенеді -
Дж/мольК өлшенеді -
Байланысқан энергия өлшемі -
Бос энергия өлшемі
-
-
S энтропия мәні-
Жүйенің бір күйден екінші күйге өту жолына тәуелсіз, тек бастапқы және соңғы күйге тәуелді -
Жүйенің бір күйден екінші күйге өту жолына тәуелді -
Жылу мен температураға кері пропорционал -
Температураға тура пропорционал және жылуға кері пропорционал -
Температураның абсолютті нөл мәнінде идеалды кристалдар үшін нөлге тең болмайды
-
83. Изохоралық-изоэнтропиялық потенциал ол –
1) H
-
G -
F -
U -
S
-
Изобаралық-изоэнтропиялық потенциал ол –
1) H
-
G -
F -
U -
S
-
Изобаралық-изотермиялық потенциал ол –
1) H
-
G -
F -
U -
S
-
Изохоралық-изотермиялық потенциал ол –
1) H
-
G -
F -
U -
S
-
Төмендегі шамалардың қайсысы күй функциясына жатпайды?
-
энтропия -
энтальпия -
ішкі энергия -
Гиббстің бос энергиясы -
жұмыс
-
Стандартты жағдайда барлық элементтердің энтальпиясы
1) нөлге тең
-
айнымалы шама -
нөлден аз -
нөлден көп -
нөлден көп, бірден аз
-
Экзотермиялық реакция үшін энтальпия шамасының таңбасы
1) тек оң
2) нөлге тең 3) тек теріс
-
оң да, теріс те -
кез келген
-
Эндотермиялық реакция үшін энтальпия шамасының таңбасы
-
тек оң -
нөлге тең -
тек теріс -
оң да, теріс те -
кез келген
-
Химиялық тепе - теңдік күй сипаты
-
тура және кері реакция жылдамдықтары теңеседі -
тура реакция жылдамдығының теңдігі -
кері реакцияның теңдігі -
өнімдердің зат мөлшерінің қосындысы реагенттердің зат мөлшерінің қосындысына тең -
химиялық реакцияның тура және кері бағытта жүрмеуі
-
Соңына дейін жүретін реакция
-
қайтымсыз -
қайтымды -
параллель -
тізбектелген -
орайлас
-
Бір уақытта қарама -қарсы жүретін реакциялар
-
қайтымсыз -
қайтымды -
параллель -
тізбектелген -
орайлас
-
 Химиялық тепе -теңдік константасы (К)
Химиялық тепе -теңдік константасы (К)
-
К1/К2 -
К1/К2 -
3) К1=0
4) К2=0 5) К1≠К2
-
Бір атомды газ үшін жылусыйымдылық (Сv) тең
-
5R/2 -
3R/2 -
3) 0
-
1 -
7R/2
-
Екі атомды газ үшін жылусыйымдылық (Сv) тең
-
5R/2 -
3R/2 -
0 -
1 -
7R/2