ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.04.2024
Просмотров: 26
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
-
Ерітіндінің коллигативті қасиеттері
-
еріген заттың бөлшектер санына байланысты -
еріген заттың табиғатына тәуелді -
еріген заттың бөлшектер санына тәуелді емес -
еріген заттың табиғатына тәуелді емес -
еріген заттың табиғатына тәуелді және еріген заттың бөлшектер санына тәуелсіз
-
Ерітіндіні таза еріткішпен салыстырғанда
-
қаныққан бу қысымы тұрақты -
қайнау температурасы төмендейді -
қаныққан бу қысымы өседі -
қату температурасы өседі -
қату температурасы азаяды
-
Таза еріткішпен салыстырғанда ерітінді үстіндегі қаныққан буының қысымының салыстырмалы төмендеуі еріген заттың молярлық үлесіне тең
-
Гиббс-Коноваловтің бірінші заңы -
Гиббс-Коноваловтің екінші заңы -
Вант-Гофф заңы -
Раулдің бірінші заңы -
5) Раулдің екінші заңы
-
Вант-Гофф заңына сәйкес теңдеу
-
∆Тқайнау = Еm2 -
∆Тқату = Km2 -
∆Р/Р1 = x2 -
π= CRT
5) p1 = p10x1
-
(Е) эбулиоскопиялық константа
1) еріткіш табиғатына тәуелді
2)еріген зат табиғатына тәуелді
-
еріткіш табиғатына тәуелді емес -
еріген зат табиғатына тәуелді емес -
еріткіш пен еріген зат табиғатына тәуелді
-
(К) криоскопиялық константа
l) еріткіш табиғатына тәуелді
2) еріген зат табиғатына тәуелді
-
еріткіш табиғатына тәуелсіз -
температураға тәуелді -
еріткіш пен еріген зат табиғатына тәуелді
103.Еріген заттың молярлық массасын криоскопиялық анықта
1) ∆Тқату = Кm2
2) ∆Тқайн = Еm2 3) ∆S = Q/T
-
???? = С???????? -
Г = -C/RT(d????/dC)
-
Эритроцитті ерітіндіге жоғары осмостық қысыммен жеткізу-
плазмолиз -
гемолиз
-
З) судың плазмадан жасушаға ауысуы
-
эндосмос -
жасуша қабығының айрылуы
-
Көктамыр ішіне енгізілетін дәрілік заттың ерітіндісі қан плазмасына (көз жасы сұйықтығына) қатысты болуы керек
1) изотондық
2) гипертоникалық
-
гипотоникалық -
қаныққан -
қанықпаған
-
Осмостық қысымның жоғарылауына байланысты жасушаның осмостық керілу күйі деп аталады 1) эндосмос
-
плазмолиз -
гемолиз -
тургор
5) экзосмос
-
Дәрілік заттардың изотондық концентрацияларын есептеуге болады-
Аррениус заңы -
фазалардың таралуы -
термодинамикалық әдіс -
Раульдің екінші заңы -
кинетикалық әдіс
-
-
Теңіз суында жүзу кезінде көздің аздап ауыруы мен қызаруы байланысты-
көз алмасынан судың осмосы -
көз алмасының ішіндегі судың осмосы -
суда еріген заттардың көз алмасына өтуі -
еріген заттардың көз алмасынан теңіз суына өтуі -
гемолиз
-
-
Тұщы суда жүзу кезінде көздің ауырсынуы мен ауруы пайда болады, себебі-
көз алмасынан судың осмосы -
көз алмасына судың осмосы -
еріген заттардың судан көз алмасына өтуі -
еріген заттардың көз алмасынан суға өтуі -
плазмолиз
-
-
2 л суда 2 моль фруктозаны ерітсе, судың қату температурасы қалай өзгереді? Судың криоскопиялық тұрақтысы 1,86°:-
өзгермейді -
1,86 есе өседі -
1,86 есеге төмендейді -
1,86 градусқа жоғарылайды
-
5) 1,86 градусқа төмендейді
-
Изотондық коэффициент i:-
электролиттер үшін 1 тең -
1-ден жоғары бейэлектролиттер үшін -
1-ден төмен электролиттер үшін -
бейэлектролиттер үшін 0-ге тең -
1-ден жоғары электролиттер үшін
-
-
 (n-1) + 1 өрнегі көрсетеді
(n-1) + 1 өрнегі көрсетеді -
иондану дәрежесі -
иондану константасы -
рН мәндері -
изотондық коэффициент -
иондарға ыдырайтын бөлшектердің саны
-
-
Күшті электролиттер теориясын ұсынған
-
Дебай және Хюккель -
Вант Гофф -
Аррениус -
Гиббс -
Гельгольц
-
Булануы нәтижесінде бастапқы сұйық қоспаның құрамымен бірдей бу түзілетін ерітінділер аталады
1) гомогенді 2)гетерогенді 3) теңескен
4) қайтымды 5)азеотропты
-
Ерітіндінің негізгі коллигативтік қасиеті:-
ерітіндінің қайнау температурасы -
ерітіндінің қату температурасы -
ерітінді үстіндегі қаныққан бу қысымының төмендеуі -
онкотикалық қысым -
ерітінді үстіндегі қаныққан бу қысымы
-
-
Криоскопиялық тұрақты:-
концентрацияға тәуелді емес -
температураға тәуелді емес -
еріткіштің табиғатына тәуелді емес -
еріткіштің табиғатына байланысты
-
5) еріген заттың табиғатына байланысты
-
Эбулиоскопиялық тұрақты:-
концентрацияға тәуелді емес -
температураға тәуелді емес -
еріткіштің табиғатына тәуелді емес -
еріткіштің табиғатына байланысты -
еріген заттың табиғатына тәуелді емес
-
-
Төмендегі заттардың қайсысы үшін изотондық коэффициенттің мәні 1-ге тең?-
C12H22O11 -
NaCl -
KNO3 -
CuSO4 -
CuCl2
-
-
Төмендегі заттардың қайсысы үшін изотондық коэффициенттің мәні 1-ге тең емес?-
манноза -
глюкоза -
фруктоза -
галактоза -
натрий гидрокарбонаты
-
-
Буферлік ерітінділерге жатады-
күшті негіз және әлсіз қышқылмен осы негіздің тұзы -
әлсіз негіз және осы негіздің күшті қышқылмен тұзы -
күшті қышқыл және осы қышқылдың әлсіз негізі бар тұзы -
күшті қышқыл және осы қышқылдың күшті негізі бар тұзы -
әлсіз қышқыл күшті негізбен
-
-
рН сутектік көрсеткіш анықталады-
pH= lgCH+ -
pН= - lgCн+ -
рН=-1nСн+ -
4) рН= ln СH+
-
5) рН=-1nСон-
-
Қышқыл ортада
1)рН>7
-
pН=7 -
рН<7 -
[Н+] = 10-7моль/л -
[H+]<10-7 моль/л
-
Бейтарап ортада-
рН = 0 -
pH=7 -
рН<7 -
[Н+] < 10-7 моль/л -
[H+ ]>10-7 моль/л
-
-
Молярлық концентрациясы 0,1 моль/л тұз қышқылы ерітіндісінің рН мәні-
1 -
7 -
0,1 -
13 -
5
-
-
Молярлық концентрациясы 0,01 моль/л және диссоциациялану дәрежесі 0,01 сірке қышқылы ерітіндісінің рН мәні-
11 -
12 -
2 -
10-4 -
4
-
-
Молярлық концентрациясы 0,01 моль/л натрий гидроксиді ерітіндісінің рН мәні
1) 10-2
-
10-12 -
7 -
12 -
2
-
Молярлық концентрациясы 0,01 моль/л және диссоциациялану дәрежесі 0,001 аммоний гидроксиді ерітіндісінің рН мәні-
9 -
10-9 -
2 -
10-5 -
5
-
-
250С судың иондық көбейтіндісі-
7 -
14 -
10-7 -
1014 -
10-14
-
-
Гидрокарбонатты буферге сәйкес қоспаны таңда-
Н2СO3+Nа2СО3 -
2) Na2CO3+ CO2
-
3) H2CO3+NaHCO3
4) Н2СО3+NaOH
5) NaHCO3+NaOH
-
Егер рН=3, онда-
сутегі ионының концентрациясы 0,1 моль/л тең -
сутегі ионының концентрациясы 0,01 моль/л тең -
сутегі ионының концентрациясы 1 моль/л тең -
рОН = 4 -
pOH = 11
-
-
Егер рОН=3, онда-
гидроксил ионының концентрациясы 0,2 тең -
гидроксил ионының концентрациясы 0,1 тең -
сутегі ионының концентрациясы 0,001 -
рН=11
-
5) рН=10
-
Вант-Гофф заңы бойынша берілген температурада ерітіндінің осмостық қысымы тура пропорционал-
еріткіштің мольдік үлесіне -
еріген заттың молялдық концентрациясына -
еріген заттың массалық үлесіне -
еріткіштің молярлық концентрациясына -
5) еріген заттың молярлық концентрациясына
-
-
Белоктардың болуына байланысты қысым қалай аталады?-
осмостық -
онкотикалық -
гидростатикалық -
атмосфералық -
парциалды
-
-
Идеал газ қоспасынан тұратын химиялық реакцияның CH4 + CO2 = 2CO + 2H2 тепе - теңдік константасы KP=KС(RT)n, мұндағы n – стехиометриялық коэффициенттің өзгерісі. n шамасын көрсет-
1 -
2 -
3 -
4 -
5
-
-
Идеал газ қоспасынан тұратын химиялық реакцияның 2NO2(Г) = 2NO(Г) + O2 тепе - теңдік константасы KX=KС(RT/P)n , мұндағы n – стехиометриялық коэффициенттің өзгерісі. n шамасын көрсет-
1 -
2 -
3 -
4 -
5
-
-
Идеал газ фазасындағы химиялық реакциялар үшін тепе-теңдік парциалды қысымдар (P), мольдік үлестер (x) немесе мольдік концентрациялар (c) арқылы өрнектелген тепе-теңдік константаларына арналған теңдеу
1
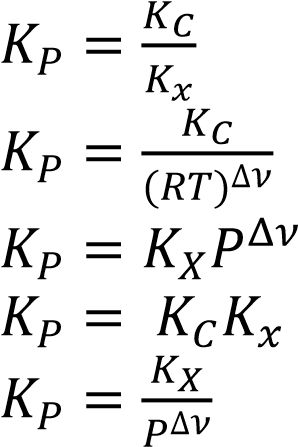 )
)2)
3)
4)
5)
-
Дұрыс тұжырымды таңдаңыз-
ΔG > 0 химиялық тепе-теңдіктің белгісі -
ΔG = 0 химиялық тепе-теңдіктің белгісі -
3) ΔG < 0 химиялық тепе-теңдік белгісі
-
4) ΔG ≥ 0 химиялық тепе-теңдіктің белгісі
5) ΔG ≤ 0 химиялық тепе-теңдік белгісі
-
Бірдей заттар бір уақытта әрекеттесіп, әртүрлі өнімдер түзетін реакциялар аталады-
параллельді -
тізбектелген -
орайлас -
тізбекті 5) фотохимиялық
-
-
Клаузиус-Клапейрон теңдеуі тепе-теңдік қысымының температураға тәуелділігін сипаттайды.-
бір компонентті бір фазалы жүйе -
бір компонентті екі фазалы жүйе -
екі компонентті бір фазалы жүйе -
екі компонентті екі фазалы жүйе 5) екі компонентті үш фазалы жүйе
-
-
Сол жағына сәйкес келетін бір компонентті екі фазалы жүйе үшін теңдеудің dP/dT= оң жағын таңдаңыз-
2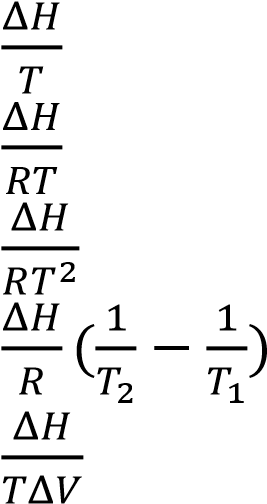 ) 3)
) 3)
-
4)
5)
-
Сол жағына сәйкес теңдеудің ln(P2/P1) = оң жағын таңдаңыз
1
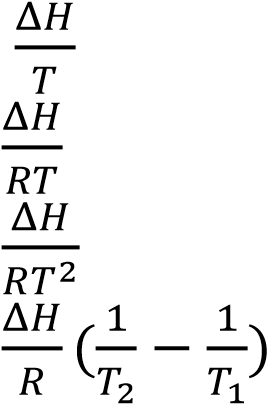 )
)2) 3)
4)
5)
-
Сыртқы жағдайлардың тек температура мен қысым әсер ететін екі фазалы бір компонентті жүйенің еркіндік дәреже саны-
1 -
2 -
3 -
4 -
5
-
143 Сыртқы жағдайлардан тек қысым мен температура әсер ететін K компонент пен Ф фазадан тұратын жүйенің еркіндік дәреже саны (варианттылық)
1) К+Ф+2
2) К-Ф-2
-
К+Ф-2 -
Ф-К+2 -
К-Ф+2
-
Сыртқы жағдайлардан тек температура (қысым тұрақты) әсер ететін K компонент мен Ф фазадан тұратын жүйенің еркіндік дәреже саны (варианттылық)
1) К+Ф+1
2) К-Ф-1
-
К+Ф-1 -
Ф-К+1 -
К-Ф+1
-
Көпкомпонентті жүйелер – бұл-
компонент саны көп -
екі компоненттен -
бір компоненттен көп -
екі компоненттен көп -
5) бір компоненттен
-
-
Фаза – бұл-
гетерогенді жүйенің гомогенді бөлігі -
бірдей агрегаттық күйдегі жүйе бөліктерінің жиынтығы -
химиялық құрамы бірдей жүйе бөліктері -
химиялық құрамы және физикалық қасиеттері бірдей жүйенің гомогенді бөліктердің жиынтығы -
гетерогенді жүйе
-
-
Гиббстің фазалық ережесі жатады-
гетерогенді жүйелерге -
көпкомпонентті жүйелерге -
көпфазалы жүйелерге
-
4) тепе-теңдіктегі жүйелерге
5) гомогенді жүйелерге
-
Жүйе инвариантты болады, егер еркіндік дәреже-
0 -
1 -
2 -
3 -
4
-
-
Гиббстің фазалық ережесі-
тепе-теңдіктегі жүйенің фазалар саны, компоненттер саны және еркіндік дәреже саны арасындағы байланыс -
заттың сулы және органикалық фазалардағы концентрациялар арасындағы қатынасты белгілейді -
әртүрлі температурадағы реакция жылдамдығының байланысын белгілейді -
заттың сулы емес фазадағы концентрациялары арасындағы қатынасты белгілейді 5) бірдей температурадағы реакция жылдамдығының байланысын белгілейді
-


