ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.04.2024
Просмотров: 28
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
-
Фазалық тепе-теңдік дегеніміз-
екі фаза арасындағы тепе-теңдік -
екі немесе одан да көп фазалардан тұратын жүйедегі тепе-теңдік -
сұйық және қатты фазалар арасындағы тепе-теңдік -
көпкомпонентті жүйедегі тепе-теңдік
-
5) инвариантты жүйедегі тепе-теңдік
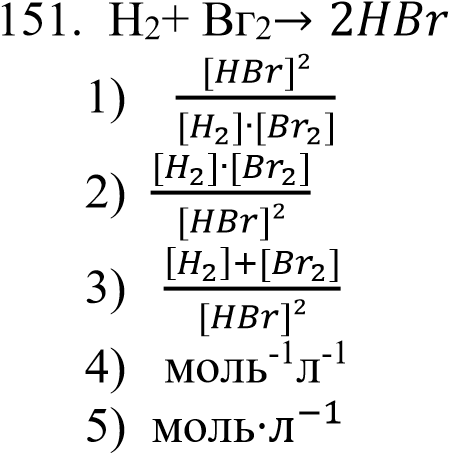 реакциясы үшін тепе - теңдік константасы
реакциясы үшін тепе - теңдік константасы 1дурыс
-
w = [????]1/2 ∙ [????]−1/2 реакция реттілігін белгіле-
0 -
1/2 -
1 -
1,5 -
2
-
-
w = [????]2∙[????]−1/2 реакция реттілігін белгіле-
0 -
1/2 -
1 -
1,5 -
2
-
-
Химиялық реакция жылдамдығының тұрақтысы-
кез келген уақыттағы реакция жылдамдығына тең -
әрекеттесуші заттардың концентрациялары бірге тең болса, реакция жылдамдығына тең -
әрекеттесуші заттардың концентрациясына байланысты 4) әрекеттесуші заттардың концентрациясына тәуелді емес
-
5) элементар актіге қатысатын молекулалар санына тең
-
Дұрыс тұжырымды таңдаңыз: химиялық реакцияның реттілігі --
молекулалықпен бірдей -
стехиометриялық коэффициенттердің қосындысы -
кинетикалық теңдеудегі дәрежелердің қосындысы -
элементарлық актіге қатысатын бөлшектердің саны -
стехиометриялық коэффициенттер саны
-
156 2А + В = 2С реакциясы үшін
-
тура реакцияның кинетикалық теңдеуі W= k????????2 • ???????? -
кері реакцияның кинетикалық теңдеуі W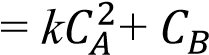
-
тура реакцияның реттілігі 2 тең -
тура реакцияның реттілігі 1 тең -
кері реакцияның кинетикалық теңдеуі W = k • ????????
-
2А + В = 2С тура реакцияның кинетикалық теңдеуінің түрі-
W = k????????2• ???????? -
W = k????????2+ ???????? -
W = k????????• ???????? -
W = k????????+ ???????? -
W= ????????2
-
-
2СО + О2 = 2C????2реакциясы үшін тура реакцияның кинетикалық теңдеуі-
тура реакцияның кинетикалық теңдеуі W
-
тура реакцияның кинетикалық теңдеуі W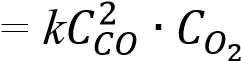
-
тура реакцияның реттілігі 2 тең -
тура реакцияның реттілігі 1 тең -
кері реакцияның кинетикалық теңдеуі W= k • ????????????2
-
-
2СО + ????2 = 2С????2 кері реакциясы үшін кинетикалық теңдеуінің түрі-
W = k????????????2 +????????2
-
2) W = k????????????2 ∙ ????????2
-
W = k • ????????????2 2 -
W = ????????????2 2 -
W = k •????????????2
-
Реакцияның температуралық коэффициенті γ=3, температурасы 250 -тан 45°С -қа өскен кезде реакцияның жылдамдығы қалай өзгереді?-
6 есе өседі -
6 есе төмендейді -
9 есе өседі
-
3) 9 есе төмендейді
5) өзгермейді
-
Егер реакцияның температуралық коэффициенті γ = 3 болса, температура 40 градусқа төмендеген кезде реакция жылдамдығы ...-
12 есе артады -
12 есеге төмендейді -
81 есе өседі -
81 есе азаяды 5) өзгермейді
-
-
2СО + ????2 = 2С????2 реакцияның молекулалығын анықта-
0 -
1 -
-3 -
2 -
3
-
-
2NO+????2 = 2N????2 реакцияның молекулалығы-
0 -
1 -
2 -
3 -
4
-
-
2СО + ????2 = 2СО2 әрекеттесетін заттардың концентрациясын 2 есе арттырса, реакцияның жылдамдығы-
өзгермейді -
4 есе өседі
-
3) 8 есе өседі
4) 6 есе өседі
5) 8 есе төмендейді
-
Көлемді 3 есе азайтса, 2СО + О2 = 2СО2 реакцияның жылдамдығы-
өзгермейді -
9 есе өседі -
9 есе төмендейді -
27 есе өседі -
27 есе төмендейді
-
-
Қысымды 3 есе азайтса, 2СО + 02 = 2С02 реакцияның жылдамдығы-
32 есе өседі -
9 есе өседі -
9 есе төмендейді
-
4) 27 есе өседі
5) 27 есе төмендейді
-
Әрекеттесуші заттар концентрациясының уақыт бойынша өзгеру графиктік тәуелділігі аталады-
беттік керілу изотермасы -
кинетикалық қисық -
реакцияның энергетикалық профилі -
қисық -
адсорбция изотермасы
-
-
Әрекеттесуші заттар концентрациясының химиялық реакция жылдамдығына әсері сандық түрде сипатталады-
Рауль заңы -
Гесс заңы -
Аррениус теңдеуі -
Вант-Гофф ережесі -
массалар әрекеттесу заңы
-
169
Массалар әрекеттесу заңының авторлары
-
Менделеев және Клапейрон -
Клаузиус Клайперон -
Гульдберг және Вааге -
Шульц және Гарди 5) Гендерсон және Гассельбах
170.Химиялық реакция жылдамдығының температураға тәуелділігі мына теңдеумен сипатталады?
-
Гесс -
Михаэлис-Ментен -
Аррениус -
Шульце-Гарди ережесі -
массалар әрекеттесуші заңы
171.Ле-Шателье принципі бойынша ????2 + ????2 = 2???????? реакцияның тепе - теңдігі оңға ығысады, егер
-
сутегі мен йодтың концентрациясын арттыру -
сутегінің концентрациясын төмендету -
йод сутегінің концентрациясын арттыру -
йодтың концентрациясын төмендету -
H2 және I2 концентрациясын төмендету
172. С(тв) + О2(г)= СО2(г) реакциясындағы оттегі концентрациясын екі есе арттырса, онда реакция жылдамдығы
-
өзгермейді -
2 есе артады -
3 есе артады -
4 есе артады -
6 есе артады
173.Жылдамдық константасының температурадан тәуелділігін көрсет
-
k=A????????/???????? -
k= A???????? ???????? -
ln k= ln A-
-
ln k= ln A - ???????? ???????? -
ln k= ln A+???????? ????????
174.Катализатор химиялық реакцияның жылдамдығын арттырады
-
ішкі энергияның төмендеуі -
энтальпияның төмендеуі -
активтену энергиясының төмендеуі -
энтропияның артуы -
активтену энергиясының жоғарылауы
-
реакция өнімінің концентрациясының өзгеруінен есептелетін реакция жылдамдығы -
бастапқы заттың концентрациясының өзгеруінен есептелетін реакция жылдамдығы
3) реакция өнімінің концентрациясының өзгеруінен есептелетін реакцияның шынайы жылдамдығы
-
бастапқы заттың концентрациясының өзгеруінен есептелетін реакцияның шынайы жылдамдығы -
екінші ретті реакция жылдамдығы
-
реакция өнімінің концентрациясының өзгеруінен есептелетін реакция жылдамдығы -
бастапқы заттың концентрациясының өзгеруінен есептелетін реакция жылдамдығы
3) реакция өнімінің концентрациясының өзгеруінен есептелетін реакцияның шынайы жылдамдығы
-
бастапқы заттың концентрациясының өзгеруінен есептелетін реакцияның шынайы жылдамдығы -
екінші ретті реакция жылдамдығы
177. Химиялық реакцияның молекулалығы
-
әрқашан бүтін сан -
нөлге тең болуы мүмкін -
бөлшек болуы мүмкін -
2-ден аспауы керек -
бөлшек болуы мүмкін емес
178.Реакцияның тұрақтылық константасы тәуелді
-
температураға -
массаға -
уақытқа -
зат мөлшеріне
5) салмаққа
-
Қандай жағдайда химиялық реакцияның жылдамдық константасы А+ВС реакция жылдамдығына тең, яғни W=K?-
элементар химиялық реакцияларда -
әрекеттесуші компоненттер газ фазасында болғанда -
әрекеттесетін компоненттердің концентрациясы бірге тең болғанда, яғни СА=СВ=1 -
жылдамдық константасы реакция жылдамдығына тең бола алмайды -
әрекеттесетін компоненттердің концентрациясы бірге тең болғанда, яғни СА=СВ≠1
-
-
Химиялық реакция жылдамдығының константасының физикалық мағынасы қандай?
1) жылдамдық константасы химиялық реакция жылдамдығына тең, егер ол газ фазасында жүрсе
-
әрекеттесуші заттардың концентрациясы бірге тең болса, жылдамдық константасы химиялық реакция жылдамдығына тең -
жылдамдық константасы реакция жылдамдығына тең, егер ол фазааралық шекарада жүрсе -
жылдамдық константасының физикалық мағынасы мүлдем жоқ -
егер ол газ фазасында жүрсе, жылдамдық константасы химиялық реакция жылдамдығына тең емес
-
Химиялық кинетиканың негізгі постулаты қалай оқылады?
-
химиялық реакцияның жылдамдығы реакция өнімдердің концентрациясына тәуелді 2) реакция жылдамдығы барлық әрекеттесуші заттардың концентрациясының көбейтіндісіне тура пропорционал
3) реакция жылдамдығы олардың сәйкес стехиометриялық коэффициенттері дәрежесіне келтірілген әрекеттесуші заттардың концентрацияларының көбейтіндісіне тура пропорционал 4) реакция жылдамдығы - әрекеттесуші заттардың концентрациясының бірлік бетте өзгеруі 5) реакция жылдамдығы реакция өнімдерінің концентрациясының көбейтіндісіне тура пропорционал
-
Реакция реті нөл, бөлшек, теріс болуы мүмкін бе?-
реакция реті бөлшек және теріс болуы мүмкін емес, нөл болуы мүмкін -
реакция реті тек оң болуы мүмкін -
иә, реакция реті кез келген мәнді қабылдай алады -
реакция реті нөлге тең болуы мүмкін емес, ал қалған барлық мәндер болуы мүмкін 5) тек бүтін сан болуы мүмкін
-
-
Химиялық реакцияның механизмі дегеніміз не?-
аралық заттардың түзілу процесінің толық теориялық сипаттамасы -
механизм – реакция өнімдерінің күтілетін шығымы -
химиялық реакцияны құрайтын кезеңдердің жиынтығы -
механизм – химиялық реакцияны жүргізу тәсілі -
аралық заттардың түзілу процесін ішінара теориялық сипаттау
-
-
Реакция жылдамдығының таңбасы қандай?-
әрқашан оң; -
реакция өнімдерінің концентрациясының өзгеруі арқылы көрсетілсе, оң, ал бастапқы заттардың концентрациясының өзгеруі арқылы өрнектелсе, теріс; -
реакция механизміне байланысты (қайтымды реакция кезінде жылдамдық тура кезең үшін оң, ал кері үшін теріс); -
әрқашан теріс -
молекулалығына байланысты
-
-
Реакция жылдамдығының температураға тәуелділігі туралы Вант-Гофф ережесі қалай айтылады?-
температураның әр 100 С жоғарылауы гомогенді реакцияның жылдамдығын 2 есе арттырады -
температураның жоғарылауы жылдамдықтың бірнеше есе артуына әкеледі -
температураның 100 С жоғарылауы химиялық реакцияның жылдамдығын 2-4 есе арттырады 4) химиялық реакция жылдамдығының артуы температураның әрбір 10 градусқа артуына тура пропорционал
-
5) температураның әрбір 100 С жоғарылауы гомогенді реакция жылдамдығын 4 есе арттырады
-
Активтену энергиясы дегеніміз не?-
бөлшектердің соқтығысуы кезінде бөлінетін энергия мөлшері -
реакцияға қатысатын заттардың кинетикалық энергиясының ең үлкен мәні; -
реакцияға қатысатын заттардың ішкі энергиясының жоғарғы мәніне тең; -
реакция жүйесінің орташа энергиясымен салыстырғанда молекулалардың реакцияға қатысуы үшін қажет энергияның артық мөлшері -
жұмысқа ауысу кезіндегі энергия мөлшері
-
-
Химиялық әрекеттесетін жүйенің жылу сыйымдылығын өзгерту арқылы анықтауға болады:-
химиялық реакцияның жылу эффектісінің температуралық коэффициентін -
химиялық реакцияның жүру бағытын -
химиялық реакция өнімдерінің шығымын -
реакция өнімінің түзілу жылуының температуралық коэффициентін -
жүйедің күй функцияларын
-
-
Егер химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрациясына тәуелді болмаса, онда реакция реті болады-
3 -
1/2 -
0 -
2 -
-1/2
-
189.Қандай ретті реакциялар үшін реакция жылдамдығы мен реакция жылдамдық константасының өлшем бірлігі бірдей
-
нөл -
бірінші 3) екінші
4) үшінші 5) бөлшек
-
Катализатор - бұл зат-
қайтымды реакцияның тепе-теңдік орнын ауыстырады -
реакцияның активтену энергиясын арттырады -
реакцияның активтену энергиясын төмендетеді -
реакцияның соңында ол жұмсалады 5) тура реакцияның жылдамдығын арттырады
-
-
Химиялық реакциядағы катализатордың әсерінен өзгереді-
реакция өнімдерінің құрамы -
тепе-теңдік концентрациялары -
тепе-теңдік жағдайы -
реакцияның бағыты 5) активтендіру энергиясы
-
-
Нөлдік ретті реакцияның жылдамдығы тәуелді емес-
температураға -
реагенттердің табиғатына -
катализатордың болуына -
реагент концентрациясына
-
5) жоғарыда аталған факторлардың барлығына 7>7>0>0>0>1>0>
No table of contents entries found.
-
Химиялық кинетика зерттейді-
химиялық реакцияның жылдамдығын -
химиялық реакцияның жылу эффектісін -
реакцияның жүру мүмкіндігін -
еріткіш табиғатын -
еріген заттың табиғатын
-
-
aA + bB + cC = mM + nN реакциясы үшін тура реакцияның реттілігі тең:-
а -
a+b+c -
m+n -
b -
n
-
-
Нөлдік реакцияның кинетикалық теңдеуі-
w=kCA2 -
w =kC C
=kC C -
w=k -
w=kCACB
-
5) w=kCACDCC
-
aA + bB= cC +dD кері реакцияның реттілігі-
a+b -
ab -
c+d -
cd -
a+b+c+d
-
-
Нөлінші ретті реакция жылдамдығы анықталады-
w=kС -
w=k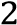
-
w=kС -
w=kС3 -
w=kС−2
-
-
СО+Cl2 = COCl2 реакциясы-
мономолекулалы реакция -
үшмолекулалы реакция -
бимолекулалы реакция -
бірінші ретті реакция
-
5) нөлінші ретті реакция
-
Бірнеше жылдамдық константасы бар жалпы жылдамдықпен анықталатын реакциялар
1) қарапайым
-
қайтымды -
күрделі
4) ферментативті
5) биохимиялық
-
Бірдей бастапқы заттар бір уақытта әрекеттесіп, әртүрлі өнімдер түзетін реакциялар аталады-
тізбекті -
параллель -
қайтымды
-
4) орайлас
5) тізбектелген
-
Бірінен соң бірі жүретін бірнеше кезеңнен тұратын реакциялар аталады 1) тізбекті 2) параллель
-
қайтымды -
орайлас -
тізбектелген
-
Бір химиялық реакцияның жүйеде екінші реакцияның жүруін туындататын құбылыс 1) катализ
-
тежелу -
химиялық индукция -
бастама 5) промотер
-
Бір мезгілде қарама-қарсы бағытта жүретін реакциялар аталады 1) тізбекті
2) параллель 3) қайтымды 4) орайлас
5) тізбектелген
-
Қай реакция үшін Вант-Гоффтың «Температураның әрбір 10 градусқа жоғарылауымен химиялық реакцияның жылдамдығы 2-4 есе артады» ережесі орындалмайды 1) ферментативті 2) бірінші ретті 3) нөлінші ретті 4) үшінші ретті 5) фотохимиялық
-
Өзі катализатор болып табылмайтын, бірақ катализаторға қосқанда активтілігін арттыратын зат аталады 1) промотор


