Файл: Отчет по лабораторной работе по физике студент Группа Факультет Преподаватель Барнаул 2022.docx
Добавлен: 17.10.2024
Просмотров: 11
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
∆????сл = ????????,???? ∗ ???? ????????,???? = 4,3
∆????сл1 = 4,3 ∗ 0,02 =0,086 ∆????сл1 = 4,3 ∗ 0,012 =0,052
∆????сл2 = 4,3 ∗ 0,011 =0,047 ∆????сл2 = 4,3 ∗ 0,024 =0,103
∆????сл3 = 4,3 ∗ 0,01 =0,043 ∆????сл3 = 4,3 ∗ 0,011 =0,047
∆????сл4 = 4,3 ∗ 0,009 =0,039 ∆????сл4 = 4,3 ∗ 0,012 =0,052
2
tср


 1 h r t 2
1 h r t 2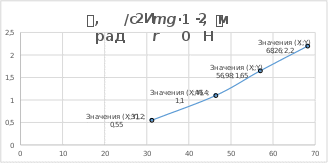
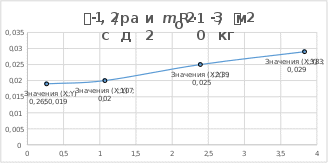
ВЫВОДЫ:
Основной закон динамики вращательного движения был экспериментально
подтвержден. Установлена функциональная зависимость углового ускорения
от момента сил и момента инерции.
Лабораторная работа №13
Таблица 1.
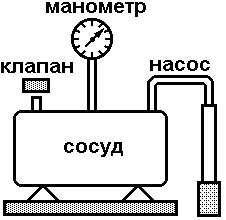
ОПИСАНИЕ УСТАНОВКИ
Схема установки представлена на рисунке 2. В сосуд насосом накачивают воздух, создавая давление выше атмосферного. Это состояние газа соответствует началу эксперимента, на графике (рис.3) это точка 1. При этом газ имеет параметры Р1, V1, T1.
| . | P V P V 1 1 P2 V2 или P12 V12 (14) | Рис. 2. Схема эксперимен-тальной установки. |
Б
 ыстрое расширение воздуха можно рассматривать как адиабатическое. Поэтому, открывая клапан сосуда на мгновение, в
ыстрое расширение воздуха можно рассматривать как адиабатическое. Поэтому, открывая клапан сосуда на мгновение, в течение которого давление внутри сосуда достигает атмосферного, мы можем считать, что газ перейдет в новое состояние, характеризуемое
величинами Р2, V2, T2 по адиабате (точка 2 на рисунке 3). Температура воздуха в сосуде после адиабатического расширения будет ниже
начальной. Параметры начального и конечного состояний воздуха в сосуде при адиабатическом процессе связаны уравнением Пуассона (уравнением адиабаты):
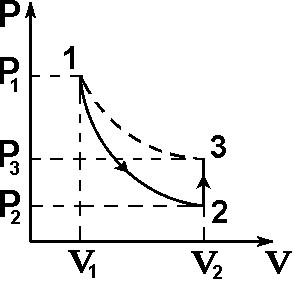
Рис. 3. Диаграмма процессов, происходящих с воздухом в сосуде.
Через несколько минут воздух в сосуде нагреется до температуры окружающей среды Т1.
Поскольку при этом V2 не изменяется, то давление повысится до Р3. Новое состояние воздуха характеризуется параметрами Р3, V2, T1 (точка 3 на рисунке 3). Сравнивая состояние воздуха в сосуде, соответствующее точкам 3 и 1 (рис.3), видим, что температура воздуха в этих точках одинакова. Тогда по закону Бойля – Мариотта:
P3 V1 . (15)
P3 V2 P1 V1 или P1 V2
Сравнивая уравнения (14) и (15) получим:
P2 P3
. (16)
P1 P1
Прологарифмировав уравнение (16), получим
 lnP2 lnP1 . (17) lnP3 lnP1
lnP2 lnP1 . (17) lnP3 lnP1 Условия эксперимента позволяют упростить формулу (17) следующим образом:
 P1 . (18)
P1 . (18) P1P3
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ И ЗАДАНИЯ
-
При закрытом клапане накачать воздух в сосуд так, чтобы измеряемое манометром избыточное давление стало равным 100 – 130 мм. рт. ст. -
Через некоторое время, когда давление перестанет падать записать в таблицу величину давления Р1. -
Открыть на мгновение клапан сосуда и когда стрелка манометра упадет до нуля быстро закрыть его. Через некоторое время, когда давление перестанет расти, записать величину давления Р3 в таблицу. -
Повторить пункты 1-3 пять раз. -
По формуле (18) рассчитать коэффициент Пуассона для каждого опыта. Вычислить среднее значение коэффициента Пуассона ср. -
Найти теоретическое значение коэффициента Пуассона теор для воздуха, считая его молекулы жесткими двухатомными (указание: воспользоваться определениями коэффициента Пуассона и молярных теплоемкостей при постоянном объеме и давлении).
-
Сравнить теоретическое и среднее экспериментальное значения коэффициента Пуассона, оценив теор ср величину относительного отклонения по формуле 100% .
теор Та блица 1
-
№ изм.
 Р1, мм. рт. ст.
Р1, мм. рт. ст.
Р3, мм. рт. ст.
ср
теор
δ , %
1
120
23
1,24
1,22
1,4
12,9
2
119
21
1,21
3
122
25
1,26
4
119
20
1,2
5
117
19
1,19
