ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.02.2024
Просмотров: 195
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Дәріс:14
Тақырыбы: p-элементтерге жалпы сипаттама. Алюминий.
Мақсаты: p – элементтерінің жалпы сипаттама: период және топ бойынша кейбір физикалық және химиялық қасиеттерінің өзгеру заңдылықтарымен таныстыру және олардың элемент атомдары құрылысымен таныстыру.
Жоспары:
-
р-элементтерге сипаттама -
Алюминий, қасиеттері, қосылыстары
р – элементердің сыртқы электрондық қабатында бірден алтыға дейін электрон болатыны белгілі. Периодтық жүйеде 30р элемент бар. Бұл р – элементтер немесе олардың ұқсастары ІІІА, ІVА, VА, VІа, VІІА, және VІІІА топшаларын құрайды. Сыртқы электрон қабаттарының құрылысы мынадай қатарда дамиды: ns2np1, ns2np2, ns2np3, ns2np4, ns2np5, ns2np6. Al басқа р – элементтердің тотықсыздандырғыштық белсендігі айтарлықтай нашар. Керісінше ІІІА-дан VІІА топшаға біртіндеп ауысқанда, бейтарап атомдардың тотықтырғыштық белсендігі артатыны байқалады, себебі р – элементтердің электртерістігі артады. р– элемент атомдарында тек р – электрондары ғана емес, сыртқы деңгейдің s – электрондары да валентті болып табылады. р – элементтердің жоғары оң тотығу дәрежесі өздері орналасқан топ нөмеріне сәйкес келеді. Периодтық жүйенің ІІІА топшасында кең таралған элементтер – В, Al, Ga, In, Tl. Олардың атомдарының сыртқы деңгейінде 3е s2p1 болады. Қозбаған күйде р – электрон ғана жұптаспаған. Бірақ бұл эелементтердің тотығу дәрежесі +3 .д. көрсетеді, өйткені электронды s-тен р-күйге ауыстыру үшін аз энергия қажет. Тек талий көбінсе +1т.д. тән. Бұл топшаның барлық элементерінің Э2О3 типті оксидтер түзуі көп мөлшерде жылу бөлумен жүреді. Э(ОН)3 типті екідайлы қасиет көрсететін гидроксидтер сәйкес келеді. В Al Ga In Tl
Оксидтер мен гидроксидтердің негіздік қасиеті күшейеді, қышқылдық қасиеті әлсірейді. Радиус артады; иондану энергиясы кемиді; электртерістігі кемиді; тотықсыздану қабілеті, яғни электрон беру қабілеті артады. Алюминий гидроксидінің екідайлық қаситеттері күшті, ал галий гидроксидінің екідайлық қаситеттері әлсіз, индий гидроксиді сілті ерітіндісінде өте қиын ериді, талий гидроксиді екідайлық қасите көрсетпейді. ЭХ3 типті қосылыстарда байланыс көрші 3 атоммен үш гибридтік орбитальдардың sp2 бүркесуі есеьінен жүзеге асырылады және мұндай молекулалар жазық үшбұрышты құрылыста болады. ІІІА топша элементтерінің металдық қаситеттерінің бір қалыпта өзгерісі байқалмайды. В-дан Al-ге өткенде металдық қасиет күрт күшейеді, Ga-де аздап әлсірейді де, қайтадан Tl өткенде біртіндеп өсе бастайды. Мұның себебі: Ga, In және Tl атомдарында (В және Al атомдарынан ерекшелігі) сырттан санағанда екінші деңгейде 18 электроннан болады.
Атом құрылысы. Алюминий – Д.И.Менделеев жасаған периодтық жүйеде ІІІ топтың негізге топша металдарының өкілі. Атомдық нөмірі 13, салыстырмалы атомдық массасы 26,98. Алюминийдің жалғыз тұрақты изотопы
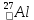 бар. Сыртқы электрондық қабатының құрылысы -
бар. Сыртқы электрондық қабатының құрылысы - 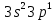 , осыған байланысты алюминий +3 тотығу дәрежесін көрсетеді.
, осыған байланысты алюминий +3 тотығу дәрежесін көрсетеді.Алюминийдің электрондық формуласы:
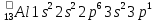 .
.Табиғатта таралуы. Белсенді болғандықтан алюминий табиғатта бос күйінде кездеспейді, ал қосылыстар құрамындағы алюминий – табиғатта, ең көп таралған металл (жер қыртысындағы жалпы мөлшері шамамен 9%). Ол силикаттардың құрамында (шпаттар, слюдалар), сондай – ақ далалық шпаттардың табиғи ыдырауы нәтижесінде оксиді корунд деп аталады. Алюминий қосылыстарының ішінде мына қосылыстардың маңызы өте зор:
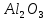 (корунд, рубин, сапфир), ортоклаз
(корунд, рубин, сапфир), ортоклаз 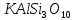 , нефелин
, нефелин 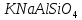 , криолит
, криолит 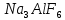 , боксит
, боксит 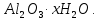
Алынуы. Алюминий өндірісінде, шикізат ретінде көбінесе бокситтер
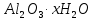 жиі қолданылады. Қыздырғанда олар суын жоғалтып, алюминий оксидіне айналады.
жиі қолданылады. Қыздырғанда олар суын жоғалтып, алюминий оксидіне айналады.Алюминий оксидінің балқу температурасы жоғары (2045°C) және ол электр тогын өткізбейді. Сондықтан
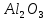 -ті фторидтерді қоса отырып (
-ті фторидтерді қоса отырып (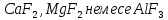 ), балқытылған криолитте
), балқытылған криолитте 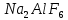 ерітеді. Бұл қоспа шамамен 1000°С температурада балқиды. Электролиз кезінде катодта – алюминий, ал анодта – оттек бөлінеді. Сұйық алюминий электролиздердің түбінде жиналады, оны бұл жерден мерзімінде шығарып отырады. Елімізде, Торғай кен орындағы бокситтен Павлодар қаласында электролиттік әдіс арқылы алюминийді алу үшін қажетті глинозем өндіретін, алюминий зауыты жұмыс істейді. Металл күйдегі алюминий алынатын электролиз цехтары салынып жатыр. Ол 2007 жылдан бастап өнім бере бастайды.
ерітеді. Бұл қоспа шамамен 1000°С температурада балқиды. Электролиз кезінде катодта – алюминий, ал анодта – оттек бөлінеді. Сұйық алюминий электролиздердің түбінде жиналады, оны бұл жерден мерзімінде шығарып отырады. Елімізде, Торғай кен орындағы бокситтен Павлодар қаласында электролиттік әдіс арқылы алюминийді алу үшін қажетті глинозем өндіретін, алюминий зауыты жұмыс істейді. Металл күйдегі алюминий алынатын электролиз цехтары салынып жатыр. Ол 2007 жылдан бастап өнім бере бастайды.Физикалық қасиеттері.
Алюминий – күмістей ақ түсті, жеңіл металл, бүйірлі орталықтанған торы бар: d = 2,7 г/с
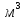 ,
, 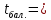 660,24°С,
660,24°С, 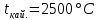 . Алюминийдің иілгіштік қасиеттері жоғары, ол оңай фольга болып жайылады және сым түрінде созылады. Алюминий жеңіл металға жатады және электрөткізгіштігі, жылуөткізгіштігі жоғары. Оның электрөткізгіштігі мыстың электрөткізгіштігімен шамалас. Өте жеңіл болғандықтан алюминий сымдарының көлденең қимасы үлкен болса да, массасы жағынан мыс сымдарынан жеңіл шасымен қапталған. Бұл қабықша оптикалық мөлдір және металдың шағылдырғыш қабілетін сақтайды.
. Алюминийдің иілгіштік қасиеттері жоғары, ол оңай фольга болып жайылады және сым түрінде созылады. Алюминий жеңіл металға жатады және электрөткізгіштігі, жылуөткізгіштігі жоғары. Оның электрөткізгіштігі мыстың электрөткізгіштігімен шамалас. Өте жеңіл болғандықтан алюминий сымдарының көлденең қимасы үлкен болса да, массасы жағынан мыс сымдарынан жеңіл шасымен қапталған. Бұл қабықша оптикалық мөлдір және металдың шағылдырғыш қабілетін сақтайды.Химиялық қасиеттері. Алюминий – белсенді металл. Алюминий атомының сыртқы электрондық қабатында үш электрон бар, бұл электрондарын оңай беріп, тотықсыздандырғыштық қасиеттер көрсетеді. Электрохимиялық кернеу қатарында алюминий темірдің алдында орналасқан, белсендігі жағынан сілтілікжер металдарға ұқсас. Оксидтік қабықша оттектің металға енуіне мүмкіндік бермейді. Егер қабықшаны алып тастаса, алюминий тез тотығады. Егер қорғағыш қабықшаны химиялық әдіспен аластатса (мысалы, сілті ерітіндісімен), онда металл сумен сутек бөліп, қарқынды әрекеттеседі:
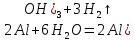
Алюминий ұнтағын қыздырғанда тұтынады және
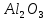 оксидін түзіп, өте жарық жалынмен жанады:
оксидін түзіп, өте жарық жалынмен жанады: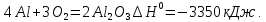
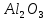 – тегі алюминий мен оттектің байланысты өте жоғары беріктігімен ерекшеленеді. Сондықтан алюминий көптеген металл оксидтерінен (темір, марганец, хром) оттекті тартып алады.
– тегі алюминий мен оттектің байланысты өте жоғары беріктігімен ерекшеленеді. Сондықтан алюминий көптеген металл оксидтерінен (темір, марганец, хром) оттекті тартып алады.Металл оксидтерін алюминиймен тотықсыздандыру алюмотермия деп аталады. Мысалы, егер алюминий ұндағын темір оксидімен
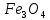 немесе FeO
немесе FeO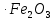 араластырып, қоспаны жақса, онда өте қарқынды реакция жүреді.
араластырып, қоспаны жақса, онда өте қарқынды реакция жүреді.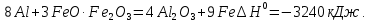
Бұл реакция жүрген кезде температура 2500°С – қа дейін жоғарылайды.
Алюминий галогендермен тікелей әрекеттесіп, галогенидтер түзеді:
Өте қатты қыздырған кезде ол күкіртпен, көміртекпен және азотпен әрекеттесіп, сульфид
 , карбид
, карбид 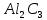 және нитрид ALN түзеді.
және нитрид ALN түзеді.Алюминий – екідайлы (амфотерлі, грек тілінен аударғанда “амфотерос”-екіжақты). Ол қышқылдармен де, сілтілермен де әрекеттесуге қабілетті (аммиак суынан басқа). Сұйылтылған тұз және күкірт қышқылдары оксид қабықшасын бұзып, сутекті ығыстырып, алюминийді оңай ерітеді:
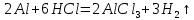
Екідайлы болғандықтан алюминий сілті ерітінділерімен де әрекеттеседі:
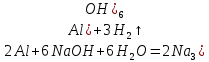
Салқын концентрлі азот қышқылында оксидтік қабықша бұзылмайды да алюминий ерімейді. Концентрлі азот және күкірт қышқылдарында алюминий қорғағыш қабықша түзілуі нәтижесінде енжарланады. Сондықтан азот қышқылын алюминий ыдыстарында сақтайды және тасымалдайды. Сұйытылған азот қышқылы алюминиймен әрекеттесіп , азот (II) оксидіне дейін тотықсызданады:
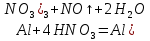
Алюминий оксиді
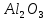 қиын балқитын, ақ түсті зат. Табиғатта корунд минералы түрінде кездеседі. Алюминий оксиді суда ерімейді. Екідайлық қасиеттер көрсетеді, негіздік қасиеттері қышқылдық қасиеттеріне қарағанда әлсіздеу:
қиын балқитын, ақ түсті зат. Табиғатта корунд минералы түрінде кездеседі. Алюминий оксиді суда ерімейді. Екідайлық қасиеттер көрсетеді, негіздік қасиеттері қышқылдық қасиеттеріне қарағанда әлсіздеу: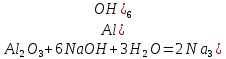
Алюминий гидроксидінің
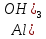 түр өзгерісі екі түрлі болуы мүмкін: кристалдық немесе аморфтық. Алюминий тұздары ерітінділерінен гидроксидін тұнбаға түсіргенде ақ қоймалжың аморфтық тұнба түрінде алынады.
түр өзгерісі екі түрлі болуы мүмкін: кристалдық немесе аморфтық. Алюминий тұздары ерітінділерінен гидроксидін тұнбаға түсіргенде ақ қоймалжың аморфтық тұнба түрінде алынады.Алюминий гидроксидін, алюминий тұздары ерітінділеріне сілтімен әсер ету арқылы алады:
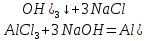
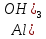 мүлдем суда ерімейді және типтік екідайлы гидроксид болып табылады. Қышқылдармен әрекеттесіп, ол алюминий катиондық компонент болып табылатын тұздары түзеді. Сілтілермен әсер еткенде алюминаттар – кешенді қосылыстар түзеді, мұнда алюминий анион құрамына кіреді:
мүлдем суда ерімейді және типтік екідайлы гидроксид болып табылады. Қышқылдармен әрекеттесіп, ол алюминий катиондық компонент болып табылатын тұздары түзеді. Сілтілермен әсер еткенде алюминаттар – кешенді қосылыстар түзеді, мұнда алюминий анион құрамына кіреді: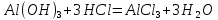
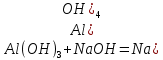
Алюминий гидроксидінің негіздік қасиеттері өті әлсіз көрінетіндіктен, алюминий тұздары сулы ерітінділерде жоғары дәрежеде гидролизге ұшырайды:
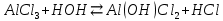
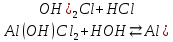
Алюминий тұздарын анықтау. Алюминий тұздарын сілтілермен сапалық реакция бойынша анықтауға болады. Бұл кезде алюминий гидроксидінің қоймалжың тұнбасы түзіледі. Тұнба сілтінің артық мөлшерінде ериді.
Қолданылуы. Алюминий техникада және тұрмыста кеңінен қолданылады. Жеңіл және бағалы қасиеттері бар құймалар алынатындықтан, оның авиациялық өнеркәсіпте, автокөлікте (автомобиль бөлшектерін дайындауда), электротехникада электр сымдарын жасау үшін, сонымен қатар жарылғыш заттарды алуда, химиялыұ аппаратураларды дайындауда, құрылыстар салуда, жиһаздар, ыдыстар және т.б. жасауда маңызы өте зор. Таза металл түрінде алюминийді химиялық аппаратураларла электр сымдарын дайындауда пайдаланады. Алюминий жұқа қаңылтыр (фольга) және конденсаторлар жасау үшін қолданылады. Алюминийді кабель, қаңылтыр және айна өндірісінде, ал шаңын “күміс сияқты” түс беру үшін бояу ретінде қолданады.
Алюминийдің қолданылатын маңызды аймағы – оның негізіндегі жеңіл құймалар өндірісі. Металдық алюминийді мыс, магний, титан, никель, мырыш, темір негізіндегі құймаларды легирлейтін қоспа ретінде кеңінен қолданады. Алюминий құймаларының жемірілуге тұрақтылығы төмен. Кең таралған құймалар силумин – алюминийдің кремниймен құймасы, дуралюмин – құрамына алюминиймен бірге магний, темір, мыс және марганец кіреді, магналий – алюминийдің магниймен құймасы. Бұл құймалардың барлығы жеңіл және берік. Силуминді негізінен құю үшін, ал дуралюминді және магналийді ұшақ, машина, кеме, ыдыстар жасауда қолданады. Алюминиймен темір бұйымдардың бетін қаптайды, бұл оларды жемірілуден қорғайды. Ол үшін болат бұйымды бірақ уақыт алюминий балқымасында ұстайды, бұл кезде беткі қабатта металмен құйма түзіледі. Металдарды тотығудан қорғаудың бұл әдісі алтирлеу деп аталады. Алюминий қосылыстары да көп қолданылады. Алюминий оксиді табиғатта қатты минерал корунд түрінде кездеседі, оны металдарды ыспалау үшін және жылтырату үшін абразивті материал ретінде қолданады. Табиғи немесе жасанды жолмен алынған

