ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.02.2024
Просмотров: 191
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Металдардың сыртқы энергиялық деңгейінде 1-ден 3-ке дейін электрон болады.Металдар периодтың басында және ортасында тұр, сондықтан олардың атомдарының радиустары салыстармалы түрде алғанда үлкендеу. Атом құрылысының ерекшеліктері, бұл элементтердің металдарға жататынын айқындайды.
Бейметалдар сыртқы электрондық қабатында 3-тен (борда) 7-ге дейін электрондар болуымен сипатталады. Атомдардың сыртқы электрондарының саны неғұрлым көбірек және атом радиусы кішірек болса, соғұрлым бейметалдық қасиеттері айқынырақ көрінеді. Ең белсенді бейметалдар—галогендер мен оттек. Атом құрылысы
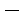 элементтер қасиеттерінің өзгеру заңдылықтарын айқындайды, периодта солдан оңға қарай металдық қасиеттер әлсіреп, бейметалдық қасиеттер күшейеді, негізгі топшаларда реттік нөмір өскен сайын металдық қасиеттер күшейеді де, бейметалдық қасиеттер әлсірейді.
элементтер қасиеттерінің өзгеру заңдылықтарын айқындайды, периодта солдан оңға қарай металдық қасиеттер әлсіреп, бейметалдық қасиеттер күшейеді, негізгі топшаларда реттік нөмір өскен сайын металдық қасиеттер күшейеді де, бейметалдық қасиеттер әлсірейді.Металдарға тән сипаттауыш қасиеттер олардың атомдары сыртқы электрондарын жеңіл беріп, оң зарядты иондарға айналуы болып табылады. Бейметалдар, керісінше теріс зарядты иондар түзіп, электрондарды қосып алу қабілетімен сипатталады, бірақ олар едәуір белсенді тотықтырғыштарға да электрондарын бере алады.
Атомдардың электрондарды беру немесе қосып алу қабілеттері көптеген жағдайларға байланысты:
-
ядро зарядының шамасына; -
атом радиусына; -
атомдардың иондану энергияларына және электрон тартқыштығына; -
элементтердің электртерістігіне.
0>
Дәріс:11
Тақырыбы: Металдардың электрохимиялық кернеу қатары. Металдардың химиялық қасиеттері. Тірі ағзалар үшін металдардың маңызы.
Мақсаты: Металдардың электрохимиялық кернеу қатары жайлы мағлұмат бере отырып, металдардың химиялық қасиеті жайлы оқушы білімдерін тереңдетіп, химиялық реакция теңдеулерін жаза білу.
Жоспары:
-
Металдардың электрохимиялық кернеу қатары. -
Металдардың химиялық қасиеттері. -
Тірі ағзалар үшін металдардың маңызы.
Металдардың химиялық қасиеттері олардың атомдарының құрылысына, атап айтқанда, атом радиусының үлкендеу, валенттік электрондарының аздау болатынына тәуелді. Реакция кезінде металл атомдары өздерінің валенттік электрондарын оңай береді, сөйтіп, оң зарядты катиондарға айналып тотығады:
Me0 – ne- = Me+n тотықсыздандырғыш
Ал тотықтырғыш қызметті металл атомдары берген электрондарды қосып алатын атомдар немесе иондар атқарады. Металдардың тотықсыздандырғыштық қабілеті бірдей емес. Мәселен, натрий оттекпен лезде әрекеттеседі, ал мыс оттекпен қыздырғанда ғана реакцияласады. Мәселен, тотияйынның CuSO4 ерітіндісіне батырылған темір шеге қызғылт түсті мыспен қапталады, ал темір сульфатының FeSO4 ерітіндісіне салынған мыс шеге өзгермейді. Мыспен салыстырғанда темірдің электрондары атомдардан оңай үзіледі, өйткені темір мыстан гөрі белсендірек элемент. Активтік қатар химияда — металдардың электролиттік ерітінділерінің электродтық потенциалының өсу реті бойынша орналасу тәртібі. Оны “ығыстыру қатары” деген атпен 1865 жылы орыс ғалымыН.Н.Бекетов (1827 — 1911) мынадай жүйемен ұсынды:
| Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au |
Бұл қатарда металдардың электрон беру, яғни тотықсыздандырғыш қасиеті солдан оңға қарай кемиді. Басқаша айтқанда әр металл өзінен кейінгілерін тұздар ерітіндісінен ығыстырып шығарады. Салыстыру үшін қатарға сутек те орналасқан. Активтік қатарда сутекке дейін орналасқан металдар сутекті қышқылдардан ығыстыра алады. Сутектен кейін тұрған мыс, сынап, күміс, платина және алтын қышқыл ерітінділерімен әрекеттеспейді, өйткені сутекті ығыстыра алмайды. Активтік қатарға сүйеніп, металл, тұз және қышқыл ерітінділерінің арасындағы реакциялардың жүру мүмкіндігін алдын-ала болжауға болады. Активтік қатар заңдылығы металды бос күйінде бөліп алуға және оны коррозиядан қорғауға мүмкіндік береді.
Металдардың көпшілігі химиялық активті элементтер болғандықтан жай және күрделі заттармен әрекеттеседі:
| Металдар - тотықсыздандырғыштар | |
| Қосылу реакциялары | Орынбасу реакциялары |
| Жай заттармен әрекеттесуі: а) оттекпен: 2Mg0 + O20 = 2Mg+2O-2 ә) күкіртпен: 2Al0 + 3S0 = Al2+3S3-2 б) галогендермен: 2Na0 + Cl20 = 2Na+Cl- | Күрделі заттармен әрекеттесуі: а) сумен: 2Li0 + 2H+OH = 2Li+OH + H20↑ ә) оксидтермен: Fe2+3O3-2 + 2Al0 = 2Fe0 + Al2+3O3-2 б) қышқылдармен: Zn0 + H2+SO3-2 = Zn+2SO4 + H20↑ в) тұздармен: Fe0 + Cu+2SO4 = Fe+2SO4 + Cu0 г) сілтілермен (екідайлы қасиет көрсететін металдар): 2Al0 + 6Na+OH = 2Na3Al+3O3 + 3H20↑ д) тотықтырғыш заттармен (H2SO4 конц. HNO3) Cu0 + 4HN+5O3 = Cu+2(NO3)2 + 2N+4O2 + 2H2O |
Орыс ғалымы Н.Н.Бекетов металдардың сулы ерітіндідегі тотықсыздандырғыш қабілетінің әртүрлі екендігін эксперимент жүзінде анықтай отырып, 1865 ж. Металдардың белсенділік қатарын ұсынды және бұл қатарға сутекті енгізді. Қазір оны металдардың электрохимиялық кернеу қатары деп атайды:
Li K Ca Na Mg Al Zn Cr Fe Ni Sn Pb H Cu Hg Ag Pt Au
Металдардың тотықсыздандырғыш қасиеті
артады ← → кемиді
Дәріс:12
Тақырыбы: І А топша элементтері. Жалпы сипаттама. Натрий
Мақсаты: Сілтілік металдар , атом құрылысы,қасиеттері, туралы білімді қалыптастыру; сілтілік металдардың электрондық формуласын құрастыра білу, жеке атомға сипаттама беру, қорытынды жасау,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту.
Жоспары:
-
Негізгі және қосымша топша элементтері -
І А топша элементтерінің жалпы сипаттамасы -
Натрий, қасиеттері
Барлық металдардың қасиеттері бірдей емес. Периодтық жүйенің негізгі және қосымша топшаларында орналасқан металдардың құрылысы әр түрлі, демек, қасиеттері де әр түрлі болады.
I – III топтың негізгі топша элементтері s-және p-топшаға жатады. Олардың сыртқы энергиялық деңгейінде 1s немесе 2s-электрон (I, II топтар) не 1p-электрон (III топ) болады.Химиялық әрекеттесу кезінде бұл металдар валенттік электрондарын жеңіл береді де, топ нөмірлеріне сәйкес +1, +2, +3 тұрақты тотығу дәрежелерін көрсетеді. s-элементтер — металдардың типтік өкілдері. Олармен периодтық жүйедегі (біріншіден басқасы) әрбір период басталады. P-элементтердің металдық қасиеттері едәуір әлсіз болады. Топтарда ядро заряды өсуіне және иондану энергиясы кемуіне орай, элементтердің металдық қасиеттері заңды күшейеді.
s-элементтер оттекпен негіздік сипаты бар
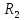 O (I топ) және RO (II топ) типті оксидтер түзеді. Бұл оксидтер сумен әрекеттесіп, гидроксидтер — негіздер ROH және R(OH)2 түзеді. Негіздердің күші — топта жоғарыдан төмен қарай металл атомы радиусының өсуіне сай артады. III топтың p-элементтері құрамы
O (I топ) және RO (II топ) типті оксидтер түзеді. Бұл оксидтер сумен әрекеттесіп, гидроксидтер — негіздер ROH және R(OH)2 түзеді. Негіздердің күші — топта жоғарыдан төмен қарай металл атомы радиусының өсуіне сай артады. III топтың p-элементтері құрамы 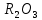 оксидтер түзеді, оларға R(OH)3 гидроксидтері сәйкес келеді. Топтағы қосылыстардың сипаты екідайлықтан негіздікке қарай өзгереді. Қосымша топша металдары негізгі топшалардың металдарынан құрылысы және қасиеттері бойынша ерекшеленеді.
оксидтер түзеді, оларға R(OH)3 гидроксидтері сәйкес келеді. Топтағы қосылыстардың сипаты екідайлықтан негіздікке қарай өзгереді. Қосымша топша металдары негізгі топшалардың металдарынан құрылысы және қасиеттері бойынша ерекшеленеді.Қосымша топша металдарының электрондық қауыздары (n - 1) d-деңгейше электрондармен толтырылады (n—период нөмірі), сондықтан бұл элементтерді d-элементтер деп те атайды. Қосымша топша металдарында байланыс түзуге s-электрондардан (сыртқы энергетикалық деңгей) басқа (n—1) d-электрондар да қатыса алады. d-электрондар да қатыса алады. s – электрондар байланысты оңай түзеді, сондықтан d – деңгейшеде электрон сандарының артуы қосылыстың қасиеттеріне аз ғана әсер етеді.
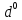 (d-орбитальда электрон жоқ),
(d-орбитальда электрон жоқ), 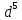 (d-орбитальдың жартысы толған) және ????10 (орбиталь толығымен толған) күйлері едәуір тұрақты болып табылады.
(d-орбитальдың жартысы толған) және ????10 (орбиталь толығымен толған) күйлері едәуір тұрақты болып табылады.Валенттік электрондардың санының көп болуына орай, d – элеметтің атомдары өзара көп химиялық байланыстар түзеді, соған байланысты едәуір бергірек кристалдық тор құрайды. Сондықтан қосымша топша металдарды ең берік және қиын балқитын заттар болып келеді. Беріктіктің максимумы конфигурациясы
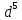 (d – орбитальдың жартысы толтырылған) элементтер кіретін VI топқа келеді. Хром,молибден және вольфрам – өз периодтарындағы ең қиын балқитын және берік металдар, d – элементтерге тән нәрсе, олардың қосылыстарында валенттік күйлері көп, соған байланысты қосылыстары қышқылдық-негіздік және тотығу – тотықсыздану қасиеттерін кең ауқымда көрсетеді. Егер әр түрлі тотығу дәрежелерін көрсететін элемент оксидтер және гидроксидтер түзетін болса, онда олардың тотығу дәрежелері – негіздіктен екідайылық арқылы қышқылдыққа өткенде заңды өзгереді. Мысалы, хром (№24) мынадай оксидтер түзеді: CrO – негіздік, Cr2O3 – екідайылық,
(d – орбитальдың жартысы толтырылған) элементтер кіретін VI топқа келеді. Хром,молибден және вольфрам – өз периодтарындағы ең қиын балқитын және берік металдар, d – элементтерге тән нәрсе, олардың қосылыстарында валенттік күйлері көп, соған байланысты қосылыстары қышқылдық-негіздік және тотығу – тотықсыздану қасиеттерін кең ауқымда көрсетеді. Егер әр түрлі тотығу дәрежелерін көрсететін элемент оксидтер және гидроксидтер түзетін болса, онда олардың тотығу дәрежелері – негіздіктен екідайылық арқылы қышқылдыққа өткенде заңды өзгереді. Мысалы, хром (№24) мынадай оксидтер түзеді: CrO – негіздік, Cr2O3 – екідайылық, 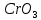 – қышқылдық. Сәйкес гидроксидтердің сипаты да осындай. Организмдердің тіршілігінде d – элементтердің маңызы ерекше. Олардың көбі (мыс, мырыш, кобальт, марганец, темір және т.б.) микроэлементтер болып табылады.
– қышқылдық. Сәйкес гидроксидтердің сипаты да осындай. Организмдердің тіршілігінде d – элементтердің маңызы ерекше. Олардың көбі (мыс, мырыш, кобальт, марганец, темір және т.б.) микроэлементтер болып табылады. Сілтілік металдардың атаулары сумен белсенді әрекеттескенде сілті түзуіне байланысты алынған. Сілтілік металдар ІА тобын түзеді. Бұл топқа алты металл: литий Li, натрий Na, калий К, рубидий Rb, цезий Cs, франций Fr жатады. Натрий және калий қосылыстары ерте кезден бері белгілі болған, бірақ бұл металдар жеке күйінде ағылшын химигі Г.Дэви және неміс химигі Р.Бунзен жұмыстарының нәтижесінде ХІХ ғасырда ғана алынған. № 87 элементтің болу мүмкіндігін Д.И. Менделеев болжап айтып, оны экацезий деп атаған. Бұл радиоактивті элементті 1938 ж. француз химигі М. Пере анықтаған және оны – өз отаны Францияның құрметіне франций деп атаған. Алғаш рет оны өте аз мөлшерде 1955 ж. жасанды алған. Натрий және калий (элементтердің таралуы бойынша Na – алтыншы, К – жетінші орында) табиғатта кең таралған: литий, рубидий, цезий – сирек элементтер, франций – жер қыртысында болмайтын радиоактивті элемент.
Атомдардың құрылысы. Олардың сыртқы энергетикалық деңгейлерінде бір-бірден электрон бар. Сондықтан натрий және калий, барлық басқа сілтілік металдар сияқты өздерінің валенттік электрондарын жеңіл береді, өте күшті тотықсыздандырғыштар және өздерінің периодтарында өте белсенді металдар (қосылыстарында тотығу дәрежесі +1) болады.
Элементтің реттік нөмірі артқанда:
a) ядродағы протондар және атом қауызындағы


