ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.02.2024
Просмотров: 192
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
электрондар саны артады;
ә) атомының жнергетикалық деңгейінің саны артады;
б) атомдық және иондық раидустары артады;
в) элементтердің электртерістігі кемиді.
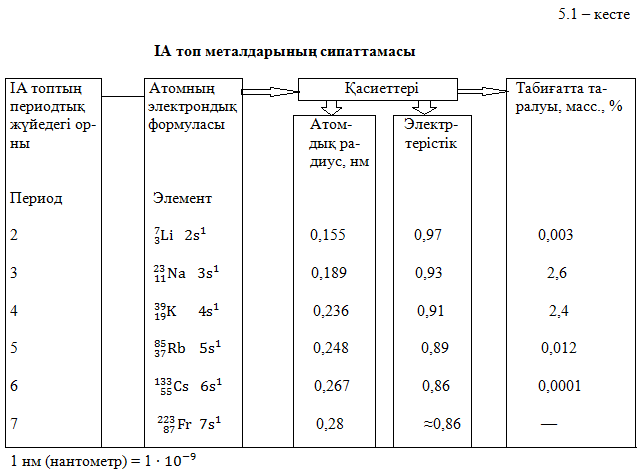
Ядродан қашықтау валенттік электронның ядромен байланысының әлсіреуіне әкеледі, сондықтан металдардың химиялық белсендігі, топта жоғарыдан төмен қарай өседі.
Табиғатта таралуы. Біздің планетамызда таралуы бойынша, натрий барлық элементтердің ішінен алтыншы орынды алады. Олардың үлесіне жер қыртысы массасының 2,64 % - і тиесілі.
Натрий табиғатта адамға ежелгі заманнан белгілі қосылыстар түрінде кездеседі. Жер қыртысында натрий даладық шпат және гранит құрамына кіреді. Тау жыныстары желдің әсерінен мүжілгенде, натрийдің ерімтал қосылыстары түзіледі және мұхиттарға дейін жетеді.
Мұхит суларында шамамен 2,8 % натрий хлориді бар, ішкі теңіздерде оның мөлшері одан жоғары (Өлі теңізде 7,9% NaCl бар). Ертеде, теңіз жағалауларынан байқалатын құбылыстарды, қазіргі кезде Каспий және Арал теңіздерінің жағалауларынан көруге болады. Саяз сулы шығанақ теңізден бөлінеді де, ондағы құрғақ климаттың салдарынан қарқынды булану жүреді және теңіз тұздары концентрленеді. Шығанақ тұзды көлге айналады. Осындай көлдерден жүз мыңдаған жылдар бұрын галит деп аталатын тас тұздардың шөгінділері түзілген.
Біздің елімізде көптеген тұзды көлдер мен тас тұздарының шөгінділері бар. Олар натрий хлоридін (NaCl) өндірудің көзі болып табылады. Оның ең мол қоры – Каспий ойпатында, Арал маңында, Ертіс өзенінің ағысында бар.
Қазақстанда Алматы, Қызылорда облыстардында мирабилиттің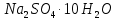 ірі кен орындары бар. Іле ойпаңында және Балқаш маңында содалық көлдер бар, оларда (судың құрамында) натрий карбонаты (
ірі кен орындары бар. Іле ойпаңында және Балқаш маңында содалық көлдер бар, оларда (судың құрамында) натрий карбонаты (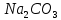 ) болады.
) болады.
Калий – табиғатта таралуы бойынша, жетінші элемент. Тас тұздардың шөгінділерінің жоғары қабатында калий тұздары болады. Калий қосылыстары өзіне тән өзіне тән өзгешеліктерімен ерекшеленеді – олар топыраққа жақсы сіңеді. Сондықтан теңіз суларында калий атомы натрийге қарағанда 50 есе аз болады. Құрғап қалған ертедегі көлдер мен теңіздер орындарынан сильвинит NaCl
KCl, сильвин KCl, карналиит
KCl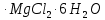 минералдарын өндіреді. Калий тұздарының кен орындары батыс Қазақстанда шоғырланған.
минералдарын өндіреді. Калий тұздарының кен орындары батыс Қазақстанда шоғырланған.
Na және K табиғи қосылыстарының тірі организмдерінің тіршілігі үшін маңызы ерекше. Натрий хлориді адам тағамы мен жануар азығының қажетті компоненті болып табылады. Организмде натрий және калий иондары үнемі қарама – қарсы бағыттарда көптеген биохимиялық реакцияларға қатысады. Калий иондары клетка функциясының процестеріне қатысады. Олар жетіспеген жағдайда бұл процестер бұзылады, сондықтан да адам сұйықтықпен бірге көп тұзды жоғалтқанда, оған тұзды су ішу ұсынылады.
Өсімдік тіршілігі үшін калийдің рөлі үлкен. Калий негізгі қоректік элементке жатады. Ол жетіспеген жағдайда өсімдік баяу өседі, тұқым онуін тоқтатады, жапырақтары сарғаяды, сабағы нәзік және жіңішке болады. Калий иондарының өсімдік клеткаларындағы көмірсулардың (қант және крахмал) синтезін белсендіретіні анықталды. Өсімдік жыл сайын топырақтан калийді көп мөлшерде сіңіреді, сондықтан да оның тұздарын егістікке минералды тыңайтқыш түрінде енгізеді. Өте кең таралған табиғи тыңайтқыштың бірі – ағаш күлі, онда сақар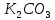 бар. Калий селитрасы
бар. Калий селитрасы 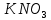 да бағалы тыңайтқыш болып табылады.
да бағалы тыңайтқыш болып табылады.
Физикалық қасиеттері. Сілтілік металдардың физикалық қасиеттері көбінесе, кристалдық тор құрылысының ерекшелігіне тәуелді (5.2-кесте). Олардың барлығы басқа типті торға қарағанда тығыздығы аздау кубтық көлемді центрлі тор типі бойынша кристалданады. Атомдық қабаттар мұндай кристалда бір-біріне қатысты өзара үш перпендикуляр бағытта сырғуы мүмкін, сондықтан сілтілік металдар өте иілгіш, жеңіл болып келеді.
Барлық сілтілік металдар күмістей ақ түсті (жаңадан кескен кезде), жұмсақ (литийден басқасы пышақпен кесіледі). Бұл металдар жеңіл балқиды. Балқу температурасы литийден цезийге (Cs қолдың жылуынан балқиды) қарай төмендейді, өйткені атомдардың шамасының артуынан кристалдық тордағы металл атомдарының байланыс энергиясы кемиді.
Бардық сілтілік металдар жылу мен электр тогын жақсы өткізеді.
Химиялық қасиеттері. Химиялық қасиеттері бойынша сілтілік металдар бір – біріне өте ұқсас. Олар – ең күшті тотықсыздандырғыштар және басқа металдарға қарағанда белсенділігі ең жоғарылар. Олардың тотықсыздандырғыштық белсенділігі Li – ден Cs – ге қарай өседі, өйткені кристалдағы химиялық байланыстық беріктігі және катиондардың түзілуі мен атомнан электронды үзіп алуға қажетті энергия кемиді.
Бұл процесті сызбанұсқамен былай жазады:
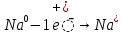
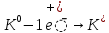
Бұл процестер өте жеңіл жүреді, бірақ калий – күшті тотықсыздандырғыш. Сілтілік металдар барлық бейметалдармен, сонымен қатар сумен, қышқылдармен әрекеттеседі:
0 0 +1 -1
2Na +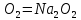
натрий пероксиді
+1 -1
(пероксидтер – сутек оксидінің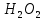 тұздары):
тұздары):
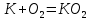
Калийнад пероксиді
0 0 +1 -2
2Na + S =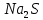
натрий сульфиді
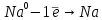 1 2 тотықсыздандырғыш
1 2 тотықсыздандырғыш
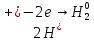 2 1 тотықтырғыш
2 1 тотықтырғыш
0 +1 +1 0
2Na +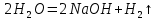
натрий гидроксиді
Бұл өте қауіпті реакция, сондықтан натрийдің сумен реакциясы үшін бұршақтан кіші металл кесегін алады. Суға салынған калий бірден тұтынады.
Натрий және калийдің тұздар мен қышқылдардың сулы ерітінділерімен әрекеттесуі де қауіпті. Бірінші кезекте, олар сумен әрекеттеседі. Қышқылдармен реакция өте шабытты жүреді, калийде қопарылыс беруі мүмкін:
K +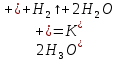
Сілтілік металдар табиғатта тек қана байланысқан қосылыс (хлоридтер, силикаттар, сульфаттар) түрінде кездеседі. Сілтілік металдардың жоғары реакциялық қабілетін ескеріп, оларды керосин немесе парафин майы (сұйық қаныққан көмірсутектердің қоспасы) қабатының астында сақтайды.
Натрий, калий және олардың қосылыстарын анықтау. Натрий иондары жалынды сары түске бояйды. Бұл реакция өте сезімтал. Платина сымды алақан бойымен жүргізіп, содан кейін оны жанарғы жалынында ұстағанда, сары түсті көруге болады. Калий және оның қосылыстары жалынды күлгін түске бояйды.
)
тұздарының болуымен байланысты. Мұндай кермектілікті суды қайнату арқылы кетіруге болады. Тұрақты (жойылмайтын) кермектік жалпы және жойылатын кермектіктердің айырымына тең. Қалдық (бейкарбонаттық) кермектік жалпы және карбонаттық кермектіктердің айырымына тең. Біздің елімізде судың кермектігі 1 дм3 судағы Са2+ мен иондарының миллиграмм-эквиваленттік мелшерімен көрсетіледі. Кермектіктің бір мг-экв-ті 20,04 мг/дм3 кальций мен 12,16 мг/дм3 магнийдің косындысына тең. Шетелдерде cудың кермектігі неміс (H°), француз (F°), ағылшын және американ (А°) градусымен өлшенеді. Осы өлшемдермен салыстырғанда 1 мг-экв - 2,8 Н°, 5,0 F°, 3,5 А° ағылшын, 50,0 А° американ градусына тең. Табиғи сулар кермектік дәрежесіне қарай бес топқа бөлінеді: өте жұмсақ су (1,5 мг-экв-ке дейін), жұмсақ су (1,5—3,0 мг-экв), орташа кермек су (3,0—6,0 мг-экв), кермек су (6,0—9,0 мг-экв) және өте кермек су (9,0 мг-экв-тен жоғары). Қазақстанда ауыз су ретінде жалпы кермектігі 7—20 мг-экв болатын жер асты сулары пайдаланылады.
Табиғи сулар кермектік дәрежесіне қарай:
болып бес топқа бөлінеді. Қазақстанда ауыз су ретінде жалпы кермектігі 7-20 миллиграм-эквивлентті табиғи сулар пайдаланылады.
ә) атомының жнергетикалық деңгейінің саны артады;
б) атомдық және иондық раидустары артады;
в) элементтердің электртерістігі кемиді.

Ядродан қашықтау валенттік электронның ядромен байланысының әлсіреуіне әкеледі, сондықтан металдардың химиялық белсендігі, топта жоғарыдан төмен қарай өседі.
Табиғатта таралуы. Біздің планетамызда таралуы бойынша, натрий барлық элементтердің ішінен алтыншы орынды алады. Олардың үлесіне жер қыртысы массасының 2,64 % - і тиесілі.
Натрий табиғатта адамға ежелгі заманнан белгілі қосылыстар түрінде кездеседі. Жер қыртысында натрий даладық шпат және гранит құрамына кіреді. Тау жыныстары желдің әсерінен мүжілгенде, натрийдің ерімтал қосылыстары түзіледі және мұхиттарға дейін жетеді.
Мұхит суларында шамамен 2,8 % натрий хлориді бар, ішкі теңіздерде оның мөлшері одан жоғары (Өлі теңізде 7,9% NaCl бар). Ертеде, теңіз жағалауларынан байқалатын құбылыстарды, қазіргі кезде Каспий және Арал теңіздерінің жағалауларынан көруге болады. Саяз сулы шығанақ теңізден бөлінеді де, ондағы құрғақ климаттың салдарынан қарқынды булану жүреді және теңіз тұздары концентрленеді. Шығанақ тұзды көлге айналады. Осындай көлдерден жүз мыңдаған жылдар бұрын галит деп аталатын тас тұздардың шөгінділері түзілген.
Біздің елімізде көптеген тұзды көлдер мен тас тұздарының шөгінділері бар. Олар натрий хлоридін (NaCl) өндірудің көзі болып табылады. Оның ең мол қоры – Каспий ойпатында, Арал маңында, Ертіс өзенінің ағысында бар.
Қазақстанда Алматы, Қызылорда облыстардында мирабилиттің
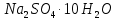 ірі кен орындары бар. Іле ойпаңында және Балқаш маңында содалық көлдер бар, оларда (судың құрамында) натрий карбонаты (
ірі кен орындары бар. Іле ойпаңында және Балқаш маңында содалық көлдер бар, оларда (судың құрамында) натрий карбонаты (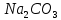 ) болады.
) болады.Калий – табиғатта таралуы бойынша, жетінші элемент. Тас тұздардың шөгінділерінің жоғары қабатында калий тұздары болады. Калий қосылыстары өзіне тән өзіне тән өзгешеліктерімен ерекшеленеді – олар топыраққа жақсы сіңеді. Сондықтан теңіз суларында калий атомы натрийге қарағанда 50 есе аз болады. Құрғап қалған ертедегі көлдер мен теңіздер орындарынан сильвинит NaCl

KCl, сильвин KCl, карналиит
KCl
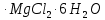 минералдарын өндіреді. Калий тұздарының кен орындары батыс Қазақстанда шоғырланған.
минералдарын өндіреді. Калий тұздарының кен орындары батыс Қазақстанда шоғырланған. Na және K табиғи қосылыстарының тірі организмдерінің тіршілігі үшін маңызы ерекше. Натрий хлориді адам тағамы мен жануар азығының қажетті компоненті болып табылады. Организмде натрий және калий иондары үнемі қарама – қарсы бағыттарда көптеген биохимиялық реакцияларға қатысады. Калий иондары клетка функциясының процестеріне қатысады. Олар жетіспеген жағдайда бұл процестер бұзылады, сондықтан да адам сұйықтықпен бірге көп тұзды жоғалтқанда, оған тұзды су ішу ұсынылады.
Өсімдік тіршілігі үшін калийдің рөлі үлкен. Калий негізгі қоректік элементке жатады. Ол жетіспеген жағдайда өсімдік баяу өседі, тұқым онуін тоқтатады, жапырақтары сарғаяды, сабағы нәзік және жіңішке болады. Калий иондарының өсімдік клеткаларындағы көмірсулардың (қант және крахмал) синтезін белсендіретіні анықталды. Өсімдік жыл сайын топырақтан калийді көп мөлшерде сіңіреді, сондықтан да оның тұздарын егістікке минералды тыңайтқыш түрінде енгізеді. Өте кең таралған табиғи тыңайтқыштың бірі – ағаш күлі, онда сақар
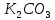 бар. Калий селитрасы
бар. Калий селитрасы 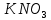 да бағалы тыңайтқыш болып табылады.
да бағалы тыңайтқыш болып табылады.Физикалық қасиеттері. Сілтілік металдардың физикалық қасиеттері көбінесе, кристалдық тор құрылысының ерекшелігіне тәуелді (5.2-кесте). Олардың барлығы басқа типті торға қарағанда тығыздығы аздау кубтық көлемді центрлі тор типі бойынша кристалданады. Атомдық қабаттар мұндай кристалда бір-біріне қатысты өзара үш перпендикуляр бағытта сырғуы мүмкін, сондықтан сілтілік металдар өте иілгіш, жеңіл болып келеді.
Барлық сілтілік металдар күмістей ақ түсті (жаңадан кескен кезде), жұмсақ (литийден басқасы пышақпен кесіледі). Бұл металдар жеңіл балқиды. Балқу температурасы литийден цезийге (Cs қолдың жылуынан балқиды) қарай төмендейді, өйткені атомдардың шамасының артуынан кристалдық тордағы металл атомдарының байланыс энергиясы кемиді.
Бардық сілтілік металдар жылу мен электр тогын жақсы өткізеді.
Химиялық қасиеттері. Химиялық қасиеттері бойынша сілтілік металдар бір – біріне өте ұқсас. Олар – ең күшті тотықсыздандырғыштар және басқа металдарға қарағанда белсенділігі ең жоғарылар. Олардың тотықсыздандырғыштық белсенділігі Li – ден Cs – ге қарай өседі, өйткені кристалдағы химиялық байланыстық беріктігі және катиондардың түзілуі мен атомнан электронды үзіп алуға қажетті энергия кемиді.
Бұл процесті сызбанұсқамен былай жазады:
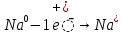
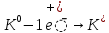
Бұл процестер өте жеңіл жүреді, бірақ калий – күшті тотықсыздандырғыш. Сілтілік металдар барлық бейметалдармен, сонымен қатар сумен, қышқылдармен әрекеттеседі:
0 0 +1 -1
2Na +
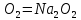
натрий пероксиді
+1 -1
(пероксидтер – сутек оксидінің
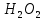 тұздары):
тұздары):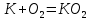
Калийнад пероксиді
0 0 +1 -2
2Na + S =
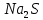
натрий сульфиді
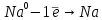 1 2 тотықсыздандырғыш
1 2 тотықсыздандырғыш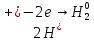 2 1 тотықтырғыш
2 1 тотықтырғыш0 +1 +1 0
2Na +
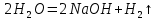
натрий гидроксиді
Бұл өте қауіпті реакция, сондықтан натрийдің сумен реакциясы үшін бұршақтан кіші металл кесегін алады. Суға салынған калий бірден тұтынады.
Натрий және калийдің тұздар мен қышқылдардың сулы ерітінділерімен әрекеттесуі де қауіпті. Бірінші кезекте, олар сумен әрекеттеседі. Қышқылдармен реакция өте шабытты жүреді, калийде қопарылыс беруі мүмкін:
K +
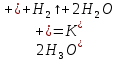
Сілтілік металдар табиғатта тек қана байланысқан қосылыс (хлоридтер, силикаттар, сульфаттар) түрінде кездеседі. Сілтілік металдардың жоғары реакциялық қабілетін ескеріп, оларды керосин немесе парафин майы (сұйық қаныққан көмірсутектердің қоспасы) қабатының астында сақтайды.
Натрий, калий және олардың қосылыстарын анықтау. Натрий иондары жалынды сары түске бояйды. Бұл реакция өте сезімтал. Платина сымды алақан бойымен жүргізіп, содан кейін оны жанарғы жалынында ұстағанда, сары түсті көруге болады. Калий және оның қосылыстары жалынды күлгін түске бояйды.
Өнеркәсіпте алынуы. Натрий өте белсенді тотықсыздандырғыш болғандықтан және өзінің сыртқы электронын жеңіл беретіндіктен, оның ионын бұл электронды қабылдауға көндіру өте қиын.
Сондықтан ғалымдар электр тогын қолдана бастаған ХІХ ғасырдың басында ғана натрийді бос күйінде алу мүмкін болды. 1807 ж. ағылшын ғалымы Г.Дэви металл натрийді натрий гидроксидінің балқымасын электролиздеу көмегімен алды. Қазір тұздардың балқымаларын электролиздеп, натрийді және басқа сілтілік металдарды да алады. Бұл әдіс Павлодар қаласының химия комбинатында қолданылды.
Калий мен натрий ауада жанғанда кәдімгі оксидтерге 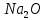 және
және 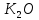 қарағанда құрамында оттек көбірек қосылыстар түзеді: 2Na +
қарағанда құрамында оттек көбірек қосылыстар түзеді: 2Na + 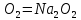 . Құрамында гидроксид ионының
. Құрамында гидроксид ионының 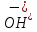 болуына байланысты сілтілердің ерітінділері сабын тәрізді сезіледі, олар теріні, матаны, қағазды (қолды,әсіресе көзді байқау керек) жеп жібереді.
болуына байланысты сілтілердің ерітінділері сабын тәрізді сезіледі, олар теріні, матаны, қағазды (қолды,әсіресе көзді байқау керек) жеп жібереді.
Натрий және калий гидроксидтері – негіздердің барлық қасиеттерін көрсетеді:
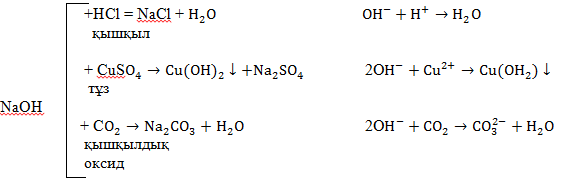
Натрий гидроксидінің техникалық атауы – күйдіргіш натр. Бұл химиялық өнеркәсіптің маңызы өнімі. Ол сабын, қағаз, жасанды талшық алу үшін, мұнай өнімдерін тазалауда бояу және дәрі – дәрмек алуда, сонымен бірге тұрмыста (каустикалық сода) қолданылады.
Калий гидроксиді – күйдіргіш калий едәуір күшті сілті, бірақ қымбат өнім болғандықтан сирек пайдаланылады. Ауада қатты күйінде NaOH және КОН ылғалды жақсы сіңіреді, сондықтан газдарды кептіру үшін қолданады.
Натрий мен калий барлық қышқылдармен тұздар түзіп әрекеттеседі. Натрий мен калийдің тұздары – түссіз, суда еритін заттар, оларды көбінесе техникада және тұрмыста қолданады.
NaCl – ас тұзы тамаққа қосылады. Ол консервілеуші зат, зең саңырауқұлақтары мен шіріткіш бактерияларды жояды. Натрий хлоридін көп мөлшерде химия өнеркәсібінде: натрий, хлор, натрий гидроксиді, сода алу үшін шикізат ретінде қолданады.
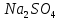 – натрий сульфатын шыны, сода өндіруде қолданады. Судағы ерітінділерінен медицина қолданылатын глаубер тұзы деп аталатын
– натрий сульфатын шыны, сода өндіруде қолданады. Судағы ерітінділерінен медицина қолданылатын глаубер тұзы деп аталатын 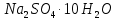 кристалгидрат бөлінеді.
кристалгидрат бөлінеді.
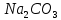 – натрий карбонаты, кальцийленген сода. Ол сабын қайнатуда, мата, тері, шыны, алюминий, дәрі – дәрмек өндірісінде қажет.
– натрий карбонаты, кальцийленген сода. Ол сабын қайнатуда, мата, тері, шыны, алюминий, дәрі – дәрмек өндірісінде қажет.
NaHC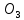 – натрий гидрокарбонатын тағам немесе ас содасы, медицина және кондитер өнеркәсібінде қолданады.
– натрий гидрокарбонатын тағам немесе ас содасы, медицина және кондитер өнеркәсібінде қолданады.
Калий тұздарын, негізінен, минералды тыңайтқыштар ретінде қолданады. Ағаш күлінде калий карбонаты 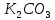 немесе сақар бар, сондықтан күл – бағалы калий тыңайтқышы. Бұрын күлді сода сияқты кір жуу үшін қолданған. Мұндай мүмкіндік натрий және калий карбонаттары суда гидролизденіп, сабындалатын ерітінді түзуіне байланысты болды. Олардың құрамында майларды ерітетін сілтілер бар.
немесе сақар бар, сондықтан күл – бағалы калий тыңайтқышы. Бұрын күлді сода сияқты кір жуу үшін қолданған. Мұндай мүмкіндік натрий және калий карбонаттары суда гидролизденіп, сабындалатын ерітінді түзуіне байланысты болды. Олардың құрамында майларды ерітетін сілтілер бар.
КN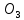 – калий немесе чили селитрасы күрделі тыңайтқыш, құрамында екі қоректік элекмент – азот және калий бар.
– калий немесе чили селитрасы күрделі тыңайтқыш, құрамында екі қоректік элекмент – азот және калий бар.
Дәріс:13
Тақырыбы: ІІ А топша элементтері. Кальций. Судың кермектігі.
Мақсаты: Кальцийдің периодтық жүйедегі орны, атом құрылысы, физикалық және химиялық қасиеттері туралы толық мәлімет беру. Оның қосылыстарының кластары туралы білімді тереңдетіп бекіту. Судың түрлері мен кермектілігіне тоқталу. Кермектілікті жоюдың жолдарын қарастыру.
Жоспары:
-
ІІ А топша элементтері
-
Кальций, қасиеттері, қолданылуы.
-
Судың кермектігі
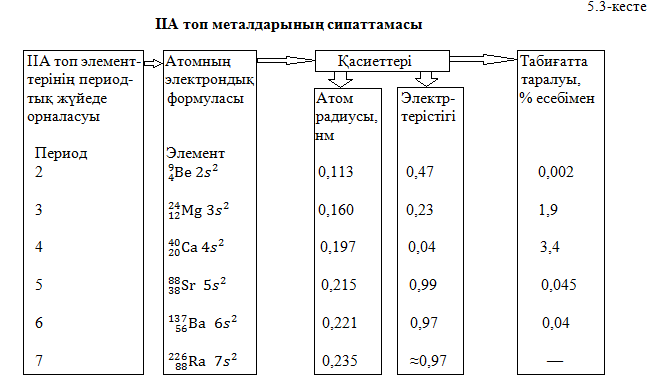
Бериллий Ве, магний Mg, кальций Са, стронций Sr, барий Ва және радий Ra периодтық жүйенің ІІА тобын түзеді. Соңғы төрт металл сілтілікжер металдар топшасын құрайды. Бұлай аталу себебі олардың оксидтері алхимия кезеңінде “жер” деп аталған, ал оларды суда еріткенде сілтілер алынған. Магний, кальций, стронций, барийді – таза күйінде ағылшын химигі Г.Дэви 1808ж., бериллийді – металл түрінде 1828 ж. неміс зимигі Ф.Вёлер, сондай – ақ радиоактивті металл радийді – 1910ж. француз химиктері П.Кюри мен М.Кюри алған.
Атомдардың құрылысы және химиялық белсенділігі. Бұл топшаның барлық өкілдері – s-элементтері (5.3 - кесте). Жай заттары – типтікметалдар. Бериллий топшасы элементтері атомдарының сыртқы деңгейінде екі электроннан бар. Оларды беріп қосылыстарында тұрақ +2 тотығу дәрежесін көрсетеді. Бұл элемент атомдарының құрылысы мынадай сызбанұсқамен берілген:
Mg Ca
Топшаның барлық металдары – күшті тотықсыздандырғыштар, бірақ сілтілік металдарға қарағанда едәуір әлсіздеу. Элементтің реттік нөмірі өскен сайын электрондардың берілуі жеңілдейді, сондықтан элементтердің металдық қасиеттері заңды өседі. Олар сілтілікжер металдарында анық көрінеді. Топшаның бірінші екі элементі қалған төрт металдан көп ерекшеленіп, басқаша жағдайға ие болады. Берилий өзінің кейбір қасиеттерімен алюминийге жақындайды.
Табиғатта таралуы. Табиғатта кальций және магний ғана көп, ал қалғандары аз таралған. Радий – сирек радиоактивті элемент. Кальций көп таралған элементке жатады. Жер қыртысындағы құрамы бойынша ол бесінші орында, оның массалық үлесі 3,4%. Табиғатта кальций қосылыстарын кез келген жерде кездестіруге болады: кальций тұздарынан таулы массивтер және сазды тау жыныстары түзілген, ол теңіз және өзен суларының, өсімдік және жануар организмдерінің құрамына кіреді. Адам организмінде сүйекте, тістің эмалінде, қанда 1 кг – ға дейін кальций болады.
Көп таралған қосылыстарының бірі – кальций карбонаты 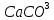 әр түрлі минералдар түзеді: бор, мәрмәр, әктас, ұлутас, маржан, перламутр және көптеген аралас металдар, олардың көпшілігі өте бағалы болып табылады.
әр түрлі минералдар түзеді: бор, мәрмәр, әктас, ұлутас, маржан, перламутр және көптеген аралас металдар, олардың көпшілігі өте бағалы болып табылады.
Табиғатта сонымен бірге гипс 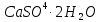 ,фосфориттер және апатиттер
,фосфориттер және апатиттер 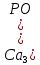 , флюорит
, флюорит 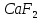 және т.б. түрінде кездеседі.
және т.б. түрінде кездеседі.
Қазақстан аумағында кальций қосылыстары көп таралған. Фосфориттердің ірі кен орындары – Қаратау тауларында және Ақтөбе облысында, ал бағалы қызғылт ұлутас кен орны – Маңғыстауда орналасқан. Гипсті Жамбыл облысында, цементтік саздарды Шымкент, Семей жағында өндіреді, көптеген әктас шөгіндісі, отқа төзімді саздар басқа облыстарымызда да кездеседі. Магний табиғатта таралуы бойынша сегізінші орында,массалық үлесі бойынша 1,9%. Ол 200-ге жуық минералдың құрамына кіреді. Олардың маңыздылары: магнезит MgC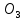 , доломит MgC
, доломит MgC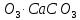 , карналит KCl
, карналит KCl 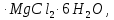 оливин
оливин 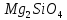 , асбест
, асбест
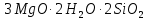 . Қазақстанда кеңінен қолданылатын ақ мәрмәр – Алматы облысында, Екпінді кен орнында өндіріледі. Елімізде доломиттің және басқа минералдардың, әсіресе асбестің, едәуір қоры бар. ТМД бойынша ең ірі асбест кен орны – Жітіқара, біздің республикамызда орналасқан. Магнийдің көп мөлшері – мұхит, теңіз және тұзды көлдердің суларында бар. Орташа есеппен 1
. Қазақстанда кеңінен қолданылатын ақ мәрмәр – Алматы облысында, Екпінді кен орнында өндіріледі. Елімізде доломиттің және басқа минералдардың, әсіресе асбестің, едәуір қоры бар. ТМД бойынша ең ірі асбест кен орны – Жітіқара, біздің республикамызда орналасқан. Магнийдің көп мөлшері – мұхит, теңіз және тұзды көлдердің суларында бар. Орташа есеппен 1  суда 1 кг шамасында магний болады. Магний шикізаты жоқ кейбір елдерде теңіз суынан магний өндіру жолға қойылған. Магний атомы – жасыл өсімдіктердің хлорофилінің құрамды бөлігі. Оның қатысуынсыз фотосинтез процесі жүруі мүмкін емес, яғни біздің ғаламшарда тіршілік болмайды. Адам организміне Mg өте қажет. Ол жеткіліксіз болғанда жүрек бұлшық етінің жұмысы бұзылады.
суда 1 кг шамасында магний болады. Магний шикізаты жоқ кейбір елдерде теңіз суынан магний өндіру жолға қойылған. Магний атомы – жасыл өсімдіктердің хлорофилінің құрамды бөлігі. Оның қатысуынсыз фотосинтез процесі жүруі мүмкін емес, яғни біздің ғаламшарда тіршілік болмайды. Адам организміне Mg өте қажет. Ол жеткіліксіз болғанда жүрек бұлшық етінің жұмысы бұзылады.
Физикалық қасиеттері. Сілтілікжер металдар физикалық қасиеттері бойынша сілтілік металдарды еске түсіреді. Бұл топтың элементтері атомдарының радиустары кішілеу және кристалдарында өзара берік байланысқан. Сондықтан олар едәуір қатты, балқу температурасы жоғары және тығыздығы үлкен. Бұл топша металдарының физикалық қасиеттері, негізінен, олардың кристалдық торлары қандай құрылысты екеніне тәуелді. Бериллий және магнийдің тығыз гексагональды кристалдық торы бар, сондықтан олар қатты, пластикалығы төмен. Кальций, стронций және барий кубтық торының типтері бойынша құрылған, сондықтан пластикалығы басым. Бұл металдардың барлығы жеңіл металдарға жатады.
ІІ топтың негізгі топша элементтерінің атомдарынан түзілген металдардың қасиеттері
Химиялық қасиеттері. Берилий топшасының металдары химиялық белсенді элементтер. Бұл металдар тотықсыздандырғыштар ретінде екі валенттік электрондарды беріп, тотығу дәрежесі +2 бөлшектерге айналады:
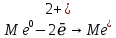
Олар ауада тотығады, бұл кезде RO типті оксидтер алынады, оларға R(OH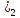 типті гидроксидтер сәйкес келеді. Гидроксидтердің негіздік сипаты мен ерігіштігі Ве – ден
типті гидроксидтер сәйкес келеді. Гидроксидтердің негіздік сипаты мен ерігіштігі Ве – ден
Ва – ға қарай өседі. ВеО және Ве(OH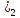 – екідайлы қосылыстар.
– екідайлы қосылыстар.
Бұл металдардың тотықсыздандырғыштық белсенділігі оттекпен әрекеттескенде көрінеді. Егер Ве және Mg оларды одан әрі тотығудан қорғайтын тұрақты оксидтік қабықшамен қапталса, Са, Sr және Ва оттекпен белсенді қосылып, оксидтер түзеді.
Кальцийді ауада қыздырғанда жанады, содан кейін таза оттекке апарғанда ақ түтін немесе кальций оксидінің бөлшегін түзіп, ашық жалынмен жанады:
0 0 +2 -2
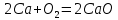
Егер ауада магний ұнтағын немесе жұқа магний лентасын жақса, онда көз қаратпайтын ұшқынмен жанады. Бұрын магнийдің бұл қасиеті фотографияда (магний жарқылы) қолданылған, қазір жарық шығаратын зымырандарда, әскери техникада қолданылады.
Жеңіл тотығатындықтан, оларды сілтілік металдар сияқты, керосин қабатының астында сақтайды. Барлық металдарды оттекпен қыздырғанда жақсы жанады.
Металдардың тотықсыздандырғыштық қабілетінің өсуін олардың сумен әрекеттесуінде бақылауға болады. Мәселен, берилий жоғары температурада ғана сумен тотығады, металдың бетінде түзілген металл гидроксиді Ве(OH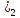 , оны одан әрі тотығудан қорғайтын тығыз қабықша болып табылады. Магний кәдімгі температурада баяу тотығады. Келесі металдар – кальций, стронций және барий сумен жақсы әрекеттеседі.
, оны одан әрі тотығудан қорғайтын тығыз қабықша болып табылады. Магний кәдімгі температурада баяу тотығады. Келесі металдар – кальций, стронций және барий сумен жақсы әрекеттеседі.
Сілтілік металдар сияқты Са сумен шабытты әрекеттесіп, одан сутекті ығыстырып шығарады. Бұл кезде кальций гидроксидінің лай ерітіндісі түзіледі:
0 +1 +2 0
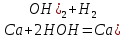
Суық сумен магний өте баяу әрекеттеседі, өйткені бұл кезде түзілетін Mg(OH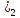 нашар ериді. Қыздырғанда Mg(OH
нашар ериді. Қыздырғанда Mg(OH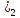 - нің еруі есебінен реакция жылдамдайды.
- нің еруі есебінен реакция жылдамдайды.
380°С – тан жоғары қыздырылған су буымен реакция шабытты жүреді:
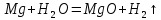
Бұл металдар қышқылдар құрамындағы сутекпен тотығуы мүмкін:
0 +1 +2 0
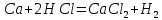
Бұл металдардың гидроксидтерінің қасиеттері бойынша бірінен – бірі заңды ерекшеленеді. Мәселен, Ве(ОН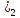 мүлдем суда ерімейді, Mg(OH
мүлдем суда ерімейді, Mg(OH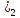 аздап ериді, қалған гидроксидтердің ерігіштігі мына қатарда өседі:
аздап ериді, қалған гидроксидтердің ерігіштігі мына қатарда өседі:
Са(OH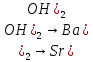
Бұл металдардың атомдары жалынды әр түрлі түстерге бояйды. Кальций жалынның түсін сарғыш, барий – жасыл, стронций – қызыл түске өзгертеді. Сондықтан бұл металдардың тұздары – пиротехникада фейерверк жасағанда және салют атуда қолданылады.
Табиғатта бұл металдардың бір-бірінен өте күшті айырмашылығы бар. Магний және кальций жер бетіндегі “тіршілік элементтері” қатарына кіреді, ал олардың топшадағы көршілері – берилий, стронций және барий тірі организмдер үшін қауіпті. ІІ негізгі топша металдарының ішінде кальций және магнийдің маңызы ерекше. Маңызды қосылыстары. Кальций оксиді – ақ түсті, қиын балқитын зат. Техникада СаО өндірілмеген әк деп аталады. Оны жоғары температурада (шамамен 1000°С-та) әктасты қыздырып (күйдіріп) алады:
СаС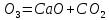 ∆
∆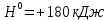 .
.
Кальций оксиді – типтік негіздік оксид.
Кальций – сілтілікжер металы, сондықтан оның оксиді сумен жеңіл әрекеттесіп, сілті – кальций гидроксидін түзеді:
СаО + 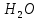 = Ca(OH
= Ca(OH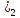 ∆
∆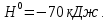
Бұл реакция өте шабытты жүреді, су қайнап, тіпті оның біраө бөлігі буға айналады. Сөндірілген әк деп аталатын ақ борпылдақ ұнтақ түзіледі.
Кальций гидроксиді суда аз ериді, оның қаныққан ерітіндісі лабораторияда әк суы деген атпен кеңінен қолданылады. Ерітіндіде кальций гидроксиді толығымен иондарға диссоциацияланады:
Са(OH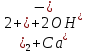
Сілтілік ерітінді фенолфталеиннің таңқурай түсімен анықталады. Кальций гидроксиді қышқылдармен және қышқылдық оксидтермен бейтараптанады. Лабораторияда көмірқышқыл газын анықтау үшін қолданылады. Егер көмірқышқыл газын әк суы арқылы өткізсе, онда алдымен лайланады:
Ca(OH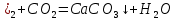
Газды одан әрі жібергенде лайлану тоқтайды, өйткені ерімейтін қалыпты тұз суда еритін қышқыл тұзға ауысады:
CaC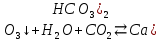
Судағы Са(ОН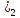 қатты жүзгіннің сыртқы түрі сүтке ұқсайды, ол техникада әк сүті деп аталады. Сөндірілген әк құрылыста кеңінен қолданылады. Әк сүті әктеу үшін, ал сөндірілген әктің құммен және сумен қоспасы кірпіш қалауда және сылақта байланыстырушы зат ретінде қолданылады. Бұл қоспа көмірқышқыл газымен әрекеттесудің салдарынан және қатты карбонат СаС
қатты жүзгіннің сыртқы түрі сүтке ұқсайды, ол техникада әк сүті деп аталады. Сөндірілген әк құрылыста кеңінен қолданылады. Әк сүті әктеу үшін, ал сөндірілген әктің құммен және сумен қоспасы кірпіш қалауда және сылақта байланыстырушы зат ретінде қолданылады. Бұл қоспа көмірқышқыл газымен әрекеттесудің салдарынан және қатты карбонат СаС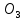 түзілетіндіктен ауада біртіндеп қатады:
түзілетіндіктен ауада біртіндеп қатады:
t°
Ca(OH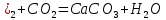
әк сүті
Кальций қосылыстарының сумен химиялық байланысып, кристалгидраттар түзу қабілетін құрылыста жиі пайдаланады. Мысалы, табиғи гипсті 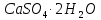 өңдегенде кристалдың судық бірақ бөлігін жоғалтады:
өңдегенде кристалдың судық бірақ бөлігін жоғалтады:
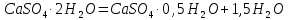
гипс алебастр
Алебастр ұнтағын сумен арастырғанда кері реакция жүреді, ол 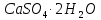 түзілетіндіктен қатады. Гипстің бұл қасиеті құрылыста ғана емес, сонымен қатар жапсырма әшекейлер, мүсіндер жасауда және медицинада қолданылады.
түзілетіндіктен қатады. Гипстің бұл қасиеті құрылыста ғана емес, сонымен қатар жапсырма әшекейлер, мүсіндер жасауда және медицинада қолданылады.
Барлығыңа белгілі цемент кальций силикатынан және алюминатынан тұрады. Бұл тұздарды құммен және сумен араластырғанда қатады. Өйткені түзілген кристалдар өзара бірігіп, берік материал түзеді.
Магний оксиді MgO (магнезия) – ақ түсті, жеңіл, борпылдақ ұнтақ, суды оңай сіңіреді. Оның спорттық гимнастикада қолданылуы осы қасиетіне негізделген. Спортшының алақанына жағылған ұнтақ оны гимнастикалық снарядтан ұшып кету қауіптілігін сақтайды.
MgO және Mg(OH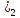 –күшті орташа, негіздік сипаттағы типтік қосылыстар. Табиғи магний карбонаттары – магнезим және доломит отқа төзімді және құрылыс материалдарын дайындау үшін қолданылады.
–күшті орташа, негіздік сипаттағы типтік қосылыстар. Табиғи магний карбонаттары – магнезим және доломит отқа төзімді және құрылыс материалдарын дайындау үшін қолданылады.
Магний сульфаты (ащы немесе ағылшын тұзы - 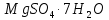 ) – медицинада, қағаз өндірісінде және жанбайтын материалдар алу үшін пайдаланады. Табиғи магний силикаты – асбет бұл табиғи талшықты, минералды заттың сирек мысалы. Ол жылуды оқшалау үшін жанбайтын маталар алу үшін қолданылады (5.3-сурет).
) – медицинада, қағаз өндірісінде және жанбайтын материалдар алу үшін пайдаланады. Табиғи магний силикаты – асбет бұл табиғи талшықты, минералды заттың сирек мысалы. Ол жылуды оқшалау үшін жанбайтын маталар алу үшін қолданылады (5.3-сурет).
Судың құрамында кальций және магний тұздары болса, онда ол кермек суға жатады. Кальций және магний тұздарымен табиғаттағы көптеген маңызды процестер байланысты. Бұл процестердің моделі жоғарыда қарастырылған кальций карбонатының гидрокарбонатқа және керісінше айналу реакциясы. Жаңбыр және басқа табиғи сулар ауадағы көмірқышқыл газын ерітіп, көмір қышқылын түзеді:
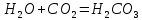
Қышқылдың ерітіндісі топыраққа сіңіп, жолындағы әктас, магнезит, доломит шөгінділерін ерітіп, карбонаттарға және гидрокарбонаттарға айналдырады. Гидрокарбонаттар шайылып нәтижесінде тау жыныстарының қабатында ірі бос орын (карст үңгірлер) түзіледі. Кальций және магний гидрокарбонаттарының ерітінділері баяу ыдырайды, ал қыздырғанда бұл процесс күшейеді:
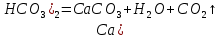
Түзілген карбонаттардан үңгір ішінде, тұздардың ірі кристалдары ерекше әдемі болып қалыптасады. Бағана, ине, сүңгі түрінде төбеден сталактиттер, ал еденнен сталагмиттер өсіп шығады. Табиғи сулардың құрамындағы кальций және магний гидрокарбонаттары су қоймасына түседі. Сонда олар ыдырайды немесе көптеген тірі организмдердің қаңқасын, бақалшағын, сауытын құруға қатысуы мүмкін. Осындай организмдер тіршілігін жойғаннан кейін қалдықтары су қоймаларының түбінде жиналады.Олардың қаңқаларынан (сүйектері) жүздеген жылдардан кейін ұлутас, бор және басқа минералдардың шөгінділері түзіледі. Табиғатта минералдардың ауысуы осылай жүреді де, жер қыртысында бос саңылаулар, ойыс жерлер және жаңа шөгінділер түзіледі. Карбонаттардың гидрокарбонаттарға және керісінше айналу процестері атмосферада көмірқышқыл газының құрамын тұрақты (ауада 0,3% С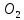 ) ұстап тұруда үлкен рөл атқарады. Егер атмосферада С
) ұстап тұруда үлкен рөл атқарады. Егер атмосферада С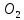 құрамы жоғарыласа, мұхиттық карбонаттар оны байланыстырып, еритін тұздарға айналады. Егер көмірқышқыл газы азайса, онда мұхитта гидрокарбонаттардың С
құрамы жоғарыласа, мұхиттық карбонаттар оны байланыстырып, еритін тұздарға айналады. Егер көмірқышқыл газы азайса, онда мұхитта гидрокарбонаттардың С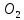 -ні бөліп, ыдырауы басталады да, ерімейтін карбонаттар тұнбаға түседі.
-ні бөліп, ыдырауы басталады да, ерімейтін карбонаттар тұнбаға түседі.
Cудың кермектігі— құрамында кальций (Са2+) мен магний (Мg2+) иондарының болуынан қалыптасатын судың қасиеті. Cудың кермектігі көрсеткіші 1 литр судағы миллиграм-эквивалентпен (мг-экв/л), кей елдерде градуспен өлшенеді. Табиғи сулардың кермектігі өте кең ауқымда ауытқиды: тайга мен тундра белдеміндегі өзен, көлдерде 0,1-0,2 мг-экв/л-ден кейбір жер асты сулары мен мұхит, теңіз суларында 80-100 мг-экв/л-ге дейін. Кермек су тұщы болса да, нашар сабындалады, бу қазандықтарының қабырғаларына тат түзеді, қант, былғары және басқа да көптеген өнеркәсіп салаларында пайдалануға жарамайды. Cудың кермектігі анықтамасы бойынша: жалпы, уақытша (жойылатын), тұрақты, карбонаттық, қалдық болып бөлінеді. Жалпы кермектік суда кальций мен магнийдің барлық тұздарының болуынан қалыптасады. Уақытша және карбонаттық кермектік онда кальциймен магнийдің тек гидрокарбонаттық (HCO3)және карбонаттық (СО32
)
ІІ А топша элементтері
Кальций, қасиеттері, қолданылуы.
Судың кермектігі
тұздарының болуымен байланысты. Мұндай кермектілікті суды қайнату арқылы кетіруге болады. Тұрақты (жойылмайтын) кермектік жалпы және жойылатын кермектіктердің айырымына тең. Қалдық (бейкарбонаттық) кермектік жалпы және карбонаттық кермектіктердің айырымына тең. Біздің елімізде судың кермектігі 1 дм3 судағы Са2+ мен иондарының миллиграмм-эквиваленттік мелшерімен көрсетіледі. Кермектіктің бір мг-экв-ті 20,04 мг/дм3 кальций мен 12,16 мг/дм3 магнийдің косындысына тең. Шетелдерде cудың кермектігі неміс (H°), француз (F°), ағылшын және американ (А°) градусымен өлшенеді. Осы өлшемдермен салыстырғанда 1 мг-экв - 2,8 Н°, 5,0 F°, 3,5 А° ағылшын, 50,0 А° американ градусына тең. Табиғи сулар кермектік дәрежесіне қарай бес топқа бөлінеді: өте жұмсақ су (1,5 мг-экв-ке дейін), жұмсақ су (1,5—3,0 мг-экв), орташа кермек су (3,0—6,0 мг-экв), кермек су (6,0—9,0 мг-экв) және өте кермек су (9,0 мг-экв-тен жоғары). Қазақстанда ауыз су ретінде жалпы кермектігі 7—20 мг-экв болатын жер асты сулары пайдаланылады.
Табиғи сулар кермектік дәрежесіне қарай:
-
өте жұмсақ су (1,5 миллиграм-эквивлентке дейін) -
жұмсақ су (1,5-3,0 миллиграм-эквивлентті) -
орташа кермек су (3,0-6,0 миллиграм-эквивлентті) -
кермек су (6,0-9,0 миллиграм-эквивлентті) -
өте кермек су (9,0 миллиграм-эквивленттен жоғары)
болып бес топқа бөлінеді. Қазақстанда ауыз су ретінде жалпы кермектігі 7-20 миллиграм-эквивлентті табиғи сулар пайдаланылады.


