ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.02.2024
Просмотров: 199
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Физикалық қасиеттері. Азотпен салыстырғанда фосфор элементінің бейметалдық қастеттерінің кеміуі , түзетін жай заттардың қасиеттеріне әсер етеді. Мәселен , азоттан ерекшілігі фосфордың бірнеше аллотропиялық түр өзгеріс бар; ақ, қызыл, қара және т.б. Олармен бұрын танысқансындар. Фосфордың аллотропиялық түр өзгерістерінің қасиеттері, олардың құрылысымен түсіндіріледі. Ақ фосфордың құрылысы, толығырақ зерттелген. Оның молекулалық кристалдық торы бар. Ақ фосфордың молекуласы төрт атомды және дұрыс үш қырлы пирамида тәріздес .Фосфордың әрбір атомы пирамиданың төбелерінде орналасқан . Кристалдық торлары молекулалық типке жататын басқа заттар сияқты ақ фосфор жеңіл балқиды және ұшқыш.
Химиялық қасиеттері. Ақ фосфор қызыл фосфордан химиялық қасиеттері бойынша, едәуір ерекшеленеді. Мәселен , ақ фосфор ауада жеңіл тотығады және өздігінен тұтығады,бірақ 240 градустан жоғары қыздырғанда тұтанады. Ақ фосфор тотыққанда қараңғыда жарық шығарады- химиялық энергияның тікелей жарық энергиясына жарық шығарады.
Сұйық және еріген күйде , сондай - ақ 800- градустан төмен температурада, бу күйінде фосфор Р молекуласынан тұрады. 800 градустан жоғары температурада қыздырғанда , молекула диссоцияланады;
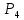 ⇆ 2
⇆ 2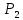
Соңғысы 2000 градустан жоғары температурада атомдарға ыдырайды. Осылай фосфор атомдары
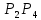 молекулаларына және полимерлі затқа бірігеді. Фосфор көптеген жай заттармен оттекпен, галогендермен, күкіртпен және кейбір металдармен, қышқылдармен, негіздермен тотықтырғыш және тотықсыздандырғыш қасиеттер көрсетіп қосылады. Мысалы;
молекулаларына және полимерлі затқа бірігеді. Фосфор көптеген жай заттармен оттекпен, галогендермен, күкіртпен және кейбір металдармен, қышқылдармен, негіздермен тотықтырғыш және тотықсыздандырғыш қасиеттер көрсетіп қосылады. Мысалы;2P + 3S =
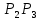
2P + 3CL ⇾ PCL
PCL3 + CL 2
 PCL5
PCL52P + 3Ca = Cа3P 2
Қызыл фосфорға қарағанда ақ фосформен реакция жеңіл жүреді. Фосфордың металдармен қосылысы фосфодтер деп аталады, олар суда жеңіл айырылып сарымсақ иісті , өте улы тұрақсыз газ фосфин PH 2 түзеді.
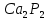 +
+ 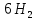 O = 3 Ca(OH )2 + 2P
O = 3 Ca(OH )2 + 2P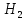
↑
Алынуы және қолданылуы. Фосфорды апетиттен немесе фосфориттен аталады. Соңғысын көмірмен (кокспен) және құммен араластырып , 1500 градустан электр пешінде қыздырады;
2Ca 3 (PO4) + 10C + 6 SiO 2 = 6CaSiО 3 + P 4 + 10CO↑
Мұндай фосфорды негізінен, фосфор қышқылы өндірісінде қолданады, ал оның негізінде фосфор тыңайтқыштары алынады.
Қызыл фосфордың бертолле тұзымен қоспасы , әлсіз үйкелісте немесе қысқасында тұтанады;
6P + 5KCIO3 = 5KCI + 3P 2 O2
Сондықтан қызыл фосфорды ,негізінен бұрынғы ақ фосфордың орнына сірінке өндірісінде қолданылады. Фосфор өсімдіктің тіршілігі үшін қажет сондықтан топырақта оның қосындысы жеткілікті мөлшерде болуы қажет. Фосфордың едеуір мөлшері жәндіктердіжою үшін пайдаланылатын әртүрлі фосфорорганикалық препараттар өндірісінде жұмсалады.Фосфор оттекті қосылыстары , фосфор қышқылы және оның тұздары кенінең қолданылады. Шымкенттің тұрмыстық химия зауыты натрий гексаметафосфоты негізінде синтетикалық кіржуғыш заттар шығарады. Адам организмдегі мөлшері бойынша фосфор (0,95%) макро элементке жатады.Фосфор - аргонеген элемент және зат алмасуда маңызды рөл атқарады. Ол жануар қанқасының құрамына (кальций ортафосфоты Ca3(PO4) 2, гидроксилапатит 3 Ca2 (PО4) 2 Ca (OH ) тіс құрамына (гидроселапатит ,фторпатит 3Ca3(PO4) * 2CaF кіреді. Фосфат түрінде фосфор клеткашілік аденозинтри фосфор қышқылының (АТФ) қажетті компененті болып табылады. Фосфор белоктың нүклейн қышқылдарының нүклеотидтер мен басқа биологиялық белсенді қосылыстардың құрамына кіреді. АТФ гидролизі организмге тіршілікке қажетті энергия қорын бөледі.
АЗОТ
Азот ( гр. ázōos – тіршіліксіз) — химиялық элемент – түссіз, иіссіз, дәмсіз – суда аз еритін газ. Бұл элемент аминқышқылдарының амидтердің ақуыздардың-нуклеин қышқылдарының-нуклеотидтердің және өмірде өте маңызды басқада көптеген органикалық қоспалардың құрамына енеді. N – элементтердің периодты жүйесінің V тобындағы химиялық элемент, реттік нөмірі – 7, атом салмағы – 14.0067. Табиғатта екі изотопы кездеседі: 14N (99.635%), 15N (0.365%). Азотты 1772 жылы ағылшын ғалымы Даниэль Резерфорд ашқан.
Жер қыртысындағы азоттың мөлшері 0.03%. Табиғатта азот дербес және қосылыстар күйінде кездеседі және негізгі қоры екі атомнан тұратын молекула түрінде ауа құрамында болады. Азоттың ауадағы салмақ үлесі 75.6% , көлем үлесі 78.1%. Жер қыртысының 1 т массасына 1 кг азоттан келеді, әрі ол бейорганикалық және органикалық қосылыстар күйінде кездеседі. Оның бейорганикалық қосылыстарының негізгілеріне натрий нитраты (чили селитрі), калий нитраты (үнді селитрі) жатады. Органикалық қосылыстар күйіндегі азоттың негізгі қоры барлық тірі ағзалардың ақуыздарында құрамына кіреді. Кезінде жанбайтын қасиетіне байланысты “тіршіліксіз” деп аталып кеткенімен азот тіршілікке өте керек элемент.
Қалыпты температурада азот түссіз, иіссіз газ. Қайнау температурасы – 196 °C, қату температурасы – 210 °C. Су бір өлшем көлемінде (20 °C-та) 0.0154 көлем азот ериді, яғни азоттың суда ерігіштігі оттектің ерігігтігінен төмен. Ауадан аздап жеңіл болады. Азот молекуласының атомдары өзара үш байланыспен тартылатындықтан, оларды бір-бірінен ажыратуға көп энергия керек. Сол себепті азот кәдімгі жағдайда тұрақты болып келеді де, литийден басқа ешқандай жай және күржелі затпен әрекеттеспейді. Химиялық белсенділігінің төмендіг жөнінен азот инертті газдардан кейінгі орынды иемденеді. Азотты қыздырса, көптеген металдармен әрекеттесіп, нитридтер түзеді. Бейметалдармен аса жоғары температурада ғана әрекеттеседі. Мысалы, оның оттекпен әрекеттесуі 3000-4000 °C-та басталады. Өнеркәсіпте азот ауаны сұйылту арқылы алынса, лабораториялық жағдайда аммоний нитритін немесе бихроматын қыздырып алады. Азот негізінен аммиак өндіруге, ал инертті болғандықтан, электр шамдарын толтыруға қолданылады. Химиялық элементтердің периодтық жүйесінде азот II периодта, V топтың негізгі топшасында орналасқан. Азоттан басқа ол топшаны, фосфор Р, мышьяк As, сурьма Sb және висмут Ві элементтері кұрайды. Азотты алғаш рет 1772 жылы ағылшын ғалымы Д. Резерфорд ашты. Азот грекше «өмірді қуаттамайды» деген мағына береді. Периодтық жүйедегі орны. Азот екінші периодтың, бесінші топтың негізгі топшасының элементі, реттік нөмірі 7. Олай болса азоттың ядросында 7 протон мен 7 нейтрон бар. Электрондарының жалпы саны да 7. Осы 7 электрон екі электрондық қабатта былай бөлініп орналасқан: 1s
22s22p3. Сондықтан азот қосылыстарында үш валентті, негізгі жағдайдағы қосылыстарында азоттың тотығу дәрежелері -3, 0, +3 болады, мысалы: NH3, N2, N2O3
Қосылыс түзген кезде азот атомында бос d қабаты болмағандықтан 2s деңгейшесіндегі электрон жұбы ажырайды. Байланыс түзу үшін бір электрон электртерістілігі басымырақ элементке ауысып, азоттың тотығу дәрежесі +1, әрі қарай +2, +3, +4, +5-ке дейін жетеді. Бұл тізбеде N2О мен NО тұз тұзбейтін оксидтер. Қалғандары қышқылдық оксидтер; оларға сәйкес қышқылдарының формулалары HNО2 - азотты қышқыл, HNО3 - азот кышқылы.
Азот көлемі бойынша ауаның 78%-ын құрайды. Ол - түссіз, иіссіз, суда нашар еритін, ауадан сәл ғана жеңіл D (ауа) = 0,97,D (H2) = 14 болатын, жануды қолдамайтын, тыныс алуға жарамсыз газ. Ауадағы 1 л азот газының массасы 1,25 г. Азот -196°С-та сұйылады, -210°С-та қатады (қар тектес). Азот молекуласында екі азот атомы өзара үш еселі байланыспен байланысқан, сондықтан оның химиялық, белсенділігі төмен газ. Азот - 19б°С температурада сұйықка айналады.
Ол тіпті ауадағы күшті тотықтырғыш оттегімен де әрекеттеспейді, бірақ найзағай отында мына реакция жүреді:
N2 + О2 = 2NO
Азоттың маңызды қосылыстары селитралар: NaNО3 (чили селитрасы), KNO3 .Топырақта нитраттар күйінде кездеседі.
Өсімдік пен жануарлар ағзасында маңызды рөл атқарады. Aзотхимиялық реакцияларда әрі тотықтырғыш, әрі тотықсыздандырғыш. Азот оттегімен, фтормен әрекеттескенде тотықсыздандырғыш болса; фосформен, сутегімен, алюминиймен әрекеттескенде тотықтырғыш болады. Азот молекуласы өте берік болуына байланысты реакцияга түсу қабілеті төмен, химиялык енжар зат. Жоғары температура мен кысымда, өршіткі (катализатор) қатысында азот сутекпен тікелей әрекеттесіп, аммиак түзеді:
N2 + 3H2 = 2NH3
Бос күйдегі азот оттекпен электр ұшқыны кезінде әрекеттеседі. Табиғатта бұл реакция найзағай жарқылдағанда жүреді:
N2 + О2 = 2NO
Бөлме температурасында азот тотықтырғыш ретінде тек металл литиймен әрекеттеседі:
N2 + 6Li = 2Li3N
Қыздырғанда басқа металдармен де осылайша әрекеттеседі:
3Mg + N2 = Mg3N2
Азот химиялық синтезде инертті атмосфера жасау үшін пайдаланылады. Тоңазытқышта, медицинада, аммиак алу үшін қолданылады.[4] Сұйық азот салқындаткыш жүйелер саласында кеңінен қолданылады. Азот, негізінен, аммиак алуға, одан әрі азот қышкылы және азот тыңайтқыштарын алу үшін қолданылады. Азотты салғырт (инертті) атмосфералық орта жасау үшін де пайдаланады (электр лампасын толтыруға, т.б.).
Азот молекуласы — берік қосылыс. Ол тотықтырғыш ретінде ерекше жағдайда металлдармен, сутекпен әрекеттеседі. Табиғатта азот бос күйінде кездеседі, ол ауаның негізгі құрам бөлігі. Селигралардың құрамында болады. Азот адам және жануарлар, өсімдіктер организмінде маңызды тіршілік процестерін жүзеге асыратын нәруыздың құрамына кіреді.
Азот табиғатта өте көп тараған элементтің бірі болып есептеледі. Жер бетіндегі оның негізгі түрлері — литосферадағы байланысқан және атмосферадағы молекулалық азот. Атмосферадағы бос азотты өсімдіктер өздігінен сіңіре алмайды. Органикалық заттар шірігенде ондағы азоттың біраз бөлігі аммиакқа айналады. Топырақтағы нитрлеуші бактериялардың көмегімен сол аммиак азот қышқылына дейін тотығады. Өз кезегінде топырақтағы карбонаттар СаС03 қышқылмен реакцияға түсіп, нитратқа айналады да өсімдікке сіңеді. Шіру процесі кезінде азоттың біраз бөлігі атмосфераға бос күйінде бөлініп отырады. Табиғи жағдайда топырақтағы байланысқан азоттың мөлшері кемімейді. Ауадағы бос азот та түрлі себептермен толықтырылып отырады. Мысалы, ағаш, шымтезек, таскөмірді жаққанда, органикалық заттар шірігенде, атмосфераға азот бөлінеді. Топырақта тіршілік ететін кейбір бактериялар да ауа жетіспейтін жағдайда нитраттардан оттекті өзіне тартып, атмосфераға бос азот бөледі. Осы процестер нәтижесінде табиғатта үздіксіз азот айналымы жүріп отырады.
Азот — өсімдікке қажетті қоректік элемент. Азот қышқылының тұздары — нитраттар және аммоний тұздары минералдық тыңайтқыштар ретінде қолданылады. Күміс нитраты хлорид ионын табуға қажетті реактив. Ағаш, таскөмір, органикалық заттар жанғанда, шірігенде ауаға бос азот бөлінеді. Организмдегі азот нәруыз (белок) синтездеуге қатысады.
Дәріс: 16

