ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.02.2024
Просмотров: 203
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
хлорлы әк, гипохлорит, кальций хлораты, т.б.) түзеді. Хлор көптеген органикалық қосылыстармен де әрекеттеседі (қ. Хлорлау). Лабораторияда хлорды 4HCl+MnO2=MnCl2+Cl2+2H2O реакциясы арқылы, ал өнеркәсіпте ас тұзының (NaCl) ерітіндісін электролиздеп алады. Хлорды ауыз суды хлорлауға, мата, қағаз ағартуда, тұз қышқылы мен органикалық синтезде, хлоры бар қосылыстар даярлауда, т.б. қолданылады. Қазақстанда хлор Павлодар химия зауытында өндіріледі.
Химиялық белсенді, өте күшті тотықтырғыш:сутегімен реакцияласады,металдармен және бейметалдармен де реакцияласады:
3Cl2 + 2Fe = 2FeCl2
2Cl + Si = SiCl4
Суда және сілтілердің судағы ерітінділерінде дисмутацияланады:
Cl2 + 2NaOH(суық) = NaClO + NaCl + H2O
3Cl2 + 6NaOH(ыстық) = NaClO3 + 5NaCl + 3H2O
Дәріс:17
Тақырыбы: d-элементтердің периодтық жүйесіндегі орны, атом құрылысы ерекшеліктері. Мыс. Мырыш.
Мақсаты: d-элементтердің құрылысы және ортақ қасиеттері туралы білімдерін кеңейту. Мыстың периодтық жүйедегі орны және атом құрылысы, табиғатта таралуы, алынуы, қасиеттері және маңызды қосылыстарымен таныстыру.
Жоспары:
d-элементтерінің басты химиялық сипаты сыртқы электрон қабатында 2s электрон болуымен анықталады. Кезекті электрондар сыртқы электрондық қабаттан санағанда екінші қабатқа түсіп, d - деңгейшені толтырады. Сондықтан d-элементтер химиялық реакцияларда металдар сияқты оң тотығу дәрежесін көрсетеді.
Мыс оның электрондық формуласы:
+29 Сu 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Мыс атомында оныншы d-электрон төртінші s-деңгейшеден «құлап» түсуі нәтижесінде үшінші d-деңгейшеге өтеді, сондықтан бұл электрон қозғалғыш.
Табиғатта таралуы. Жер қыртысында мыстың мөлшері 0,01% массаны құрайды. Ол саф күйінде және қосылыстар түрінде кездеседі. Маңызды минералдары: халькопирит-СuFeS2, малахит-CuCO3
* Cu(OH)2, куприт-Cu2O жатады. Қазіргі өнеркәсіптік кен орындарында кендер тек бір ғана мыс миниралдарынан тұрмайды. Олардың құрамында, әдетте, темір және түсті металдардың қосылыстары болады.
Тас ғасырында адамның бірінші танысқан металы ( шамамен 6 мың жыл бұрын Ежелгі шығыста, шамамен 4 мың жыл бұрын Европада) мыс болсы керек. Ол табиғатта саф күйінде кездеседі. Өте ірі саф күйінде табылған мыс 420тонна болды. Саф мыс басқа металдарға қарағанда едәуір көп таралған. Сондықтан адам құрап жасау үшін алғаш рет саф мысты пайдаланған.
Мысты металлургиялық балқумен адамның өте ертеден таныс екені туралы деректер бар. Египетте мысалы, б.з.д. ІV мыңжылдықта Синай түбегінде мыс кендерін өңдеген. Ертеде мыс кендері Кипр аралында белгілі болған. «Купрум» сөзі мыстың латынша атауы, ежелгі римдіктердің мыскен орындары болған Кипр аралының атауынан шыққан деген сөз.
Еліміз түсті металдар кеніне, оның ішінде мысқа бай. Мыс кені қорының үлкен бөлігі Жезқазған маңында, сондай-ақ Павлодар, Жамбыл, Шығыс Қазақстан, Ақтөбе обылыстарында, Кенді Алтайда. Мыс Балқашта және Жезқазған тау – металургия комбинатында өндіріледі.
Алынуы:
2Cu2S+3O2 ═ 2Cu2O+2SO2
2Cu2O+Cu2S ═ 6Cu+SO2
Физикалық қасиеті:Мыс – ашық қызғылт түсті жылтыр металл, тұтқыр, жеңіл созылады. Балқу температурасы – 1083 °С . Тығыздығы – 8,9 г/см3. Электр тоғын (күмістен кейін ) жақсы өткізеді.
Химиялық қасиеттері: Құрғақ ауада және кәдімгі температурада мыс өзгермеейді. Өйткені қосылыстың қорғаныш қабықшасымен қапталады, оның құрамы ауадаға қоспа заттарға тәуелді.
Жай заттармен әрекеттеседі. Мыс – галогендермен оңай әрекеттеседі:
Cu+Cl2 ═ CuCl2
2Cu+O2 ═ 2CuO
Cu+S ═ CuS
Мыс сутекпен және азотпен қыздырғанда да әрекеттеспейді.
Күрделі заттармен:
Cu+2H2SO4 ═ CuSO4+SO2+2H2O
Cu+4HNO3 ═ Cu(NO3)2
+2NO2 +2H2O
Конц
Cu+8HNO3 ═ 3Cu(NO3)2+2NO↑+4H2O
сұйыл
Сu+2AgNO3 ═ Cu(NO3)2+2Ag
Мыс қосылыстарын анықтау. Мыс және оның ұшқыш қосылыстары жалынды көк жасыл түске бояйды. Тұздарына сілті қосқанда мыс гидроксидінің көгілдір тұнбасы түзіледі.
Cu2+ + 2OH- ═ Cu(OH)2↓
Мыстың биологиялық рөлі. Өсімдік және жануарлар организімінде мыстың мөлшері шикізатқа есептегенде 10 -5 %-ке дейін аралықта болады. Мысқа кейбір омыртқасыздар – былқылдақденелілер мен буынаяқтылар (теңіз шаяндары, кальмарлар, сегізаяқтылар) бай болады. ХІХ өзінде ұлулардың көгілдір қанын зерттегенде ғалымдар мынадай қорытындыға келді: көгілдір түс қанда мыстың болуын көрсетеді. Ол адамның қанында 0,001 мг/л мөлшерде болады. Жануар мен адам организмінде мыс бауырда консентрленеді. Ол қан түзу просесіне қатысады, тотығу процесін күшейтетін көпдеген ферменттердің құрамына кіреді, көмірсу алмасуын, гемоглабин және майлар синтезін, витаминдердің түзілуін қамтамасыз етеді.
Мыс өсімдіктерге де қажет. Ол фотосинтез процесіне қатысатын маңызды микроэлементтердің бірі және өсімдіктердің азотты сіңіруіне әсер етеді. Адам организмінде мыс жетіспесе, қаназдық (анемия) ауруы пайда болады, ал өсімдіктерде мыс жетіспесе, олардың дамуы және жеміс беруі нашарлайды. Бірақ, оның артық мөлшеріде зиянды. Адам үшін мыстың барлық тұздары улы. Мыс қосылыстарын өсімдіктердің зиянкестеріне және саңырауқұлақтарға қарсы күресте қолданылады.
Қолданылуы:
Мырыш
(лат. Zincum), Zn – элементтердің периодты жүйесінің II-тобындағы химиялық элемент, асыл металдардың бірі. Реттік нөмірі 30, атом массасы 65,39. [1] Мырыш ерте заманда жез түрінде белгілі болған, таза түрі 16 ғасырда алынған. Жер қыртысындағы массасы бойынша мөлш. 8,3×10-3%. Ол полиметалды сульфид кендерінің құрамында кездеседі. Негізгі минералдары: сфалерит (мырыш алдамышы) және вюрцит, смитсонит, каламин, цинкит. Мырыш гексагональды тығыз қапталған торы бар күміс түсті ақ металл, тығызд. 7,133 г/см3, балқу t 419,5°С, қайнау t 906°С. Тотығу дәрежесі +2. Ылғал ауада және суда 200°С-қа дейін тұрақты, тотығуға гидроксикарбонатты беттік пленкасы кедергі жасайды; қышқылдар және сілтілермен, аммиак және аммоний тұздарымен, ылғал күйіндегі Cl2, Br2-мен, қыздырғанда О2-мен әрекеттеседі. Құрамында М. бар концентраттарды күйдіріп, әрі қарай алынған күйдіргіні Н2SO4-пен сілтісіздендіру және ZnSO4 ерітіндісінен Мырышты электрлік тұндыру арқылы алынады. Мырыш жез, нейзильбер, томпак, тағы басқа қорытпалардың құраушысы; болат және шойынды мырыштау үшін (бұл кезде коррозияға қарсы қаптама түзіледі), ұшақтар мен автомобильдердің майда бөлшектерін, химиялық ток көздерінің электродтарын жасауда, күміс пен алтынды қорғасыннан бөлуде қолданылады.
Қасиеттері:
Zn +H2О=>ZnO +H2
Zn + 2NaOH(кристалды) =>Na2[Zn(OH)4H2
Zn + 2NaOH+ 2H2О =>Na2[Zn(OH)4]+H2
Zn(OH)2 + 2HCI=>ZnCI2 +2 H2 O
Zn(OH)2 +2NaOH=>Na2[Zn(OH)4]
200 мыңдай жаңа органикалық қосылыс ситезделеді.
Химиялық белсенді, өте күшті тотықтырғыш:сутегімен реакцияласады,металдармен және бейметалдармен де реакцияласады:
3Cl2 + 2Fe = 2FeCl2
2Cl + Si = SiCl4
Суда және сілтілердің судағы ерітінділерінде дисмутацияланады:
Cl2 + 2NaOH(суық) = NaClO + NaCl + H2O
3Cl2 + 6NaOH(ыстық) = NaClO3 + 5NaCl + 3H2O
Дәріс:17
Тақырыбы: d-элементтердің периодтық жүйесіндегі орны, атом құрылысы ерекшеліктері. Мыс. Мырыш.
Мақсаты: d-элементтердің құрылысы және ортақ қасиеттері туралы білімдерін кеңейту. Мыстың периодтық жүйедегі орны және атом құрылысы, табиғатта таралуы, алынуы, қасиеттері және маңызды қосылыстарымен таныстыру.
Жоспары:
-
d-элементтердің периодтық жүйесіндегі орны, атом құрылысы ерекшеліктері -
Мыс.Мырыш
d-элементтерінің басты химиялық сипаты сыртқы электрон қабатында 2s электрон болуымен анықталады. Кезекті электрондар сыртқы электрондық қабаттан санағанда екінші қабатқа түсіп, d - деңгейшені толтырады. Сондықтан d-элементтер химиялық реакцияларда металдар сияқты оң тотығу дәрежесін көрсетеді.
Мыс оның электрондық формуласы:
+29 Сu 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Мыс атомында оныншы d-электрон төртінші s-деңгейшеден «құлап» түсуі нәтижесінде үшінші d-деңгейшеге өтеді, сондықтан бұл электрон қозғалғыш.
Табиғатта таралуы. Жер қыртысында мыстың мөлшері 0,01% массаны құрайды. Ол саф күйінде және қосылыстар түрінде кездеседі. Маңызды минералдары: халькопирит-СuFeS2, малахит-CuCO3
* Cu(OH)2, куприт-Cu2O жатады. Қазіргі өнеркәсіптік кен орындарында кендер тек бір ғана мыс миниралдарынан тұрмайды. Олардың құрамында, әдетте, темір және түсті металдардың қосылыстары болады.
Тас ғасырында адамның бірінші танысқан металы ( шамамен 6 мың жыл бұрын Ежелгі шығыста, шамамен 4 мың жыл бұрын Европада) мыс болсы керек. Ол табиғатта саф күйінде кездеседі. Өте ірі саф күйінде табылған мыс 420тонна болды. Саф мыс басқа металдарға қарағанда едәуір көп таралған. Сондықтан адам құрап жасау үшін алғаш рет саф мысты пайдаланған.
Мысты металлургиялық балқумен адамның өте ертеден таныс екені туралы деректер бар. Египетте мысалы, б.з.д. ІV мыңжылдықта Синай түбегінде мыс кендерін өңдеген. Ертеде мыс кендері Кипр аралында белгілі болған. «Купрум» сөзі мыстың латынша атауы, ежелгі римдіктердің мыскен орындары болған Кипр аралының атауынан шыққан деген сөз.
Еліміз түсті металдар кеніне, оның ішінде мысқа бай. Мыс кені қорының үлкен бөлігі Жезқазған маңында, сондай-ақ Павлодар, Жамбыл, Шығыс Қазақстан, Ақтөбе обылыстарында, Кенді Алтайда. Мыс Балқашта және Жезқазған тау – металургия комбинатында өндіріледі.
Алынуы:
2Cu2S+3O2 ═ 2Cu2O+2SO2
2Cu2O+Cu2S ═ 6Cu+SO2
Физикалық қасиеті:Мыс – ашық қызғылт түсті жылтыр металл, тұтқыр, жеңіл созылады. Балқу температурасы – 1083 °С . Тығыздығы – 8,9 г/см3. Электр тоғын (күмістен кейін ) жақсы өткізеді.
Химиялық қасиеттері: Құрғақ ауада және кәдімгі температурада мыс өзгермеейді. Өйткені қосылыстың қорғаныш қабықшасымен қапталады, оның құрамы ауадаға қоспа заттарға тәуелді.
Жай заттармен әрекеттеседі. Мыс – галогендермен оңай әрекеттеседі:
Cu+Cl2 ═ CuCl2
2Cu+O2 ═ 2CuO
Cu+S ═ CuS
Мыс сутекпен және азотпен қыздырғанда да әрекеттеспейді.
Күрделі заттармен:
Cu+2H2SO4 ═ CuSO4+SO2+2H2O
Cu+4HNO3 ═ Cu(NO3)2
+2NO2 +2H2O
Конц
Cu+8HNO3 ═ 3Cu(NO3)2+2NO↑+4H2O
сұйыл
Сu+2AgNO3 ═ Cu(NO3)2+2Ag
Мыс қосылыстарын анықтау. Мыс және оның ұшқыш қосылыстары жалынды көк жасыл түске бояйды. Тұздарына сілті қосқанда мыс гидроксидінің көгілдір тұнбасы түзіледі.
Cu2+ + 2OH- ═ Cu(OH)2↓
Мыстың биологиялық рөлі. Өсімдік және жануарлар организімінде мыстың мөлшері шикізатқа есептегенде 10 -5 %-ке дейін аралықта болады. Мысқа кейбір омыртқасыздар – былқылдақденелілер мен буынаяқтылар (теңіз шаяндары, кальмарлар, сегізаяқтылар) бай болады. ХІХ өзінде ұлулардың көгілдір қанын зерттегенде ғалымдар мынадай қорытындыға келді: көгілдір түс қанда мыстың болуын көрсетеді. Ол адамның қанында 0,001 мг/л мөлшерде болады. Жануар мен адам организмінде мыс бауырда консентрленеді. Ол қан түзу просесіне қатысады, тотығу процесін күшейтетін көпдеген ферменттердің құрамына кіреді, көмірсу алмасуын, гемоглабин және майлар синтезін, витаминдердің түзілуін қамтамасыз етеді.
Мыс өсімдіктерге де қажет. Ол фотосинтез процесіне қатысатын маңызды микроэлементтердің бірі және өсімдіктердің азотты сіңіруіне әсер етеді. Адам организмінде мыс жетіспесе, қаназдық (анемия) ауруы пайда болады, ал өсімдіктерде мыс жетіспесе, олардың дамуы және жеміс беруі нашарлайды. Бірақ, оның артық мөлшеріде зиянды. Адам үшін мыстың барлық тұздары улы. Мыс қосылыстарын өсімдіктердің зиянкестеріне және саңырауқұлақтарға қарсы күресте қолданылады.
Қолданылуы:
-
Электр тогын өткізетін қондырғылар жасауда; -
Металдық қаптаулар алуда; -
Әр түрлі заттардың металдық көшірмесін алу үшін; -
Әсемдік бұйымдар дайындауда, -
Полиграфияда, мыс қалыбын жасауда; -
Радиотехникада қолданылады.
Мырыш
(лат. Zincum), Zn – элементтердің периодты жүйесінің II-тобындағы химиялық элемент, асыл металдардың бірі. Реттік нөмірі 30, атом массасы 65,39. [1] Мырыш ерте заманда жез түрінде белгілі болған, таза түрі 16 ғасырда алынған. Жер қыртысындағы массасы бойынша мөлш. 8,3×10-3%. Ол полиметалды сульфид кендерінің құрамында кездеседі. Негізгі минералдары: сфалерит (мырыш алдамышы) және вюрцит, смитсонит, каламин, цинкит. Мырыш гексагональды тығыз қапталған торы бар күміс түсті ақ металл, тығызд. 7,133 г/см3, балқу t 419,5°С, қайнау t 906°С. Тотығу дәрежесі +2. Ылғал ауада және суда 200°С-қа дейін тұрақты, тотығуға гидроксикарбонатты беттік пленкасы кедергі жасайды; қышқылдар және сілтілермен, аммиак және аммоний тұздарымен, ылғал күйіндегі Cl2, Br2-мен, қыздырғанда О2-мен әрекеттеседі. Құрамында М. бар концентраттарды күйдіріп, әрі қарай алынған күйдіргіні Н2SO4-пен сілтісіздендіру және ZnSO4 ерітіндісінен Мырышты электрлік тұндыру арқылы алынады. Мырыш жез, нейзильбер, томпак, тағы басқа қорытпалардың құраушысы; болат және шойынды мырыштау үшін (бұл кезде коррозияға қарсы қаптама түзіледі), ұшақтар мен автомобильдердің майда бөлшектерін, химиялық ток көздерінің электродтарын жасауда, күміс пен алтынды қорғасыннан бөлуде қолданылады.
Қасиеттері:
Zn +H2О=>ZnO +H2
Zn + 2NaOH(кристалды) =>Na2[Zn(OH)4H2
Zn + 2NaOH+ 2H2О =>Na2[Zn(OH)4]+H2
Zn(OH)2 + 2HCI=>ZnCI2 +2 H2 O
Zn(OH)2 +2NaOH=>Na2[Zn(OH)4]
Қосылыстары: цинк оксиді ZnO – қызыл мырыш кені –цинкит, түссіз суда ерімейді, қышқылда және сілтіінің артық мөлшерінде оңай ериді; мырыш гидроксиді ақ түсті іртік тұнба, Zn(ОН)2, цинк купоросы ZnSO4*7Н 2 O, цинка сульфиді ZnS. Мырыштың биологиялық маңызы : адам ағзасында жетіспеген жағдайда дәм және иіс сезуі нашарлайды.
Дәріс:18
Тақырыбы: Темір. Металдардың жемірілуі.
Мақсаты: Темірдің периодтық жүйедегі орнын, атом құрлысын, табиғатта таралуы, физикалық, химиялық қасиеттері, алынуы, қолданылуы туралы түсінік беру.
Жоспары:
-
Темір
-
Металдардың жемірілуі
Периодтық жүйедегі орны және атом құрылысы.
Темір – VIIIБ топ элементі. Барлық қосымша топша элементтері сияқты темір де d-элементтерге жатады. Электрондар сыртқы электрондық қабаттан санаганда екінші қабаттағы d – деңгейшеге түседі, бірақ сыртқы электрон қабатында екі s-электрон болады.
Электрондық формуласы: 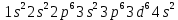
Темірде валенттік электрондары сыртқы s-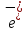 және сырттан санағанда екінші деңгейдегі d - ēболып табылады, сондықтан оның атомдары ауыспалы тотығу дәрежесін көрсетеді.
және сырттан санағанда екінші деңгейдегі d - ēболып табылады, сондықтан оның атомдары ауыспалы тотығу дәрежесін көрсетеді.
Темір химиялық реакцияларға 2ē немесе 3 ēберіп, өзінің тұрақты қосылыстарында +2 және +3 тотығу дәрежелерін көрсетеді:
0
Fe – 2 ē → F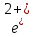
0
Fe – 3 ē → F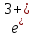
Темірдің тотығу дәрежесі +6 болатын тұрақтылығы төмен қосылыстары (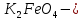 калий ферраты) белгілі.
калий ферраты) белгілі.
Табиғатта таралуы. Темір – табиғатта таралуы бойынша, екінші металл. Оның жер қыртысындағы үлесі 5,1%.
Көптеген метеориттердің құрамында темір бар, сондықтан оны ертеде “аспан” немесе “жұлдыз” тасы деп атаған. Жер қыртысында темір көптеген минералдар түзеду. Темірдің маңызды өнеркәсіптік кендері: қызыл теміртас (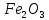 ), магниттік теміртас (
), магниттік теміртас (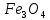 ), пирит (Fe
), пирит (Fe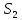 ). Елімізде темір кендерінің үлкен қоры – Торғай темір кені бассейнінде және Орталық Қазақстанда бар. Қазіргі уақытта елімізде бірнеше жүздеген кен орындары мен кен ошақтары белгілі. Көптеген кен орындарында кендердің жер бетіне жақын орналасуы оларды арзан, ашық әдіспен өндіруге мүмкіндік береді. (5.5-сурет). Темір Fe(HC
). Елімізде темір кендерінің үлкен қоры – Торғай темір кені бассейнінде және Орталық Қазақстанда бар. Қазіргі уақытта елімізде бірнеше жүздеген кен орындары мен кен ошақтары белгілі. Көптеген кен орындарында кендердің жер бетіне жақын орналасуы оларды арзан, ашық әдіспен өндіруге мүмкіндік береді. (5.5-сурет). Темір Fe(HC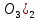 түрінде кіреді. Темір тұздары теңіз суларында бар, мұхит түбінде темірге бай табиғи шөгінділер кездеседі.
түрінде кіреді. Темір тұздары теңіз суларында бар, мұхит түбінде темірге бай табиғи шөгінділер кездеседі.
Өнеркәсіпте алынуы. Темірді оның оксидтерін сутекпен, алюминиймен немесе көміртек (II) оксидімен тотықсыздандырып алады:
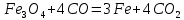
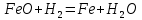
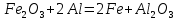
Физикалық қасиеттері. Темір – жылтыр, күмістей ақ түсті металл, оның тығыздығы 7,87 г/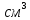 . Оның балқу температурасы +1539°С – тан жоғары. Қаттылығы 4,6, ол І-ІІІ топ металдарынан қатты. Темір пластикалы, оған магниттену және мегнитсіздену қасиеттері тән, техникада кеңінен қолданылады.
. Оның балқу температурасы +1539°С – тан жоғары. Қаттылығы 4,6, ол І-ІІІ топ металдарынан қатты. Темір пластикалы, оған магниттену және мегнитсіздену қасиеттері тән, техникада кеңінен қолданылады.
Химиялық қасиеттер. Темір қосымша топшаның көптеген металдары сияқты, орташа белсенді металл болып табылады. Белсенді бейметалдар темірді тотықтырады:
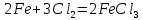
Қыздырылған темірдің жұқа жоңқалары оттекте темір тотқағын (темір оксидтерінің – тотығу дәрежесі +2 және +3 болатын FeO 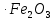 қоспасы) түзіп жанады:
қоспасы) түзіп жанады:
3Fe + 2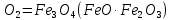
Құрғақ атмосферада темір қорғағыш оксидтік қабықшамен қапталады. Мұндай қабықшаны темірді қыздыру арқылы жасанды жолмен де алуға болады. Осылай тоттанбайтын көк болатты алады.
Қыздырылған темір су буымен әрекеттеседі:
0 +1 +2 0
Fe + 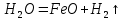
Ылғал ауада темір тотығу өнімінің қоспасы (оксидтер мен гидроксидтер) тотпен қапталады. Бұл процесті қысқаша былай жазады:
0 0 +3 -2
4Fe+6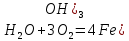
0+3
Fe – 3 ē → Fe 3 4
0-2
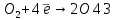
Темір кәдімгі қышқылдарда өзі +2 тотығу дәрежесіне дейін тотығып, сутекті тотықсыздандырады:
Fe + 2H = Fe + 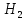
Концентрлі азот және күкірт қышқылдарында темір енжарланады, өйткені ерімейтін қосылыстардың қорғағыш қабықшасымен қапталады.
Темір белсендігі төмен металдарды тұздарынан тотықсыздандырады:
0 +2 +2 0
Fe + CuC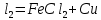
Темір оксидтері. FeO – қара түсті ұнтақ, суда ерімейді. Негіздік қасиеттер көрсетеді:
FeO + 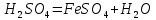
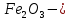 күрең, қоңыр ұнтақ, суда ерімейді. Бұл оксидке де негіздік қасиеттер тән:
күрең, қоңыр ұнтақ, суда ерімейді. Бұл оксидке де негіздік қасиеттер тән:
F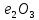 + 3
+ 3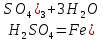
Бірақ жоғары температурада ол екідайлы оксилтер сияқты негіздік оксидтермен және балқытқанда сілтілермен қосылады:
CaO + 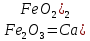
кальций ферриті
Кальций ферриті цемент өндірісінде түзіледі.
Қолданылуы. Таза темірді шеге, тез магниттелу және магнитсіздену қабілетіне байланысты электромагниттік құралдардың бөлшектерін (трансформаторлар, электромотор) және т.б. жасау үшін қолданады. Темірдің құймалары – шойын және болат көп қолданылады. Бұлар техниканың басты конструкциялық материалдары.
Дүние жүзінде темір мен оның құймаларын қалған барлық металдарға қарағанда 20 есе артық өндіреді.
Металдардың жемірілуі. Металдар мен құймалар әр түрлі заттармен жанасқанда, олармен әрекеттесіп, химиялық қосылыстар түзеді. Әсіресе жаңбыр, топырақ ылғалы, ауа әсерінен қоршаған ортадағы металдар бүлініп желінеді. Бұл кезде металдан жасалған бұйымның қасиеті мүлдем өзгеріп, ол біртіндеп бүліне бастайды. Бұл өте зиянды әрі қауіпті процесс жемірілу деп аталады (коррозия — лат. korrosio — желіну деген сөз). Қоршаған орта факторларының әсерінен болатын металдың желіну құбылысы жемірілу (коррозия) деп аталады. Металдар мен құймалардан жасалған өнеркәсіптік қондырғылар, ауылшаруашылық техникасы, қатынас келіктерінің тетіктері, энергетика және химия өнеркәсібінің қондырғылары жемірілуге ұшырайды. Жемірілудің келтірген зиянынан металл бұйымдар пайдалануға жарамсыз болып қалады, бұл тіпті түрлі апаттарға соқтыруы мүмкін. Металдардың бәрі бірдей жемірілуге ұшырай бермейді. Кернеу қатарында күмістен соң орналасқан металдар "бекзат металдар" деп аталады, олар іс жүзінде бүлінбейді. Сондықтан бұл металдарды және олардың құймаларын жемірілуге тыйым салынған жерлерде қолданады. Мысалы, электрондық өнеркәсіпте, ғарыштық техникада контактілер жасау үшін алтынды пайдаланады. Кернеу қатарында магнийдің сол жағында орналасқан сілтілік және сілтілікжер металдар "бекзат металдарға" қарама-қарсы қасиетке ие. Олар көдімгі жағдайдың өзінде қоршаган ортадағы көптеген заттармен (ең алдымен, оттекпен және сумен) оңай әрекеттеседі, сондықтан қондырғылар мен аппараттар жасауға пайдаланылмайды. Кернеу қатарының орта шенінде жемірілуге баяу ұшырайтын металдар орналасқан. Олардың біразы, мысалы, Mg, Zn, Al, Cr, Ni жемірілуге тәзімді, себебі металдардың бетінде оксидтен тұратын өте жұқа қабықша пайда болып, металдарды қоршаған ортамен жанасудан сақтап тұрады. Адамдар темірдің таттануын жиі кездестіреді, жемірілген темірдің бетін кеуек қоңырқай тат қабаты басады.
Жыл сайын дүние жүзінде алынатын темір массасының 1/4-і жемірілуге ұшырап, бүлініп отырады. Темірдің таттануы, әдетте, оттектің әсерінен болады:
2Fe0 + 2Н2О + О2 = 2Ғе(ОН)2
Оттек молекуласы темірді алдымен Ғе+2, содан кейін Ғе+3 катионына айналдырады:
Тотықсыздандырғыш 2Ғе0 — 2ē —> 2Ғе+2
Тотыктырғыш О02 + 4ē = 2О2-2
4Ғе(0Н)2 + 2Н2О + О2 -> 4Ғе(0Н)3
Тотықсыздандырғыш Fe+2 — ē —> Fe+3
Тотыктырғыш О02+4ē —> 2О-2
Жалпы алғанда, металдардың және олардың құймаларының қоршаған орта әсерінен жемірілуге ұшырауын химиялық және электрохимиялық деп екіге бөледі. Бүкіл әлемде адамның белсенді іс-әрекетінің нәтижесінде қоршаған ортаның ластануы шекті деңгейге жетіп отыр. Осыған орай, металдар мен құймалардың жемірілуі де күшейіп келеді. Қазір ғылым мен практика жемірілу процесін шектеудің, азайтудың, тіпті мүлдем болдырмаудың көптеген әдіс-тәсілдерін ұсынады. Жалпы алғанда, жемірілумен күресудің бірнеше бағыттары бар. Жемірілу электролит ерітінділерінде өтеді. Ол белсенділігі төмен металдардың қатысуымен күшейе туседі. Электрондардын ауысуымен, микротоктың пайда болуымен жүреді. Мысалдар: тасымал құбырлардың, рельстердін, кеме корпусының, әр түрлі металдан жасалған конструкциялардың желінуі. Жоғары температурада бейэлектролит тотыктырғыштардың әсерінен бүлінеді. Тотықтырғыштар: О2, Cl2, SO2, және басқа газдар, әртүрлі отын түрлері, су буы. Қоршаған ортаның әсерінен металдардың бүлінуін жемірілу (коррозия) деп атайды. Жемірілу тотығу-тотықсыздану процесіне жатады, оның жүруі металдардың белсенділігіне тәуелді. Белсенді металдар оңай жеміріледі. "Бекзат металдар" жемірілмейді. Металдардың жемірілуін болдырмау шараларын білу керек.
Дәріс:1
Тақырыбы: Органикалық зат және көмірсутек қосылысы. Органикалық химия пәні. Органикалық заттардың химиялық құрылыс теориясы.
Мақсаты: Органикалық химия пәні, даму тарихы, оның маңызы, қарайтын негізгі мәселелері мен нысандарымен, органикалық қосылыстар мен реакциялардың классификациясымен танысу.
Жоспары:
-
Органикалық химияның даму тарихы
-
Жаңа органикалық қосылыстарды синтездеу, олардың өсімдік және жануар организіміне әсері, өндіріс қалдықтарын іске асыру жолдары.
-
А.М.Бутлеров жасаған органикалық қосылыстардың құрылыс теориясы
-
Органикалық қосылыстардың классификациясы
Органикалық химия ғылым ретінде XIX ғасырдың ортасында пайда болды. Алғашқы даму сатысында органикалық химия өсімдіктер мен жануар организімінде түзілетін заттарды зерттеді. Сондықтан “организм” деген сөзден “органикалық химия” деген келіп шықты. Қазіргі кезде органикалық химия деп көміртек қосылыстарының химиясын атайды. Сонымен: органикалық химия органикалық қосылыстардың құрамын, құрылысын, қасиеттерін және өзгерістерін зерттейтін ғылым. Ал, органикалық қосылыстар дегеніміз құрамында көміртегі болатын қосылыстар (СО, СО2, Н2СО3 және тұздарынан басқа). Адамдар ежелден-ақ органикалық қосылыстарды пайдаланып, олардан әр түрлі өнімдер шарап, сыра, бал, сірке суы, органикалық бояулар – индиго, ализарин, эфир майлары, қант т.с.с. алды. Бірақ ол кезде органикалық және бейорганикалық қосылыстардың айырмашылығын ескермеген. Оқымыстылар ол кезде органикалық заттар тек өсімдік немесе жануар организімінде түзіледі деген пікірде болды. Бұл ағым “витализм” (латынның “vita” - өмір, тіршілік деген сөзінен) деп аталды. Бірақ 1824 ж. неміс дәрігері және химигі Фридрих Велер, тұңғыш рет бейорганикалық газ тәрізді зат дицианды сумен қыздырып, органикалық қосылыс қымыздық қышқылын алды:
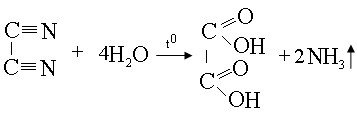
Осыдан 4 жыл өткесін 1828 ж. Велер мочевинаны синтездеді (циан қышқыл Н4 қыздырып ): NH2 – C - NH2 Велердің бұл жұмыстары
O
органикалық қосылыстарды химиялық әдіспен бейорганикалық қосылыстардан, ешқандай “өмір күшінсіз” алуға болатынын дәлелдеп берді. Сосын, аз уақыт ішінде әр түрлі елдерде: Ресейден Зинин 1842 ж. – анилин, Бутлеров 1861 ж. – қантты затты (углевод), Германияда Кольбе 1845 ж. – сірке қышқылын, Францияда М. Бертло 1954 ж. – майды синтездеп алды. Қазіргі кезде белгілі органикалық қосылыстардың саны
5 млн., ал бейорганикалық қосылыстар
650 мың. Жылына
200 мыңдай жаңа органикалық қосылыс ситезделеді.
Қосылыстары: цинк оксиді ZnO – қызыл мырыш кені –цинкит, түссіз суда ерімейді, қышқылда және сілтіінің артық мөлшерінде оңай ериді; мырыш гидроксиді ақ түсті іртік тұнба, Zn(ОН)2, цинк купоросы ZnSO4*7Н 2 O, цинка сульфиді ZnS. Мырыштың биологиялық маңызы : адам ағзасында жетіспеген жағдайда дәм және иіс сезуі нашарлайды.
Дәріс:18
Тақырыбы: Темір. Металдардың жемірілуі.
Мақсаты: Темірдің периодтық жүйедегі орнын, атом құрлысын, табиғатта таралуы, физикалық, химиялық қасиеттері, алынуы, қолданылуы туралы түсінік беру.
Жоспары:
-
Темір
-
Металдардың жемірілуі
Периодтық жүйедегі орны және атом құрылысы.
Темір – VIIIБ топ элементі. Барлық қосымша топша элементтері сияқты темір де d-элементтерге жатады. Электрондар сыртқы электрондық қабаттан санаганда екінші қабаттағы d – деңгейшеге түседі, бірақ сыртқы электрон қабатында екі s-электрон болады.
Электрондық формуласы: 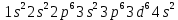
Темірде валенттік электрондары сыртқы s-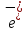 және сырттан санағанда екінші деңгейдегі d - ēболып табылады, сондықтан оның атомдары ауыспалы тотығу дәрежесін көрсетеді.
және сырттан санағанда екінші деңгейдегі d - ēболып табылады, сондықтан оның атомдары ауыспалы тотығу дәрежесін көрсетеді.
Темір химиялық реакцияларға 2ē немесе 3 ēберіп, өзінің тұрақты қосылыстарында +2 және +3 тотығу дәрежелерін көрсетеді:
0
Fe – 2 ē → F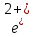
0
Fe – 3 ē → F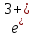
Темірдің тотығу дәрежесі +6 болатын тұрақтылығы төмен қосылыстары (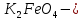 калий ферраты) белгілі.
калий ферраты) белгілі.
Табиғатта таралуы. Темір – табиғатта таралуы бойынша, екінші металл. Оның жер қыртысындағы үлесі 5,1%.
Көптеген метеориттердің құрамында темір бар, сондықтан оны ертеде “аспан” немесе “жұлдыз” тасы деп атаған. Жер қыртысында темір көптеген минералдар түзеду. Темірдің маңызды өнеркәсіптік кендері: қызыл теміртас (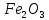 ), магниттік теміртас (
), магниттік теміртас (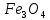 ), пирит (Fe
), пирит (Fe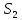 ). Елімізде темір кендерінің үлкен қоры – Торғай темір кені бассейнінде және Орталық Қазақстанда бар. Қазіргі уақытта елімізде бірнеше жүздеген кен орындары мен кен ошақтары белгілі. Көптеген кен орындарында кендердің жер бетіне жақын орналасуы оларды арзан, ашық әдіспен өндіруге мүмкіндік береді. (5.5-сурет). Темір Fe(HC
). Елімізде темір кендерінің үлкен қоры – Торғай темір кені бассейнінде және Орталық Қазақстанда бар. Қазіргі уақытта елімізде бірнеше жүздеген кен орындары мен кен ошақтары белгілі. Көптеген кен орындарында кендердің жер бетіне жақын орналасуы оларды арзан, ашық әдіспен өндіруге мүмкіндік береді. (5.5-сурет). Темір Fe(HC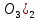 түрінде кіреді. Темір тұздары теңіз суларында бар, мұхит түбінде темірге бай табиғи шөгінділер кездеседі.
түрінде кіреді. Темір тұздары теңіз суларында бар, мұхит түбінде темірге бай табиғи шөгінділер кездеседі.
Өнеркәсіпте алынуы. Темірді оның оксидтерін сутекпен, алюминиймен немесе көміртек (II) оксидімен тотықсыздандырып алады:
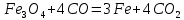
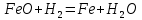
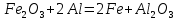
Физикалық қасиеттері. Темір – жылтыр, күмістей ақ түсті металл, оның тығыздығы 7,87 г/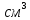 . Оның балқу температурасы +1539°С – тан жоғары. Қаттылығы 4,6, ол І-ІІІ топ металдарынан қатты. Темір пластикалы, оған магниттену және мегнитсіздену қасиеттері тән, техникада кеңінен қолданылады.
. Оның балқу температурасы +1539°С – тан жоғары. Қаттылығы 4,6, ол І-ІІІ топ металдарынан қатты. Темір пластикалы, оған магниттену және мегнитсіздену қасиеттері тән, техникада кеңінен қолданылады.
Химиялық қасиеттер. Темір қосымша топшаның көптеген металдары сияқты, орташа белсенді металл болып табылады. Белсенді бейметалдар темірді тотықтырады:
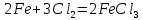
Қыздырылған темірдің жұқа жоңқалары оттекте темір тотқағын (темір оксидтерінің – тотығу дәрежесі +2 және +3 болатын FeO 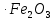 қоспасы) түзіп жанады:
қоспасы) түзіп жанады:
3Fe + 2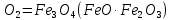
Құрғақ атмосферада темір қорғағыш оксидтік қабықшамен қапталады. Мұндай қабықшаны темірді қыздыру арқылы жасанды жолмен де алуға болады. Осылай тоттанбайтын көк болатты алады.
Қыздырылған темір су буымен әрекеттеседі:
0 +1 +2 0
Fe + 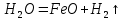
Ылғал ауада темір тотығу өнімінің қоспасы (оксидтер мен гидроксидтер) тотпен қапталады. Бұл процесті қысқаша былай жазады:
0 0 +3 -2
4Fe+6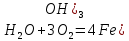
0+3
Fe – 3 ē → Fe 3 4
0-2
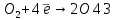
Темір кәдімгі қышқылдарда өзі +2 тотығу дәрежесіне дейін тотығып, сутекті тотықсыздандырады:
Fe + 2H = Fe + 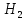
Концентрлі азот және күкірт қышқылдарында темір енжарланады, өйткені ерімейтін қосылыстардың қорғағыш қабықшасымен қапталады.
Темір белсендігі төмен металдарды тұздарынан тотықсыздандырады:
0 +2 +2 0
Fe + CuC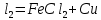
Темір оксидтері. FeO – қара түсті ұнтақ, суда ерімейді. Негіздік қасиеттер көрсетеді:
FeO + 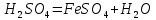
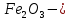 күрең, қоңыр ұнтақ, суда ерімейді. Бұл оксидке де негіздік қасиеттер тән:
күрең, қоңыр ұнтақ, суда ерімейді. Бұл оксидке де негіздік қасиеттер тән:
F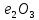 + 3
+ 3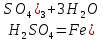
Бірақ жоғары температурада ол екідайлы оксилтер сияқты негіздік оксидтермен және балқытқанда сілтілермен қосылады:
CaO + 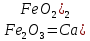
кальций ферриті
Кальций ферриті цемент өндірісінде түзіледі.
Қолданылуы. Таза темірді шеге, тез магниттелу және магнитсіздену қабілетіне байланысты электромагниттік құралдардың бөлшектерін (трансформаторлар, электромотор) және т.б. жасау үшін қолданады. Темірдің құймалары – шойын және болат көп қолданылады. Бұлар техниканың басты конструкциялық материалдары.
Дүние жүзінде темір мен оның құймаларын қалған барлық металдарға қарағанда 20 есе артық өндіреді.
Металдардың жемірілуі. Металдар мен құймалар әр түрлі заттармен жанасқанда, олармен әрекеттесіп, химиялық қосылыстар түзеді. Әсіресе жаңбыр, топырақ ылғалы, ауа әсерінен қоршаған ортадағы металдар бүлініп желінеді. Бұл кезде металдан жасалған бұйымның қасиеті мүлдем өзгеріп, ол біртіндеп бүліне бастайды. Бұл өте зиянды әрі қауіпті процесс жемірілу деп аталады (коррозия — лат. korrosio — желіну деген сөз). Қоршаған орта факторларының әсерінен болатын металдың желіну құбылысы жемірілу (коррозия) деп аталады. Металдар мен құймалардан жасалған өнеркәсіптік қондырғылар, ауылшаруашылық техникасы, қатынас келіктерінің тетіктері, энергетика және химия өнеркәсібінің қондырғылары жемірілуге ұшырайды. Жемірілудің келтірген зиянынан металл бұйымдар пайдалануға жарамсыз болып қалады, бұл тіпті түрлі апаттарға соқтыруы мүмкін. Металдардың бәрі бірдей жемірілуге ұшырай бермейді. Кернеу қатарында күмістен соң орналасқан металдар "бекзат металдар" деп аталады, олар іс жүзінде бүлінбейді. Сондықтан бұл металдарды және олардың құймаларын жемірілуге тыйым салынған жерлерде қолданады. Мысалы, электрондық өнеркәсіпте, ғарыштық техникада контактілер жасау үшін алтынды пайдаланады. Кернеу қатарында магнийдің сол жағында орналасқан сілтілік және сілтілікжер металдар "бекзат металдарға" қарама-қарсы қасиетке ие. Олар көдімгі жағдайдың өзінде қоршаган ортадағы көптеген заттармен (ең алдымен, оттекпен және сумен) оңай әрекеттеседі, сондықтан қондырғылар мен аппараттар жасауға пайдаланылмайды. Кернеу қатарының орта шенінде жемірілуге баяу ұшырайтын металдар орналасқан. Олардың біразы, мысалы, Mg, Zn, Al, Cr, Ni жемірілуге тәзімді, себебі металдардың бетінде оксидтен тұратын өте жұқа қабықша пайда болып, металдарды қоршаған ортамен жанасудан сақтап тұрады. Адамдар темірдің таттануын жиі кездестіреді, жемірілген темірдің бетін кеуек қоңырқай тат қабаты басады.
Жыл сайын дүние жүзінде алынатын темір массасының 1/4-і жемірілуге ұшырап, бүлініп отырады. Темірдің таттануы, әдетте, оттектің әсерінен болады:
2Fe0 + 2Н2О + О2 = 2Ғе(ОН)2
Оттек молекуласы темірді алдымен Ғе+2, содан кейін Ғе+3 катионына айналдырады:
Тотықсыздандырғыш 2Ғе0 — 2ē —> 2Ғе+2
Тотыктырғыш О02 + 4ē = 2О2-2
4Ғе(0Н)2 + 2Н2О + О2 -> 4Ғе(0Н)3
Тотықсыздандырғыш Fe+2 — ē —> Fe+3
Тотыктырғыш О02+4ē —> 2О-2
Жалпы алғанда, металдардың және олардың құймаларының қоршаған орта әсерінен жемірілуге ұшырауын химиялық және электрохимиялық деп екіге бөледі. Бүкіл әлемде адамның белсенді іс-әрекетінің нәтижесінде қоршаған ортаның ластануы шекті деңгейге жетіп отыр. Осыған орай, металдар мен құймалардың жемірілуі де күшейіп келеді. Қазір ғылым мен практика жемірілу процесін шектеудің, азайтудың, тіпті мүлдем болдырмаудың көптеген әдіс-тәсілдерін ұсынады. Жалпы алғанда, жемірілумен күресудің бірнеше бағыттары бар. Жемірілу электролит ерітінділерінде өтеді. Ол белсенділігі төмен металдардың қатысуымен күшейе туседі. Электрондардын ауысуымен, микротоктың пайда болуымен жүреді. Мысалдар: тасымал құбырлардың, рельстердін, кеме корпусының, әр түрлі металдан жасалған конструкциялардың желінуі. Жоғары температурада бейэлектролит тотыктырғыштардың әсерінен бүлінеді. Тотықтырғыштар: О2, Cl2, SO2, және басқа газдар, әртүрлі отын түрлері, су буы. Қоршаған ортаның әсерінен металдардың бүлінуін жемірілу (коррозия) деп атайды. Жемірілу тотығу-тотықсыздану процесіне жатады, оның жүруі металдардың белсенділігіне тәуелді. Белсенді металдар оңай жеміріледі. "Бекзат металдар" жемірілмейді. Металдардың жемірілуін болдырмау шараларын білу керек.
Дәріс:1
Тақырыбы: Органикалық зат және көмірсутек қосылысы. Органикалық химия пәні. Органикалық заттардың химиялық құрылыс теориясы.
Мақсаты: Органикалық химия пәні, даму тарихы, оның маңызы, қарайтын негізгі мәселелері мен нысандарымен, органикалық қосылыстар мен реакциялардың классификациясымен танысу.
Жоспары:
-
Органикалық химияның даму тарихы
-
Жаңа органикалық қосылыстарды синтездеу, олардың өсімдік және жануар организіміне әсері, өндіріс қалдықтарын іске асыру жолдары.
-
А.М.Бутлеров жасаған органикалық қосылыстардың құрылыс теориясы
-
Органикалық қосылыстардың классификациясы
Органикалық химия ғылым ретінде XIX ғасырдың ортасында пайда болды. Алғашқы даму сатысында органикалық химия өсімдіктер мен жануар организімінде түзілетін заттарды зерттеді. Сондықтан “организм” деген сөзден “органикалық химия” деген келіп шықты. Қазіргі кезде органикалық химия деп көміртек қосылыстарының химиясын атайды. Сонымен: органикалық химия органикалық қосылыстардың құрамын, құрылысын, қасиеттерін және өзгерістерін зерттейтін ғылым. Ал, органикалық қосылыстар дегеніміз құрамында көміртегі болатын қосылыстар (СО, СО2, Н2СО3 және тұздарынан басқа). Адамдар ежелден-ақ органикалық қосылыстарды пайдаланып, олардан әр түрлі өнімдер шарап, сыра, бал, сірке суы, органикалық бояулар – индиго, ализарин, эфир майлары, қант т.с.с. алды. Бірақ ол кезде органикалық және бейорганикалық қосылыстардың айырмашылығын ескермеген. Оқымыстылар ол кезде органикалық заттар тек өсімдік немесе жануар организімінде түзіледі деген пікірде болды. Бұл ағым “витализм” (латынның “vita” - өмір, тіршілік деген сөзінен) деп аталды. Бірақ 1824 ж. неміс дәрігері және химигі Фридрих Велер, тұңғыш рет бейорганикалық газ тәрізді зат дицианды сумен қыздырып, органикалық қосылыс қымыздық қышқылын алды:

Осыдан 4 жыл өткесін 1828 ж. Велер мочевинаны синтездеді (циан қышқыл Н4 қыздырып ): NH2 – C - NH2 Велердің бұл жұмыстары
O
органикалық қосылыстарды химиялық әдіспен бейорганикалық қосылыстардан, ешқандай “өмір күшінсіз” алуға болатынын дәлелдеп берді. Сосын, аз уақыт ішінде әр түрлі елдерде: Ресейден Зинин 1842 ж. – анилин, Бутлеров 1861 ж. – қантты затты (углевод), Германияда Кольбе 1845 ж. – сірке қышқылын, Францияда М. Бертло 1954 ж. – майды синтездеп алды. Қазіргі кезде белгілі органикалық қосылыстардың саны
5 млн., ал бейорганикалық қосылыстар Темір
Металдардың жемірілуі
Органикалық химияның даму тарихы
Жаңа органикалық қосылыстарды синтездеу, олардың өсімдік және жануар организіміне әсері, өндіріс қалдықтарын іске асыру жолдары.
А.М.Бутлеров жасаған органикалық қосылыстардың құрылыс теориясы
Органикалық қосылыстардың классификациясы

