ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.02.2024
Просмотров: 202
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Тақырыбы: VІ А топша элементтерінің жалпы сипаттамасы. Күкірт. VІІ А топша элементтерінің жалпы сипаттамасы. Хлор.
Мақсаты: VІ А топша элементтерінің жалпы сипаттама: период және топ бойынша кейбір физикалық және химиялық қасиеттерінің өзгеру заңдылықтарымен таныстыру және олардың элемент атомдары құрылысымен таныстыру.
Жоспары:
-
VІ А топша элементтерінің жалпы сипаттамасы. -
Күкірт. -
VІІ А топша элементтерінің жалпы сипаттамасы. -
Хлор.
VIA топша элементтеріне - оттек, күкірт, селен теллур және радиоктивті полоний жатады.Бірінші төртеуінде бейметалдық сипаты бар және олар халькогендер кен түзуші деген мағынаны білдіретін жалпы атаумен біріктіріледі.VIA топша элементтерінің атомдарының сыртқы денгейлерінде 6 электроннан бар; екеуі 8 - орбитальда, төртеуі р - орбитальда;
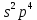 Оның р-күйдегі екі электроны жұптаспаған . Бұл олардың валенттігі қозбаған күйде екіге тең екенің көретеді.Оттек атомы құрылысының ерекшелігі - оның сыртқы деңгейіндегі электрондары таралып орналасатындай d-деңгейшесі жоқ. Сондықтан оттектін валенттігі 2 - ге тең (оттек атомы бөлінбеген электрон жұптарын жұптарының есебінен кейде донорлы - акцепторлы механизм бойынша қосымша байланыс түзіледі.) Қалған халькоген атомдарының сыртқы қабаттарында d-денгейшесі бар. Сырттан энергия келгенде р- және s- элоктрондарының d- күйге ауысуы болады. Сондықтан олар 2 ғана емес, 4 және 6 валенттік қөрсете алады.Полонийден басқа VIA топша элементтері VIIA топша элементтеріне қарағанда белсенділігі төмен болғанымен - типтік бейметалдар.Халькогенидтерінде, яғни олардың элоктрон элементтерімен қосылыстарында, сонымен бірге халькогендер сутекпен қосылыстарында -2 тотығу дәрежесін көрсетеді. Оттекпен және басқа бейметалдармен ,мысалы , күкірт, селен теллурмен қосылыстарында +4 немесе +6 тотығу дәрежелерін көрсетеді. Оттек электртерістігі бойынша фотордан кейін тұратындықтан оттек фторитінде
Оның р-күйдегі екі электроны жұптаспаған . Бұл олардың валенттігі қозбаған күйде екіге тең екенің көретеді.Оттек атомы құрылысының ерекшелігі - оның сыртқы деңгейіндегі электрондары таралып орналасатындай d-деңгейшесі жоқ. Сондықтан оттектін валенттігі 2 - ге тең (оттек атомы бөлінбеген электрон жұптарын жұптарының есебінен кейде донорлы - акцепторлы механизм бойынша қосымша байланыс түзіледі.) Қалған халькоген атомдарының сыртқы қабаттарында d-денгейшесі бар. Сырттан энергия келгенде р- және s- элоктрондарының d- күйге ауысуы болады. Сондықтан олар 2 ғана емес, 4 және 6 валенттік қөрсете алады.Полонийден басқа VIA топша элементтері VIIA топша элементтеріне қарағанда белсенділігі төмен болғанымен - типтік бейметалдар.Халькогенидтерінде, яғни олардың элоктрон элементтерімен қосылыстарында, сонымен бірге халькогендер сутекпен қосылыстарында -2 тотығу дәрежесін көрсетеді. Оттекпен және басқа бейметалдармен ,мысалы , күкірт, селен теллурмен қосылыстарында +4 немесе +6 тотығу дәрежелерін көрсетеді. Оттек электртерістігі бойынша фотордан кейін тұратындықтан оттек фторитінде 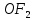 +2, пероксидтерде - 1 қалған қосылыстарда -2 тотығу дәрежесін көрсетеді.
+2, пероксидтерде - 1 қалған қосылыстарда -2 тотығу дәрежесін көрсетеді.VIA топша элементтерінің сутекті қосылыстарын (гидридтерін)
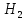 Э жай заттардан (немесе күшті қышқылдармен халькогидтерге әсер етіп) синтездеп алды.Судағы ертінділерінде олар әлсіз қышқылдық қасиет көрсетеді. Гидридтердің диссоциясы екі дайлы , судан теллусутекке өткенде күшейеді , бұл Э
Э жай заттардан (немесе күшті қышқылдармен халькогидтерге әсер етіп) синтездеп алды.Судағы ертінділерінде олар әлсіз қышқылдық қасиет көрсетеді. Гидридтердің диссоциясы екі дайлы , судан теллусутекке өткенде күшейеді , бұл Э
2 ионы радиусымен артуымен түсіндіріледі. Сонымен қатар судың полюсті молекуласы түзіліп , ассоциялануға қабілетті болады. VIA топша элементтерігидридтерінің ұшқыштығы судан күкіртсутекке қарай қушті артады , бірақ қайтадан селенсутекте және теллурсутектекемиді.судың салыстырмалы төмен ұшқыштығы оның молекуласының сұық күйде сутектік байланыс түзіп , ассоцияланауымен байланысты.Күкірт , селен және теллур ЭО2 және ЭО3 типті қышқылдықоксидтердің екі қатарын түзетеді. Н2ЭО 2 типті қышқылдарда бұл элементтер +4 тотығу дәрежесін көрсетеді,тұрақсыз; тотығу - тотықсыздану реакцияларында мұндай қышқылдар (сондай - ақ олардың тұздары) тотықтырғыш та, тотықсыздындырғыш та болады.Н2ЭО4 типті қышқылдар (Э - нің тотығу дәрежесі +6 - ға тең) едеуір тұрақты , реакцияларда тек тотықтырғыштар; олардың тотықтырғыштық белсенділігі күкірт қышқылынан H2SeO4 күшті ,алтеллур қышқылы Н2ТеО4
 2Н2О (немесе Н2ТеО6) әлсіз.
2Н2О (немесе Н2ТеО6) әлсіз.
Оттек
Периодтық жүйедегі орны және атом құрылысы.
Оттек VIA топ элементі
Оның электрондық формуласы
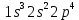
Ашылуы және табиғатта таралуы . Таза оттекті бірінші рет швед ғалымы К.Шееле 1772 ж.алған. Оттек - ең көп таралған элемент .Жер қыртысындағы оттектің массалық үлесі 49,13% -ті құрайды. Табиғатта оттек бос күйінде де кездеседі. Ол бос күйінде ауада ( масса бойынша 23,2%) немесе көлем бойынша 20,9% ) байланысқан күйінде - судың , минералдың өсімдіктердің , жануарлардың құрамына кіреді.
Жер бетіндегі барлық бос оттек фотосинтез процесінің нәтижесінде пайда болды және сақталады.
6СО2 + 6Н2О ⇾хлорофилл жарық С6Н12О6 + 6О2
Тыныс алу , жану және шіру процестері атмосфералық оттекті байланыстырады Жоғарыда көрсетілген реакция кері бағытта жылуды бөлумен жүреді. Фотосинтез бен оттекті байланыстыру процестері үйлесімі табиғаттағы оттектің айналымын құрайды. Табиғатта оттектің тұрақты үш изотобы:14 О , 17 О және 15 О бар орташа мөлшері 99, 759; 0,037 және 0,204%. Бос күйінде екі аллотропиялық түр өзгерісте , оттек
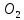 және озон
және озон 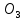 түрінде болады.
түрінде болады.Физикалық қасиеттер. Оттек - бұл дәмсіз және иіссіз , түссіз газ. 1 л оттектің массасы 1,43 г.
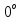 С температурасы 100 көлем суда 4,9 көлем оттек ериді. Бұл балықтардың және басқа теңіз түбінде өмір сүретіндердің тіршілігі үшін толық жеткілікті.
С температурасы 100 көлем суда 4,9 көлем оттек ериді. Бұл балықтардың және басқа теңіз түбінде өмір сүретіндердің тіршілігі үшін толық жеткілікті.Газтектес оттек -
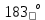 С - та ашық көгілдір түсті сұйықтыққа айналады, ал - 219 С - қа дейін салқындатқанда бұл сұйықтық - көк түсті , қар тәрізді масса түзіп қатады. Демек , оттек толтырылған баллондарды көгілдір түске бояйтыны кездейсоқтық емес.
С - та ашық көгілдір түсті сұйықтыққа айналады, ал - 219 С - қа дейін салқындатқанда бұл сұйықтық - көк түсті , қар тәрізді масса түзіп қатады. Демек , оттек толтырылған баллондарды көгілдір түске бояйтыны кездейсоқтық емес.Химиялық қасиеттері. Қыздырғанда оттек күкіртпен, көміртекпен, фосформен қосылып, оксидтер түзеді.
С +
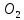 =
= 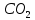
S +
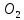 =
= 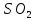
4P + 5
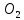 = 2
= 2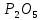
Қыздырғанда оттек сутекпен қопарылыс бере әрекеттесіп су түзеді:
2
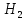 +
+ 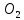 = 2H 2 O
= 2H 2 OГалогендермен тікелей әрекеттеспейді.
Натрий, калий және басқа белсенді металдароттекпен кәдімгі температурада әрекеттеседі:
2Na +
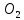 =
= 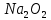
4K +
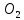 = 2K2O
= 2K2OОттек адамдар мен жануарлардың тіршілігінде маңызды рөл атқарады.Оттек қатысында маңызды процестірдің бірі - тыныс алу жүзеге асады. Көмірсулардың, майлардың және белоктардың оттекпен тотығу , тірі организмдердің энергия көзі болып табылады.адаморганизде оттек дене массасының 61% - тін құрайды. Әр түлі қосылыстар түрінде ол барлық органдарының, ұлпалардың және биологиялық сұйықтықтардың құрамына кіреді. Адам тәулігіне 20 - 30м ауамен тыныс алады. Ауада оттектің жетіспеуі адамның іс-әрекетіне едәуір әсер етеді. Мәселен, ауада оның мөлшері 12 - 10% - ка дейін кемігенде адамның ойлау қабілеті төмендейді , есте сақтауы көмекселенеді , ал 8 - 9% - ке дейін кемігенде адам есінен танады, ал 6% -ке дейін кемігенде тынысалуы тоқтайды. Ауру адамның тыныс алуы қиындағанда немесе уланған жағдайда оттекпен тыныс алдырады оттек ұшқыштардың , өртсөндіргіштердің және т.б. тыныс алу аспаптарында болады. Оттек техникада металлургиялық процестерді жеделдету үшін кеңінен қолданылады. Оттекті жоғары температура алу үшін де қолданылады, мысалы, металдарды дәнекерлегнде және автогенді кесуде жоғары температураға пайдаланады.
Галогендер VIIA топшада орналасқан, олар: фтор F, хлор С1, бром Вr, йод I, астат At. Астат - радиобелсенді элемент. Олардың валенттілік электрондарының жалпы формуласы ns2 nр5 (n=2-6). Бұл элементтердің топтық атауы «тұз түзуші» деген түсінікке сәйкес келеді. Галогендердің соңғы электрондары р-деңгейшесіне түседі, сондықтан олар р элементтеріне жатады. Топ бойынша жоғарыдан төмен қарай олардың атом радиустары артады, қайнау температурасы мен тығыздықтары да осы бағытта өседі. Олардың агрегаттық күйлері газдан (F
2, С12) сұйықтыққа (Вr2), ары қарай қатты (І2) күйге өзгереді, түстері де біртіндеп қоюлана түседі. Галогендер типтік бейметалдар, себебі олардың сыртқы валенттілік қабаттарының толысуына бір ғана электрон жетіспейді, оны қосқанда тотықтырғыштық қасиет көрсетіп, өзінен кейін тұрған бекзат газдардың электрондық кұрылысын алады.
Хлор (лат. Chlorum, Cl) — элементтердің периодтық жүйесінің VІІ тобындағы химиялық элемент, атомдық номері 17, атомдық массасы 35,45; галогендер тобына жатады. Молекуласы екі атомнан (Cl2) тұрады; өткір иісті сарғылт, жасыл түсті улы газ; тығыздығы 0,3214 г/см3. Балқу t – 101°С; Табиғатта екі тұрақты изотопы 105 жыл); 38Сl(Т1/2 37,29 мин)] химиялық және биохимиялық процестерді зерттеуде пайдаланылады. Хлорды алғаш швед химигі К. 3,08(35Cl мен 37Cl) бар. Жасанды радиоактивті изотоптарының ішіндегі маңыздылары [34Сl(Т1/2 32,4 мин); 36Сl (Т1/2 Шелле пиролюзитті тұз қышқылымен әрекеттестіріп алған (1774). Жер қыртысындағы салмақ мөлшері 4,5102%. Хлор өте активті элемент, бос күйінде жанартау лавасында ғана, ал байланысқан түрінде тау жыныстарында, теңіз, мұхит, өзен суларында, өсімдік және жануарлар организмдерінде кездеседі. Байланыстағы хлор көптеген минералдардың: галит, сильвин, сильвинит, карналлит, т.б. құрам бөлігі. Қалыпты жағдайда хлор — сарғыш жасыл, ерекше өткір иісті газ, тығыздығы 3,214 г/л, ауадан 2,5 есе ауыр, қайнау t –33,6С, балқу t –100,98С. Суда жақсы ериді. Тотығу дәрежелері +1, +3, +4, +5, +7. Хлор химиялық активті болғандықтан оның қосылыстары көптеген металдармен,бейметалдармен тікелей әрекеттестіру арқылы, ал оттек, азот, көміртек, инертті газдармен хлор қосылыстары жанама жолмен алынады. Хлор кальций гидрототығымен белгілі жағдайда әрекеттесіп, маңызды техникалық өнімдер (

