ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.02.2024
Просмотров: 181
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Гидролиз тұрғысынан тұздар 4 топқа жіктеледі:
-
күшті негіз бен күшті қышқылдан; -
күшті қышқыл мен әлсіз негізден; -
әлсіз негіз бен күшті қышқылдан; -
әлсіз негіз бен әлсіз қышқылдан түзілген.
Күшті қышқыл мен күшті негізден түзілген тұздардан [KCl, NaCl, Ca(NO3)2] басқасы гидролизденеді. Тұздар қышқылдармен, сілтілермен және өзара ион алмасу реакцияларына түседі, металдармен әрекеттеседі. Тұздарды алудың 10-нан аса жолы бар. Тұздар табиғатта кең таралған. Тұздар қатты (ас тұзы) және еріген күйінде көл, теңіз, мұхит суларында, өсімдіктер мен жануарлар организмінде кездеседі. Тамақ өнеркәсібінде, ауыл шаруашылығында, медицинада, металлургия, шыны, т.б. өнеркәсіп салаларында, тұрмыста кеңінен қолданылады.
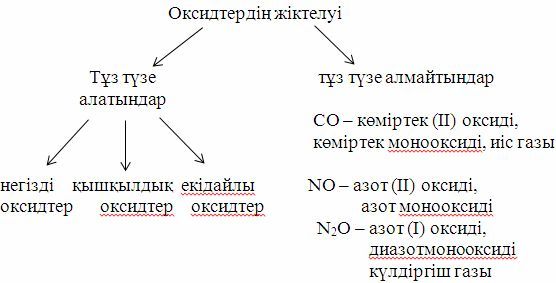
Күрделі қосылыстардың үлкен бір тобы (класы) - оксидтер. Оксидтер үшке бөлінеді: қышқылдық, негіздік, екідайлы (амфотерлі). Қышқылдық оксидтерге - қышқылдар, негіздік оксидтерге - негіздер сәйкес келеді. Р2О5→Н3РО4; SО3→H2SО4; Na2О→NaОH; СаО→Са(ОН)2. Ал екідайлы оксидтерге кышқылдар да, негіздер де сәйкес келеді, мысалы, H2ZnО2← ZnO→Zn(OH)2
Кейбір қышқылдық оксидтер сумен әрекеттесіп қышқылдар түзеді:
Р2O5+ЗН2O=2Н3РO4;
SO2+H2O=H2SO3;
СO2+Н2O=Н2СO3
Мысалы, күлгін лакмус ерітіндісі тамызылған суға көмірқышқыл газын жіберсек, оның түсі күлгіннен біртіндеп қызыл түске өзгереді. Нәтижесінде әлсіз, тұрақсыз көмір қышқылы түзіледі.
қышқылдық оксид + су = қышқыл
Қышкылдық оксидтер негіздік оксидтермен әрекеттесіп тұз түзеді.
CO2+CaO=CaCO3
P2O5=2Na3PO4
қышқылдық оксид + негіздік оксид = тұз
Қышқылдық оксидтер сілтілермен әрекеттесіп тұз және су береді.
SO3+2NaOH=Na2+H2O
Cr3+Ca(OH)2=CaCrO4+H2O
қышқылдық оксид + сілті = тұз + су
Белсенді металдардың оксидтері сумен әрекеттесіп сілті түзеді.
Na2O+H2O=2NaOH
CaO+H2O=Ca(OH)2
Дәріс: 6
Тақырыбы: Химиялық реакциялар және олардың жіктелуі. Тотығу-тотықсыздану реакциялары.
Мақсаты: Химиялық рекация жылдамдығы туралы алған білімдерін ары қарай жетілдіру, химиялық реакция жылдамдығыына әсер етуші факторлар, әсер етуші массалар заңы туралы және Вант-Гофф ережесін түсіндіре отырып, білімді қалыптастыру, химиялық реакцияның жылдамдығына әсер етуші факторларды түсіндіре білу, қорытындылау.
Жоспары:
-
Химиялық кинетиканың түсініктері. -
Химиялық реакцияның жылдамдығы, әсер етуші массалар заңы. -
Температураның реакция жылдамдығына әсері. Вант – Гофф ережесі. -
Химиялық реакцияның жылдамдығына катализатордың әсері туралы түсінік. -
Химиялық тепе – теңдік туралы түсінік. Химиялық тепе – тендіктің ығысуы. Ле – Шателье ережесі.
Химиялық кинетика – реакцияның жылдамдығы мен механизмі туралы ілім.
Химиялық реакцияның жылдамдығы дегеніміз - әрекеттесуші заттардың біреуінің концентрациясының уақыт бірлігінде өзгеруі.
V.= ∆С/∆t , моль/мин.
Химиялық реакция барысында реакцияға кіретін заттар концентрациясы азайып, реакция өнімділігінің концентрациясы жоғарлайды.
V
гомог.=∆С/ V. ∆t, моль/мл.мин.
Vгетер.= .=∆C/ S. ∆t, моль/см2.мин
Химиялық реакция жылдамдығына әртүрлі факторлардың әсері.
1. Концентрацияның әсері.
А + В = АВ
Әрекеттесуші заттар А,В , өнім- АВ
Химиялық реакция жылдамдығының концентрацияға тәуелділігін әсер етуші массалар заны сипаттайды. Химиялық реакция жылдамдығы әрекеттесуші заттар концентрациясының көбейтіндісіне тура пропорционал, ал олардың стехиометриялық коэффициенттері дәреже түрінде алынады.
aA + вВ = сС + dD.
V=K[A]a[B] b тура реакция
V= K[ C ]cD]d кері реакция
К - жылдамдық константасы,
олар әсер етуші заттар табиғатына,температураға тәуелді,бірақ концентрациаға тәуелді емес. Әсер етуші массалар заңын 1868 ж. Гульдберг және Вааге ашқан. Егер [А] = [В] = 1, онда V=K жылдамдық константаға тең болады.
2. Жылдамдыққа температураның әсері.
Әсер етуші массалар заңы кез – келген температураға сәйкес, бірақ тұрақты жылдамдықта температураның әсерінен өседі.Жылдамдыққа температураның әсерін Вант – Гофф ережесі сипаттайды:реакция температурасын әр 100С көтергенде ракция жылдамдығы 2 немесе 4 есе өседі.
γ – температуралық коэффициент.
3. Реакция жылдамдығының катализатор қатысына тәуелділігі.
Химиялық реакция жылдамдығын катализатор өзгертеді, ол тура және кері реакция жылдамдығына бірдей әсер етеді. Катализатордың қатысы нәтижесінде активті молекулалар саны артады да , жылдамдық өседі. Катализатор реакция жылдамдығын арттырса оң катализ деп ,ал төмендетсе теріс катализ деп атайды.
Катализатор қатысуымен жүретін реакцияларды катализдеп атайды.
Реакция жылдамдығын тежейтін катализаторды ингибитор, биологиялық катализаторды – ферменттер деп атайды.
Химиялық тепе – теңдік туралы түсінік.
Химиялық реакцияның 2 түрі бар:
-
Қайтымды -
Қайтымсыз
Қайтымсыз реакция – тек бір бағытта жүреді және әрекеттесуші заттың біреуі толық шығындалады.
Қайтымды реакция – кері және тура бағытта жүреді.
Егер бірқалыпты үрдісте кері және тура реакция жылдамдықтары бір- біріне тең болса бұл жағдайды тепе-теңдік күй деп атайды.
V1= V2
Химиялық тепе– теңдік күйдегі әрекеттесуші заттардың концентрациясын тепе – теңдік концентрациялары деп атайды. Химиялық тепе – теңдікке әртүрлі факторлар әсер етеді. Осы әсер ету жағдайы Ле – Шателье ережесімен сипатталады. Тепе – теңдік күйдегі жүйеге сырттан әсер етсе , тепе – теңдік сол әсерді баяулататын жаққа қарай ығысады.
1. Тепе – теңдіктің ығысуына концентрация әсері.
Егер әрекеттесуші заттар концентрациясын көтерсек, тепе – теңдік оңға - өнім жағына ығысады.
Әекеттесуші заттар концентрациясын көтерсе, тепе теңдік оңға өнім жағына жылжиды, ал өнім концентрациясын көтерсе тепе-теңдік солға,әрекеттесуші заттар жағына жылжиды.
2.Тепе–теңдікке қысымның әсері.
Егер қысымды көтерсек, тепе – теңдік моль саны аз жаққа, бұл жүйеде оңға ығысады.
N2 +3H2 ↔2NH3
Егер қысымды төмендетсек, тепе-теңдік моль саны көп жаққа ығысады.
Егер көлем өзгермесе қысым тепе-теңдікке әсер етпейді.
3.Тепе-теңдікке температураның өзгерісінің әсері.
Температура жоғарылағанда қарама – қарсы екі процесс жылдамдығы бірдей өзгереді,бірақ эндотермиялық процесс күшті ұлғаяды,ал температураны төмендетсе керісіше экзотермиялық процесс ұлғаяды.
Химиялық тепе –теңдік кездегі температураның әсерін білу үшін үрдістің жылу эффектсін (∆H) білу керек. Ол оң болса, температура әсері мәнді болады, ал нольге жақын болса, температураның өзгеруі тепе- теңдікке әсер етпейді.
Сондықтан, Ле – Шателье ережесіне сәйкес температура жоғарлағанда, тепе – теңдік эндотермиялық реакция бағытына қарай ығысады.
Температура төмендегенде, экзотермиялық реакция бағытына ығысады.
-
Эндотермиялық; -
экзотермиялық.
Температура жоғарлағанда солға ығысады. (эндотермиялық реакция жағына). Температура төмендегенде оңға ығысады. (экзотермиялық реакция жағына ).
∆H<0.
Температураны жоғарлатса- солға, әрекеттесетін заттар жағына,ал қысымды көтерсе - солға, төмендетсе оңға ығысады. Тепе – теңдік жылжымалы.
Ол бір тепе – теңдік күйден, екінші тепе – теңдік күйге ауыса алады, біраз өзгерістен кейін, қайтадан қалпына келеді
V=K[A]a[B] b тура реакцияның жылдамдығы.
V= K[ C ]cD]d кері реакцияның жылдамдығы .
Тепе – теңдік константасын табу үшін [К], соңғы заттар концентрациясының көбейтідісін алғашқы заттар концентрациясы көбейтіндісіне бөледі.
Дәріс:7
Тақырыбы: Тұздар гидролизі
Мақсаты: Тұздардың гидролизінің типтерін,тұздар гидролизінің теңдеулерін құруды, әр түрлі тұз ерітінділерінің ортасын болжап айтуды үйрену.
Жоспары:
-
Тұздар гидролизі
Тұздар химиялық қосылыстар класы; қышқыл
молекулаларындағы сутек
атомдарының орны толықтай немесе жартылай металл атомдары не ОН топтарына ауысқан қосылыстар; қалыпты жағдайда иондық құрылымдағы кристалл заттар. Тұздар ерте заманнан белгілі. 1812 жылы Я.Берцелиус тұздардың электрхимиялық теориясын құрды. Электролиттік диссоциациялану теориясы шыққаннан кейін, тұздардың суда ерігенде металл атомдары катиондарын және қышқыл қалдығы аниондарын түзетін күрделі заттар екені анықталды.
Натрий сульфатының формуласын құрумен танысайық:
Na2SO4
-
валенттіліктерінің ең кіші ортақ еселігін табу. -
ортақ еселікті әр топтың валенттілігіне бөліп, индекс етіп жазу:
2:1 = 2 (Na); 2 : 2 = 1 (S04).
сонда тұздың формуласы Na2S04. Ал натрийдің осы қышқылмен түзген екінші тұзында Na HS04 натрий мен қышқыл калдығының валенттіліктері өзара тең болғандыктан (I), тұздың формуласы NaHS04күйінде қалады.
Тұздар орта, қышқыл, негіздік, қос және кешенді болып бөлінеді.
-
Орта тұздар – сутек атомдары толық ауысса (Na2CO3, K3PO4, MgSO4); -
қышқыл тұздар – сутек атомдары металл атомдарымен біртіндеп алмасса (NaHCO3, K2HPO4); -
негіздік тұздар – құрамына гидроксил тобы енсе (MgOHCl, A1(OH)2Cl), қос тұздар – сутектің орнын бірнеше металл катиондары басса (KAl(SO4)2, NaK2PO4); -
кешенді тұздар – құрамында кешенді катион ([Cu(NH3)4]SO4) немесе кешенді анион (K[Fe(CN)6]) болса түзіледі.
Тұздар көбіне халықаралық номенклатура бойынша аталады. Тұздар суда ерігенде иондарға ыдырап, ерітінділері электр тогын өткізеді.
Гидролиз тұрғысынан тұздар 4 топқа жіктеледі:
-
күшті негіз бен күшті қышқылдан; -
күшті қышқыл мен әлсіз негізден; -
әлсіз негіз бен күшті қышқылдан; -
әлсіз негіз бен әлсіз қышқылдан түзілген.
Күшті қышқыл мен күшті негізден түзілген тұздардан [KCl, NaCl, Ca(NO3)2] басқасы гидролизденеді. Тұздар қышқылдармен, сілтілермен және өзара ион алмасу реакцияларына түседі, металдармен әрекеттеседі. Тұздарды алудың 10-нан аса жолы бар. Тұздар табиғатта кең таралған. Тұздар қатты (ас тұзы) және еріген күйінде көл, теңіз, мұхит суларында, өсімдіктер мен жануарлар организмінде кездеседі. Тамақ өнеркәсібінде, ауыл шаруашылығында, медицинада, металлургия, шыны, т.б. өнеркәсіп салаларында, тұрмыста кеңінен қолданылады. Тұздар негізінен катты заттар, олардың суда ерігіштігі арнайы кестеде беріледі (химия кабинетінде ілініп тұрады) және


