ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.02.2024
Просмотров: 187
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
«ерігіштік кестесі» деп аталады. Онда суда еритін заттар «е», аз еритіндері -«а.е», ерімейтіндері - «ем», суда тұрақсыздары сызықшаман (-) белгіленген. Тұздардың ішінде нитраттар жақсы ериді, ал барий сульфаты, кальций карбонаты, күміс хлориді, қорғасын (II) сульфиді т. т. іс жүзінде ерімейді. Калий мен натрийдің барлық түздары суда ерімтал келеді.
Тұздардың металдар мен әрекеттесуі белсенді металдар белсенділігі төмен металдарды олардың тұздарының құрамынан ығыстырып, орын басу реакциясы жүреді, нәтижесінде жаңа тұз бен бос күйіндегі металл алынады. Мысалы, сынауыққа мыс сульфатының ерітіндісін құйып, оған темір шеге салсақ, оның беті біраздан кейін қызыл мыспен қапталады:
CuSO4+Fe=FeSO4+Cu
Тұздардың гидролизі - тұздың құрамындағы иондары мен су молекулаларының арасында жүретін, нәтижесінде әлсіз электролит молекуласы не иондары түзілетін реакциялар.[3]
Тұздар түзілу табиғатына қарай мынадай топқа бөлінеді:
I. Күшті негіз бен күшті қышқылдан KCl, K2S04, NaN03, NaCl;
ІІ. Күшті негіз бен әлсіз қышқылдан Na2S, Na2C03, K2S03, Na3P04;
ІІІ. Әлсіз негіз бен күшті қышқылдан Al2(S04)3, FeS04, ZnCl2.
I.Натрий хлориді (NaCl) — NaOH күшті негіз (к.н.) және HCl күштіқышқыл (к.қ.) әрекеттескенде түзілетін тұз.
NaCl -->Na+ +CI-
НОН -->Н+ +ОН-
Диссоциация нәтижесінде пайда болған әр аттас иондар электростатикалық күштердің әсерінен тартылады. Сонда түзілген электролиттер күшті болғандықтан (NaOH, HCl) құрамдас бөліктеріне толық диссоциацияланады, сондықтан су иондарының концентрациялары өзгермейді . Сондықтан күшті негіз бен күшті қышқылдан түзілген тұздар гидролизге ұшырамайды, оның ортасы бейтарап болады.
IІ.Натрий карбонаты Na2CO3 - NaOH күшті негіз (к.н.) бен әлсіз көмір (Н2СО3) қышқылы (ө. к.) әрекеттескенде түзілген тұз.
Na2CO3 -->2Na+ +CO32-
НОН --> Н+ + OH-
Натрий карбонаты суда ерігенде түзілген С032- ионының сумен әрекеттесуі әлсіз электролит ионы НСО3- және ОН ионын береді. Олай болса орта негіздік, себебі түзілген натрий гидроксиді (NaOH) толық диссоциацияланады.
Күшті негіз бен әлсіз қышқылдың тұзы гидролизденгенде тұз құрамындағы қышқыл қалдық анионы су құрамынан сутек катионын қосып алып, ерітіндіге гидроксид ионы босап шығады, сондықтан орта негіздік (сілтілік) болады. Гидролиздену реакциясының молекулалық теңдеуі:
Na2C03 + НОН = NaHC03 + NaOH
IІI.Алюминий хлориді АlСl3 - Аl(ОН)3 әлсіз негіз (ө.н.) бен HCl күшті кышқыл (к.қ.) әрекеттескенде түзілген тұз.
АlСl->3 Аl3+ +3Cl-НОН -> Н+ + ОН-
АlСl3 ерігенде түзілген Аl3+ иондары судың ОН- иондарымен бірігіп (Аl0Н)2+ ионын түзеді, сутек ионы ерітіндіде қалады, ал түзілген қышқыл иондалады. Тұздардың гидролизге ұшырауы және олардың судағы ерітіндісіндегі ортасы тұздың құрамындағы иондардың қасиеттеріне тәуелді. Гидролизге тек ерімтал тұздар ғана түседі, гидролиз қайтымды үдеріс. Бейтараптану реакциясы тек күшті қышқыл мен күшті негіздің әрекеттесу реакциясы, яғни осы жағдайда ғана С(Н+) = С(ОН-) орындалып, орта бейтарап болады.
Дәріс: 8
Тақырыбы: Химиялық реакцияның жылдамдығы
Мақсаты: Химиялық реакциялар жылдамдығына әсер ететін факторларымен таныстыру, мағлұмат беріп, ол бойынша есеп шығаруға дағдыландыру. Химиялық реакцияның жылдамдығы, жылдамдыққа С, Т, өршіткі, әрекеттесуші заттардың табиғатының әсерін меңгеру. Формуланы қолданып есептер шығаруда логикалық белсенділіктерін кеңейту, білімдерін тереңдету .
Жоспары:
Химиялық реакциялардың жылдамдығымен заттардың өзгеруі туралы түсінік және олардың өндіріс масштабындағы алынуының экономикалық тиімділігіне байланысты. Химиялық реакцияның жылдамдығы мен механизмі туралы ілімді химиялық кинетика деп атайды. Химиялық реакцияның жылдамдығы деп көлемі өзгермейтін системада әрекеттесуші заттардың біреуінің концентрациясының уақыт бірлігінде өзгеруін атайды. Мұнда реакцияға қатысатын заттардың қайсысы туралы айтса да бәрі бір: олардын, барлығы реакция теңдеуі арқылы өзара байланысқан, бір заттың концентрациясының өзгеруіне сәйкес басқа барлық заттардың концентрациясының өзгеруін айтуға болады. Әдетте, концентрацияны моль/л, ал уақытты — секунд немесе минутпен өрнектейді. Мәселен, әрекеттесуші заттардың біреуінің алғашқы концентрациясы 1 моль/л, ал реакция басталғаннан кейін 4с концентрациясы 0,6 моль/л болса, онда реакцияның орташа жылдамдығы (1—0,6) (4 = 0,1 моль/л · с) болады.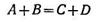
А заты жұмсалған сайын реакция жылдамдығы төмендейді (4.1-суретте көрсетілгендей). Бұдан, реакция жылдамдығын тек қана белгілі уақыт аралығында анықталатындығы байқалып отыр. А затының t
1 уақыт мезгіліндегі концентрациясы С1 -мен ал t2 мезгіліндегі С2-мен өлшенсе, онда ∆ t = t2— t1 уақыт аралығында заттың концентрациясының өзгеруі ∆С = С2-С1 болады, бұдан реакцияның орташа жылдамдығы (v) анықталынады: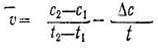
Теріс таңба қойылатын себебі А затының концентрациясының азайғанына, яғни С2-С1 айырымының мәні теріс болғанына қарамастан, реакция жылдамдығы тек қана оң шама болады. Реакция нәтижесінде алынған енімнің біреуінін. — С және D затының концентрациясының өзгеруін байқауға болады, ол реакция жүрген сайын жоғарылайды, сондықтан келтірілген теңдеудің оң жағына теріс таңба қою керек. Реакция жылдамдығы барлық уақытта өзгеріп отырады, сондықтан химиялық кинетикада реакцияның шын жылдамдығын, яғни уақыт мезгілі арасындағы жылдамдығын қарастырады. Химиялық реакцияның жылдамдығы әрекеттесуші заттардың табиғатына және реакцияның жүру жағдайына: концентрацияға С, температураға t, катализатордың қатысуына және көптеген басқа факторларға (мәселен, газдар арасындағы реакция үшін— қысымға, қатты зат болғанда — майдалануға, радиоактивтік сәулеге) байланысты болады.
Әрекеттесуші заттардың концентрациясының әсері. А және В заттарының арасында химиялық әрекеттесу болу үшін олардың молекулалары (бөлшектері) бір-бірімен соқтығысуы керек. Соқтығысу қаншалықты көп болса, реакция соншалықты жылдам жүреді. Әрекеттесуші заттардың концентрациясы жоғары болса соқтығысуда көп болады. Осындай көптеген эксперименталдық материалдардың арқасында реакция жылдамдығының әрекеттесуші заттар концентрациясына тәуелділігін анықтайтын химиялық кинетиканың негізгі заңы тұжырымдалған:
- химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрациясының көбейтіндісіне пропорционал болады.
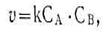
Мұндағы СА мен СВ —А және В заттарынын, концентрациясы моль/л, к k - реакцияның жылдамдық константасы деп аталатын пропорционалдық коэффициент. Химиялық кинетиканың негізгі заңын көбінесе әсер етуші массалар заңы деп атайды. Жылдамдық константасының k физикалық мәнін, анықтау қиын емес: оның сан мәні әрекеттесуші заттардың әрбірінің концентрациясы 1 моль/л немесе олардың көбейтіндісі бірге тең болғандағы реакция жылдамдығына тең. Жылдамдық константасы әрекеттесуші заттардың табиғатына, температураға тәуелді болады, бірақ олардың концентрациясына тәуелді емес. Реакция жылдамдығы мен әрекеттесуші заттардың концентрациясын бірге қарастыратын теңдеуді реакцияның кинетикалық теңдеуі деп атайды. Егер реакцияның кинетикалық теңдеуі тәжірибе жүзінде анықталған болса, онда ол арқылы әрекеттесуші заттардың басқа да концентрациясы үшін жылдамдықты есептеуге болады. Химиялық кинетиканың негізгі заңы қатты күйдегі әрекеттесуші заттардың концентрациясын есепке алмайды, себебі олардың концентрациясы тұрақты, олардың сыртқы беті ғана әрекеттесуге қатысады. Мәселен, көмірдің жану реакциясы үшін С+О2=СО2 реакцияның қинетикалық теңдеуі v = kс — болады мұндағы k жылдамдық константасы, с — қатты заттың концентрациясы; s — зат бетінің ауданы. Бұлар тұрақты шамалар. Тұрақты шамалардың көбейтіндісін R мен белгілеп, v = R С02 болатындығын табамыз яғни реакция жылдамдығы тек қана оттек концентрациясына пропорционал болады.
Температураның әсері.
Реакция жылдамдығының температураға тәуелділігі Вант-Гофф ережесі бойынша анықталады. Температураны әрбір 10°С көтерсе көптеген реакциялардың жылдамдығы 2—4 есе артады.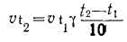
Мұндағы v1,v2 —бастапқы (t1) және соңғы (t2) температурадағы реакция жылдамдығы, ал γ - әрекеттесуші заттардың температурасын 10°С көтергенде реакция жылдамдығының неше есе өсетіндігін көрсететін реакция жылдамдығының температурасының коэффициенті. Вант-Гофф ережесі реакция жылдамдығына температураның қалай әсер ететіндігіне тек қана жуықтап баға береді. Температура реакция жылдамдығына әсер етіп жылдамдық константасын жоғарылатады.
Химиялық реакцияның жылдамдығын өзгертетін заттарды катализаторлар деп атайды. Кейбір катализаторлар реакцияны өте тез жылдамдатады — оларды оң катализ, немесе жай катализ деп атайды, ал кейбіреулері реакцияны баяулатады — оларды теріс катализ деп атайды. Оң катализдің мысалына платина катализатордың көмегімен күкірт қышқылының алынуы, аммиактың азо қышқылына тотығуы және т. с. с. Теріс катализдің мысалына этил спирті қатысқанда ауадағы оттегімен натрий сульфиті ерітіндісінің әрекеттесуінің бәсеңдеуі немесе аз мөлшердегі күкірт қышқылы (0,0001 м. б) қатысқанда сутегі пероксидінің беліну жылдамдығының баяулауы және т. б. жатады. Теріс катализді көбінесе ингибирлеу, ал реакция жылдамдығын бәсеңдететін теріс катализаторларды ингибиторлар (кейінгінің әсер ету механизмі катализаторларға қарағанда езгеше болады) деп атайды. Катализаторлар қатысқанда жүретін химиялық реакцияларды катализдік реакциялар деп атайды. Көптеген химиялық реакцияларға катализдік әсер етуге болады. Қатализаторлардың саны өте көп, ал олардын, катализдік активтілігі әртүрлі болады. Ол катализатор қатысқанда реакция жылдамдығының өзгеруімен анықталады. Катализатордың өзі реакцияларда жұмсалмайды және соңғы өнімнің кұрамына кірмейді. Катализдің екі түрі бар — гомогендік (бір текті) және гетерогендік (әртекті) қатализ. Гомогендік катализде әрекеттесетін заттармен катализатор бір фазалы газ немесе сұйық күйдегі жүйені түзеді, катализатор мен әрекеттесуші заттар арасында бөліну беті болмайды. Мәселен тұздар ерітіндісі (сұйық күйінде) қатысқанда сутегі пероксидінің катализдік ыдырауы. Гомогенді катализ үшін химиялық реакцияның жылдамдығын катализатор концентрациясына пропорционал екендігі анықталған. Гетерогенді катализде әрекеттесуші заттар мен катализатор әртүрлі фазалардан тұратын жүйе түзеді. Мұндай кезде катализатор мен әрекеттесуші заттар арасында бөліну беті болады. Әдетте катализатор — қатты зат, ал әрекеттесуші заттар — газдар немесе сұйықтықтар болады. Мәселен, платина қатысқанда (қатты күйдегі фаза) аммиактың тотығуы (газ күйіндегі фаза) немесе сутегі пероксидінің (сұйық күйіндегі фаза) көміртегі немесе марганец (IV) тотығы (қатты күйдегі фаза) қатысқанда ыдырауы. Химиялық реакциялардың барлығы гетерогендік катализде катализатордың бетінде жүреді. Сондықтан катализатордың активтігі оның бетінің қасиетіне (шамасына, химиялық құрамына, құрылысына және қалпына) тәуелді болады.
Тұздардың металдар мен әрекеттесуі белсенді металдар белсенділігі төмен металдарды олардың тұздарының құрамынан ығыстырып, орын басу реакциясы жүреді, нәтижесінде жаңа тұз бен бос күйіндегі металл алынады. Мысалы, сынауыққа мыс сульфатының ерітіндісін құйып, оған темір шеге салсақ, оның беті біраздан кейін қызыл мыспен қапталады:
CuSO4+Fe=FeSO4+Cu
Тұздардың гидролизі - тұздың құрамындағы иондары мен су молекулаларының арасында жүретін, нәтижесінде әлсіз электролит молекуласы не иондары түзілетін реакциялар.[3]
Тұздар түзілу табиғатына қарай мынадай топқа бөлінеді:
I. Күшті негіз бен күшті қышқылдан KCl, K2S04, NaN03, NaCl;
ІІ. Күшті негіз бен әлсіз қышқылдан Na2S, Na2C03, K2S03, Na3P04;
ІІІ. Әлсіз негіз бен күшті қышқылдан Al2(S04)3, FeS04, ZnCl2.
I.Натрий хлориді (NaCl) — NaOH күшті негіз (к.н.) және HCl күштіқышқыл (к.қ.) әрекеттескенде түзілетін тұз.
NaCl -->Na+ +CI-
НОН -->Н+ +ОН-
Диссоциация нәтижесінде пайда болған әр аттас иондар электростатикалық күштердің әсерінен тартылады. Сонда түзілген электролиттер күшті болғандықтан (NaOH, HCl) құрамдас бөліктеріне толық диссоциацияланады, сондықтан су иондарының концентрациялары өзгермейді . Сондықтан күшті негіз бен күшті қышқылдан түзілген тұздар гидролизге ұшырамайды, оның ортасы бейтарап болады.
IІ.Натрий карбонаты Na2CO3 - NaOH күшті негіз (к.н.) бен әлсіз көмір (Н2СО3) қышқылы (ө. к.) әрекеттескенде түзілген тұз.
Na2CO3 -->2Na+ +CO32-
НОН --> Н+ + OH-
Натрий карбонаты суда ерігенде түзілген С032- ионының сумен әрекеттесуі әлсіз электролит ионы НСО3- және ОН ионын береді. Олай болса орта негіздік, себебі түзілген натрий гидроксиді (NaOH) толық диссоциацияланады.
Күшті негіз бен әлсіз қышқылдың тұзы гидролизденгенде тұз құрамындағы қышқыл қалдық анионы су құрамынан сутек катионын қосып алып, ерітіндіге гидроксид ионы босап шығады, сондықтан орта негіздік (сілтілік) болады. Гидролиздену реакциясының молекулалық теңдеуі:
Na2C03 + НОН = NaHC03 + NaOH
IІI.Алюминий хлориді АlСl3 - Аl(ОН)3 әлсіз негіз (ө.н.) бен HCl күшті кышқыл (к.қ.) әрекеттескенде түзілген тұз.
АlСl->3 Аl3+ +3Cl-НОН -> Н+ + ОН-
АlСl3 ерігенде түзілген Аl3+ иондары судың ОН- иондарымен бірігіп (Аl0Н)2+ ионын түзеді, сутек ионы ерітіндіде қалады, ал түзілген қышқыл иондалады. Тұздардың гидролизге ұшырауы және олардың судағы ерітіндісіндегі ортасы тұздың құрамындағы иондардың қасиеттеріне тәуелді. Гидролизге тек ерімтал тұздар ғана түседі, гидролиз қайтымды үдеріс. Бейтараптану реакциясы тек күшті қышқыл мен күшті негіздің әрекеттесу реакциясы, яғни осы жағдайда ғана С(Н+) = С(ОН-) орындалып, орта бейтарап болады.
Дәріс: 8
Тақырыбы: Химиялық реакцияның жылдамдығы
Мақсаты: Химиялық реакциялар жылдамдығына әсер ететін факторларымен таныстыру, мағлұмат беріп, ол бойынша есеп шығаруға дағдыландыру. Химиялық реакцияның жылдамдығы, жылдамдыққа С, Т, өршіткі, әрекеттесуші заттардың табиғатының әсерін меңгеру. Формуланы қолданып есептер шығаруда логикалық белсенділіктерін кеңейту, білімдерін тереңдету .
Жоспары:
-
Химиялық реакция және оның жылдамдығы -
Химиялық реакцияға әсер ететін заттар.
Химиялық реакциялардың жылдамдығымен заттардың өзгеруі туралы түсінік және олардың өндіріс масштабындағы алынуының экономикалық тиімділігіне байланысты. Химиялық реакцияның жылдамдығы мен механизмі туралы ілімді химиялық кинетика деп атайды. Химиялық реакцияның жылдамдығы деп көлемі өзгермейтін системада әрекеттесуші заттардың біреуінің концентрациясының уақыт бірлігінде өзгеруін атайды. Мұнда реакцияға қатысатын заттардың қайсысы туралы айтса да бәрі бір: олардын, барлығы реакция теңдеуі арқылы өзара байланысқан, бір заттың концентрациясының өзгеруіне сәйкес басқа барлық заттардың концентрациясының өзгеруін айтуға болады. Әдетте, концентрацияны моль/л, ал уақытты — секунд немесе минутпен өрнектейді. Мәселен, әрекеттесуші заттардың біреуінің алғашқы концентрациясы 1 моль/л, ал реакция басталғаннан кейін 4с концентрациясы 0,6 моль/л болса, онда реакцияның орташа жылдамдығы (1—0,6) (4 = 0,1 моль/л · с) болады.
А заты жұмсалған сайын реакция жылдамдығы төмендейді (4.1-суретте көрсетілгендей). Бұдан, реакция жылдамдығын тек қана белгілі уақыт аралығында анықталатындығы байқалып отыр. А затының t
1 уақыт мезгіліндегі концентрациясы С1 -мен ал t2 мезгіліндегі С2-мен өлшенсе, онда ∆ t = t2— t1 уақыт аралығында заттың концентрациясының өзгеруі ∆С = С2-С1 болады, бұдан реакцияның орташа жылдамдығы (v) анықталынады:
Теріс таңба қойылатын себебі А затының концентрациясының азайғанына, яғни С2-С1 айырымының мәні теріс болғанына қарамастан, реакция жылдамдығы тек қана оң шама болады. Реакция нәтижесінде алынған енімнің біреуінін. — С және D затының концентрациясының өзгеруін байқауға болады, ол реакция жүрген сайын жоғарылайды, сондықтан келтірілген теңдеудің оң жағына теріс таңба қою керек. Реакция жылдамдығы барлық уақытта өзгеріп отырады, сондықтан химиялық кинетикада реакцияның шын жылдамдығын, яғни уақыт мезгілі арасындағы жылдамдығын қарастырады. Химиялық реакцияның жылдамдығы әрекеттесуші заттардың табиғатына және реакцияның жүру жағдайына: концентрацияға С, температураға t, катализатордың қатысуына және көптеген басқа факторларға (мәселен, газдар арасындағы реакция үшін— қысымға, қатты зат болғанда — майдалануға, радиоактивтік сәулеге) байланысты болады.
Әрекеттесуші заттардың концентрациясының әсері. А және В заттарының арасында химиялық әрекеттесу болу үшін олардың молекулалары (бөлшектері) бір-бірімен соқтығысуы керек. Соқтығысу қаншалықты көп болса, реакция соншалықты жылдам жүреді. Әрекеттесуші заттардың концентрациясы жоғары болса соқтығысуда көп болады. Осындай көптеген эксперименталдық материалдардың арқасында реакция жылдамдығының әрекеттесуші заттар концентрациясына тәуелділігін анықтайтын химиялық кинетиканың негізгі заңы тұжырымдалған:
- химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрациясының көбейтіндісіне пропорционал болады.
Мұндағы СА мен СВ —А және В заттарынын, концентрациясы моль/л, к k - реакцияның жылдамдық константасы деп аталатын пропорционалдық коэффициент. Химиялық кинетиканың негізгі заңын көбінесе әсер етуші массалар заңы деп атайды. Жылдамдық константасының k физикалық мәнін, анықтау қиын емес: оның сан мәні әрекеттесуші заттардың әрбірінің концентрациясы 1 моль/л немесе олардың көбейтіндісі бірге тең болғандағы реакция жылдамдығына тең. Жылдамдық константасы әрекеттесуші заттардың табиғатына, температураға тәуелді болады, бірақ олардың концентрациясына тәуелді емес. Реакция жылдамдығы мен әрекеттесуші заттардың концентрациясын бірге қарастыратын теңдеуді реакцияның кинетикалық теңдеуі деп атайды. Егер реакцияның кинетикалық теңдеуі тәжірибе жүзінде анықталған болса, онда ол арқылы әрекеттесуші заттардың басқа да концентрациясы үшін жылдамдықты есептеуге болады. Химиялық кинетиканың негізгі заңы қатты күйдегі әрекеттесуші заттардың концентрациясын есепке алмайды, себебі олардың концентрациясы тұрақты, олардың сыртқы беті ғана әрекеттесуге қатысады. Мәселен, көмірдің жану реакциясы үшін С+О2=СО2 реакцияның қинетикалық теңдеуі v = kс — болады мұндағы k жылдамдық константасы, с — қатты заттың концентрациясы; s — зат бетінің ауданы. Бұлар тұрақты шамалар. Тұрақты шамалардың көбейтіндісін R мен белгілеп, v = R С02 болатындығын табамыз яғни реакция жылдамдығы тек қана оттек концентрациясына пропорционал болады.
Температураның әсері.
Реакция жылдамдығының температураға тәуелділігі Вант-Гофф ережесі бойынша анықталады. Температураны әрбір 10°С көтерсе көптеген реакциялардың жылдамдығы 2—4 есе артады.
Мұндағы v1,v2 —бастапқы (t1) және соңғы (t2) температурадағы реакция жылдамдығы, ал γ - әрекеттесуші заттардың температурасын 10°С көтергенде реакция жылдамдығының неше есе өсетіндігін көрсететін реакция жылдамдығының температурасының коэффициенті. Вант-Гофф ережесі реакция жылдамдығына температураның қалай әсер ететіндігіне тек қана жуықтап баға береді. Температура реакция жылдамдығына әсер етіп жылдамдық константасын жоғарылатады.
Химиялық реакцияның жылдамдығын өзгертетін заттарды катализаторлар деп атайды. Кейбір катализаторлар реакцияны өте тез жылдамдатады — оларды оң катализ, немесе жай катализ деп атайды, ал кейбіреулері реакцияны баяулатады — оларды теріс катализ деп атайды. Оң катализдің мысалына платина катализатордың көмегімен күкірт қышқылының алынуы, аммиактың азо қышқылына тотығуы және т. с. с. Теріс катализдің мысалына этил спирті қатысқанда ауадағы оттегімен натрий сульфиті ерітіндісінің әрекеттесуінің бәсеңдеуі немесе аз мөлшердегі күкірт қышқылы (0,0001 м. б) қатысқанда сутегі пероксидінің беліну жылдамдығының баяулауы және т. б. жатады. Теріс катализді көбінесе ингибирлеу, ал реакция жылдамдығын бәсеңдететін теріс катализаторларды ингибиторлар (кейінгінің әсер ету механизмі катализаторларға қарағанда езгеше болады) деп атайды. Катализаторлар қатысқанда жүретін химиялық реакцияларды катализдік реакциялар деп атайды. Көптеген химиялық реакцияларға катализдік әсер етуге болады. Қатализаторлардың саны өте көп, ал олардын, катализдік активтілігі әртүрлі болады. Ол катализатор қатысқанда реакция жылдамдығының өзгеруімен анықталады. Катализатордың өзі реакцияларда жұмсалмайды және соңғы өнімнің кұрамына кірмейді. Катализдің екі түрі бар — гомогендік (бір текті) және гетерогендік (әртекті) қатализ. Гомогендік катализде әрекеттесетін заттармен катализатор бір фазалы газ немесе сұйық күйдегі жүйені түзеді, катализатор мен әрекеттесуші заттар арасында бөліну беті болмайды. Мәселен тұздар ерітіндісі (сұйық күйінде) қатысқанда сутегі пероксидінің катализдік ыдырауы. Гомогенді катализ үшін химиялық реакцияның жылдамдығын катализатор концентрациясына пропорционал екендігі анықталған. Гетерогенді катализде әрекеттесуші заттар мен катализатор әртүрлі фазалардан тұратын жүйе түзеді. Мұндай кезде катализатор мен әрекеттесуші заттар арасында бөліну беті болады. Әдетте катализатор — қатты зат, ал әрекеттесуші заттар — газдар немесе сұйықтықтар болады. Мәселен, платина қатысқанда (қатты күйдегі фаза) аммиактың тотығуы (газ күйіндегі фаза) немесе сутегі пероксидінің (сұйық күйіндегі фаза) көміртегі немесе марганец (IV) тотығы (қатты күйдегі фаза) қатысқанда ыдырауы. Химиялық реакциялардың барлығы гетерогендік катализде катализатордың бетінде жүреді. Сондықтан катализатордың активтігі оның бетінің қасиетіне (шамасына, химиялық құрамына, құрылысына және қалпына) тәуелді болады.


