ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 84
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Глава 4. ТИТАН И ЦИРКОНИЙ
-
ОБЩИЕ СВЕДЕНИЯ
Элемент титан открыт в 1791 г. английским любителем-минералогом Грегором. в титанистом железняке - менакените и был им назван менакеном. В 1795 г немецкий химик Клапрот открыл в минерале рутиле новый элемент, названный титаном. Несколько лет спустя была доказана идентичность менакена и титана. До 1849 г. за металлический титан принимали металлоподобный карбонитрид титана, найденный в шлаках доменных печей. Металлический титан был получей лишь спустя 120 лет после открытия, в 1910 г., американским химиком Хантером восстановлением тетрахлорида титана натрием.
Элемент цирконий открыт почти одновременно с титаном - в 1789 г. Клапротом, который получил диоксид циркония из минерала циркона. Чистый ковкий цирконий был получен лишь в 1925 г. (спустя 136 лет после открытия элемента) термической диссоциацией иодида циркония по методу Ван-Аркеля и де Бура.
Химический аналог циркония - гафний, всегда содержащийся в его минералах, был открыт в 1923 г. венгром Хевеши и голландцем Костером на основании теоретических предсказаний Бора.
Применение титана и циркония в виде их химических соединений и присадок в сплавах началось в первые десятилетия XX в. Промышленное производство ковких титана и циркония возникло в начале 50-х годов в связи с потребностями в новых конструкционных материалах для реактивной авиации, ракетной техники и атомной энергетики.
Свойства титана и циркония
Титан и цирконий - элементы IV побочной группы периодической системы. По внешнему виду они напоминают сталь. Чистые металлы ковки и хорошо поддаются механической обработке давлением.
Некоторые физико-механические свойства титана, циркония (а также аналога циркония - гафния) приведены ниже:
Глава 4. ТИТАН И ЦИРКОНИЙ
-
ОБЩИЕ СВЕДЕНИЯ
Элемент титан открыт в 1791 г. английским любителем-минералогом Грегором. в титанистом железняке - менакените и был им назван менакеном. В 1795 г немецкий химик Клапрот открыл в минерале рутиле новый элемент, названный титаном. Несколько лет спустя была доказана идентичность менакена и титана. До 1849 г. за металлический титан принимали металлоподобный карбонитрид титана, найденный в шлаках доменных печей. Металлический титан был получей лишь спустя 120 лет после открытия, в 1910 г., американским химиком Хантером восстановлением тетрахлорида титана натрием.
Элемент цирконий открыт почти одновременно с титаном - в 1789 г. Клапротом, который получил диоксид циркония из минерала циркона. Чистый ковкий цирконий был получен лишь в 1925 г. (спустя 136 лет после открытия элемента) термической диссоциацией иодида циркония по методу Ван-Аркеля и де Бура.
Химический аналог циркония - гафний, всегда содержащийся в его минералах, был открыт в 1923 г. венгром Хевеши и голландцем Костером на основании теоретических предсказаний Бора.
Применение титана и циркония в виде их химических соединений и присадок в сплавах началось в первые десятилетия XX в. Промышленное производство ковких титана и циркония возникло в начале 50-х годов в связи с потребностями в новых конструкционных материалах для реактивной авиации, ракетной техники и атомной энергетики.
Свойства титана и циркония
Титан и цирконий - элементы IV побочной группы периодической системы. По внешнему виду они напоминают сталь. Чистые металлы ковки и хорошо поддаются механической обработке давлением.
Некоторые физико-механические свойства титана, циркония (а также аналога циркония - гафния) приведены ниже:
Глава 4. ТИТАН И ЦИРКОНИЙ
-
ОБЩИЕ СВЕДЕНИЯ
Элемент титан открыт в 1791 г. английским любителем-минералогом Грегором. в титанистом железняке - менакените и был им назван менакеном. В 1795 г немецкий химик Клапрот открыл в минерале рутиле новый элемент, названный титаном. Несколько лет спустя была доказана идентичность менакена и титана. До 1849 г. за металлический титан принимали металлоподобный карбонитрид титана, найденный в шлаках доменных печей. Металлический титан был получей лишь спустя 120 лет после открытия, в 1910 г., американским химиком Хантером восстановлением тетрахлорида титана натрием.
Элемент цирконий открыт почти одновременно с титаном - в 1789 г. Клапротом, который получил диоксид циркония из минерала циркона. Чистый ковкий цирконий был получен лишь в 1925 г. (спустя 136 лет после открытия элемента) термической диссоциацией иодида циркония по методу Ван-Аркеля и де Бура.
Химический аналог циркония - гафний, всегда содержащийся в его минералах, был открыт в 1923 г. венгром Хевеши и голландцем Костером на основании теоретических предсказаний Бора.
Применение титана и циркония в виде их химических соединений и присадок в сплавах началось в первые десятилетия XX в. Промышленное производство ковких титана и циркония возникло в начале 50-х годов в связи с потребностями в новых конструкционных материалах для реактивной авиации, ракетной техники и атомной энергетики.
Свойства титана и циркония
Титан и цирконий - элементы IV побочной группы периодической системы. По внешнему виду они напоминают сталь. Чистые металлы ковки и хорошо поддаются механической обработке давлением.
Некоторые физико-механические свойства титана, циркония (а также аналога циркония - гафния) приведены ниже:
| | Титан | Цирконий | Гафний |
| Атомный номер | 22 | 40 | 72 |
| Атомная масса | 47,90 | 91,22 | 178,6 |
| Кристаллическая структура: | |||
| α-модификация | ГПУ (до ГПУ (до 882 °С), | ГПУ (до ГПУ (до 862 °С), | ГПУ (до ГПУ (до 1310 °С), |
| | α = 0,2951 нм, | α = 0,3223 нм, | α = 0,3188 нм, |
| | ϲ = 0,4692 нм, | ϲ = 0,5123 нм, | ϲ = 0,5042 нм, |
| β-модификация | ОЦК, | ОЦК, | ОЦК, |
| | α = 03306 нм, | α = 0,361 нм, | α = 0,350 нм |
| Плотность, г/см3 (α-модификацня) | 4,51 | 6,52 | 13,3 |
| Температура, °С: | |||
| плавления | 1668±4 | 1852±10 | 2130±15 |
| кипения | 3300 | около 3600 | около 5400 |
| Температурный коэффициент линейного расширения | | | |
| α • 106, °С-1 20-300 °С | 8,2 | 8,9 | 5,9 |
| Удельное электросопротивление ρ • 106, | | | |
| Ом • см: | | | |
| при 20 °С | 42 | 41 | 34 |
| при 800 °С | 180 | 143 | - |
| Работа выхода электронов, э В | 3,95 | 3,9 | 3,53 |
| Температура перехода в состояние сверхпроводимости, К | 0,53 | 0,7 | 0,35 |
| Сечение захвата тепловых нейтронов n • 1024 , см2 | 4 | 0,18 | 115 |
| Механические свойства высоком истых металлов при 20 °С (отожженные прутки): | | | |
| модуль упругости F, ГПа | 98,5-109 | 98,2 | 140 |
| твердость НВ, МПа | 700-750 | 640-670 | 1300 |
| временное сопротивление δВ, МПа | 250-270 | 230-250 | 400 |
Физические и особенно механические свойства титана и циркония сильно зависят от чистоты металлов. Характерное свойство металлов - способность растворять кислород, водород, азот и углерод. Примеси этих элементов делают титан и цирконий хрупкими.
На воздухе металлы устойчивы. При нагревании до 400—600 °С они покрываются оксидной пленкой, затрудняющей дальнейшее окисление. При более высокой температуре одновременно с увеличением скорости окисления наблюдается растворение кислорода, что сильно понижает пластичность металлов.
Активное поглощение водорода титаном и цирконием наблюдается при 300- 400 °С с образованием твердых растворов и гидридов (TiH1.63-2, ZrH1.54-1.63). В отличие от кислорода и азота водород можно удалить из титана и циркония нагреванием в вакууме при 800-1000 °С. Вышч. 800-900 °С металлы быстро поглощают азот и активно взаимодействуют с углеродсодержащими газами (СО, СН4). С азотом и углеродом они образуют твердые и тугоплавкие соединения - нитриды и карбиды.
Ниже приведены температура плавления tПЛ и микротвердость H0 ряда нитридов и карбидов:
| | TiCl | ZrC | HfC | TiN-1 | ZrN-1 | HfN |
| tПЛ,°С | 3140 | 3420 | 3928 | 2950 | 2982 | 3387 |
| H0, МПа | 28500 | 26000 | 27000 | 20000 | 15000 | 16000 |

* Нитриды имеют широкую область гомогенности TiN0,6-1,0; ZrN0,67-1,0.
Титан и цирконий при повышенных температурах реагируют с серой и сероводородом с образованием дисульфидов. С галогенами металлы взаимодействуют при 100-200 °С с образованием низкокипящих или легковозгоняющихся хлоридов, фторидов и иодидов.

* Вследствие близости свойств все, что ниже изложено о химических свойствах циркония, относится и к гафнию.
По коррозионной стойкости титан близок к хромоникелевой быстрорежущей стали. Металл не корродирует в холодной и кипящей воде, практически стоек в азотной кислоте любой концентрации на холоду и при нагревании, в разбавленной (до 10%) серной кислоте на холоду; достаточно стоек в разбавленной соляной кислоте (5-10 %-ной) на холоду, растворяется в плавиковой кислоте. Коррозию в НСl можно сильно снизить добавлением окислителей (HN0
3, KMnO4, солей меди). В растворах щелочей (до концентрации 20 %) на холоду и при нагревании титан стоек. Важное значение имеет коррозионная стойкость титана в морской воде.
По антикоррозионной стойкости цирконий и гафний превосходят титан и приближаются к танталу и ниобию. При температурах до 100°С они не корродируют в соляной и азотной кислотах любой концентрации и серной кислоте концентрации до 50 %. Металлы устойчивы на холоду в царской водке, растворяются при нагревании в плавиковой и концентрированно серной кислотах. Оба металла не корродируют в растворах щелочей при температуре кипения.
Свойства химических соединений
В важнейших и наиболее устойчивых соединениях титан и цирконий находятся в высшей степени окисления 4. Известны соединения, соответствующие степеням окисления 2 и 3. До низших степеней окисления сравнительно легко восстанавливается титан, труднее - цирконий. Так, в отличие от титана, в водных растворах соединения циркония со степенью окисления меньше четырех неизвестны. Ионы Ti4+ и Zr4+ в водных растворах неустойчивы. В результате взаимодействия с водой они образуют гидроксо-ионы Ti(OH)
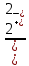 и Zr(OH)
и Zr(OH)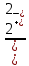 , которым упрощенно приписывают состав TiO2+ (ион титанила), ZrO2+ (ион циркоиила). Соответственно зтому в растворах присутствуют основные соли, например, Ti(OH)2SO4, Zr(OH)2Cl2 или в "титанильной" и "цирконильной" форме TiOSO4 и ZrOCl2.
, которым упрощенно приписывают состав TiO2+ (ион титанила), ZrO2+ (ион циркоиила). Соответственно зтому в растворах присутствуют основные соли, например, Ti(OH)2SO4, Zr(OH)2Cl2 или в "титанильной" и "цирконильной" форме TiOSO4 и ZrOCl2.Высшие оксиды титана и циркония TiO2 и ZrO2 имеют амфотерный характер. При их сплавлении с щелочами или нагревании в смеси с оксидами других металлов (CaO, MgO) образуются титанаты и цирконаты. Наиболее характерны мета - и ортосоли типа
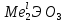 и
и 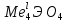 . Кроме того, путем сплавления с щелочами получены более сложные полититанаты и полицирконаты, например Na2Ti2O5, Na2Tl3O7, и др. Титанаты и цирконаты малорасторимы в воде, но растворяются в минеральных кислотах.
. Кроме того, путем сплавления с щелочами получены более сложные полититанаты и полицирконаты, например Na2Ti2O5, Na2Tl3O7, и др. Титанаты и цирконаты малорасторимы в воде, но растворяются в минеральных кислотах.Титан образует ряд оксидов: TiO2 (белый, плавится при 1850 °С), Ті2O3 (фиолетовый, плавится при 2130 °С,) ТіО (золотисто-желтый, плавится при 1750 °С) и промежуточный оксид Ti3
O5.
Известны три аллотропические модификации диоксида тнтаиа, встречающиеся в виде минералов рутила, анатаза и брукита. Теплота образования TiO2 940 кДж/моль.
Диоксид циркония ZrO2 - прочный и тугоплавкий оксид. Температура плавления 2900°С, теплота образования 1082 кДж/моль. Чистый диоксид - белого цвета, имеет три кристаллические модификации: до 1000-1100 устойчива моноклинная форма, в интервале 1100-1900 °С - тетрагональная форма, выше 1900 °С - кубическая форма. Существование низших оксидов циркония достоверно не установлено. Имеются указания об образовании монооксида ZrO при восстановлении ZrO2.
Со всеми галогенами титан и цирконий образуют галогениды, являющиеся производными четырех-, трех - и двухвалентных элементов. Все высшие галогениды - легколетучие соединения. Среди них важнейшие: ТіС14 - бесцветная жидкость, кипящая при 136 °С; ZrCl4 - твердое бесцветное вещество с температурой возгонки 330 °С. Теплоты образования высших хлоридов равны 796 кДж/моль и 985 кДж/моль соответственно.
Фториды титана и циркония образуют с фторидами щелочных металлов комплексные соединения - Me2TiF6 и Ме2ZrF6. Фтороцирконат калия K2ZrF6 легко кристаллизуется из растворов и устойчив на воздухе. Соль используют как исходное соединение для получения циркония.
Области применения титана, циркония и гафния
Области применения титана
Титан и сплавы на его основе. Производство титана и сплавов на его основе возникло в начале 50-х годов в связи с потребностью в новых конструкционных материалах для реактивной авиации и ракетной техники. Сплавы на основе титана обладают высокой удельной прочностью (отношение прочности к плотности). Лучшие современные сплавы на основе титана (легированные добавками А1, Сг, V, Мо, Мn) имеют временное сопротивление (δв = = 1200-1500 МПа, что отвечает удельной прочности 270-330. Легированные стали с тем же δв имеют удельную прочность 155-190.
Из сплавов на основе титана изготовляют части фюзеляжа самолетов и детали реактивных двигателей. В ракетостроении из легированного титана изготовляют корпусы двигателей, емкости для жидкого водорода и другие детали. Сплавы на основе титана используют в морском судостроении, перспективно их применение в автомобильном и железнодорожном транспорте.
Широко используют титан и сплавы на его основе, как
коррозионностойкие, в химическом машиностроении, конденсационных системах ТЭЦ, производстве медицинского инструмента и других областях.
Ведущими странами в области производства титана являются СНГ, США и Япония. Промышленный выпуск титана осуществляется также в Англии, Франции. Масштабы прозводства первичного титана в капиталистических странах сильно зависят от конъюктуры рынка. В 1985 г. оно находилось на уровне 60 тыс. т., в том числе в США 30-34, Японии 24-25, Великобритании 5,0. Примерно 75-80 % титана используется в авиации, судостроении и космической технике, остальное в химическом машиностроении и других областях.
Титан в сталях. В связи с высоким сродством к кислороду и азоту титан используют как эффективный раскислитель и деазотизатор стали. Кроме того, титан связывает серу, образуя прочный сульфид и устраняя этим образование прослоек легкоплавкой эвтектики Fе-FеS, вызывающих красноломкость стали. Для раскисления и деазотизации в сталь вводят от 0,03 до 0,2 % титана в виде ферротитана (18-25 % Тi). В качестве легирующей присадки титан вводят в марганцовистые, хромистые, хромомолибденовые и хромоникелевые коррозионностойкие стали. В последних титан устраняет межкристаллитную коррозию.
Сплавы с цветными металлами. Добавки титана к меди, медным и алюминиевым сплавам улучшают их прочностные свойства и сопротивление коррозии. Для раскисления меди применяют купротитан (сплав меди с 6-12 % титана). В алюминиевые бронзы вводят 0,5-1,55 % титана в виде сплава алютита (40 % А1, 22-50 % Тi, 40 % Сu).
Твердые и жаростойкие сплавы. Карбид титана входит в состав инструментальных твердых сплавов (10-40 % ТiС, 85-50 % WС, остальное - кобальт) -наиболее эффективных для обработки сталей и имеющих большое народнохозяйственное значение.
В последние годы разработаны и выпускаются безвольфрамовые твердые сплавы на основе карбида и нитрида титана с никельмолибденовой цементирующей связкой. Карбид титана входит также в состав жаростойких и жаропрочных сплавов, применяемых для изготовления деталей газовых турбин в реактивных двигателях.
Диоксид титана. Наиболее важно применение диоксида титана для изготовления белого пигмента - титановых белил, обладающих высокой кроющей способностью и неядовитых. Их используют для окраски судов, машин, вводят в состав эмалей, резины, бумажной массы.
Природный диоксид титана (рутил) или технический диоксид вводят в состав обмазки электродов для электросварки. Высокая диэлектрическая постоянная рутильной формы ТiO
