ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 88
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Рисунок 41 Шахтный хлоратор непрерывного действия:
1-водоохлаждаемый конус; 2 - фурма; 3 -хлорный коллектор; 4 - корпус хлоратора; 5 -волдохлаждаемый свод; 6 - бункер; 7 - золотниковый питатель; 8 - редуктор; 9 - электродвигатель; 10 - сборник огарка; 11 - разгрузочный шнек.
В печах подобного типа можно хлорировать шлаки с низким суммарным содержанием СаО и МgО (не выше 4-5 %). При (более высоком содержании образующиеся жидкие хлориды CaCl2 и МgС12 приводят к слипанию брикетов и нарушению схода шихты вдоль шахты печи.
Расход хлора составляет 0,85-0,9 т на 1 т тетрахлорида титана, что выше теоретического расхода (
0,75 т хлора) вследствие затрат хлора на хлорирование соединений примесей. В хлоратор подается анодный газ магниевых электролизеров, содержащий
85-90 % хлора или испаренный хлор из цистерн с жидким хлором.
При температурах 900-1000 °С хлорирование брикетов протекает во внешне диффузионной области, т.е. скорость процесса определяется скоростью подачи хлора. Энергия активации процесса хлорирования
12-16 кДж/моль ТiO2. Брикет приведенного выше размера полно хлорируется за 3-3,5 ч.
При принятых режимах хлорирования процесс протекает за счет теплоты реакций. При расходе хлора
400 кг/(м2 • ч) высота реакционной зоны, в пределах которой концентрация хлора изменяется примерно от начальной вблизи фурм практически до нуля (у верхней границы зоны), равна 0,8-1,0 м.
Удельная производительность шахтных хлораторов непрерывного действия при температурах хлорирования 900-1000 °С равна 1,8-2 т ТiС14 на 1 м3 объема хлоратора.
Повышение единичной мощности шахтного хлоратора путем увеличения его диаметра нецелесообразно, так как возрастает неравномерность схода шихты (центральная часть брикета перемещается быстрей периферийной) и неоднородность температурного поля по его сечению (у стен температура выше вследствие неравномерности распределения хлора).
Отношение по массе СО:СО2 в парогазовой смеси, выходящей из хлоратора, колеблется (в зависимости от режима) от 5:1 до 2:1.

Рисунок 42 Хлоратор для хлорирования в солевом расплаве:
Недостаток хлорирования брикетированной шихты - высокие затраты на приготовление брикетов, что повышает 10-15 % себестоимость хлорида; взрывоопасность отходящих газов, в которых преобладает СО. 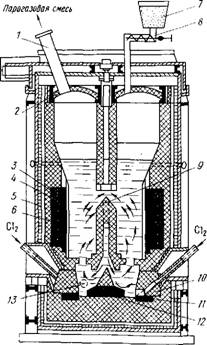
1 - газоход; 2 - свод; 3 -графитовый электрод; 4 -стальные трубы для отвода тепла; 5 - кожух хлоратора; 6 -шамотная футеровка; 7 - бункер с шихтой; 8 - шнековый питатель; 9 - перегородка для создания циркуляции расплава; 10 - фурма; 11,12 - донные графитовые электроды; 13 -нижний слив расплава
Хлорирование в солевом расплаве. Этот способ разработан в СНГ. Хлорирование шлака проводится в ванне из расплава хлоридов щелочных и щелочно-земельных металлов, куда подают компоненты шихты (измельченные шлак и кокс) и хлор. В качестве расплава используют отработанный электролит магниевых электролизеров, имеющий следующий примерный состав, %: КС1 72-76; NаС1 14-16, МgС12 4-6. Шихта подается шнеком на поверхность расплава, хлор поступает в нижнюю часть хлоратора через фурмы и газораспределительную решетку (рис. 42). При удельном расходе хлора 40-60 м3/ч на 1 м3 расплава обеспечивается хорошее перемешивание его барботирующим хлором. В расплаве поддерживают концентрацию ТiO2 2-3 %, углерода 7-9 %. При высоте расплава 3-3,2 м хлор успевает полностью прореагировать в объеме расплава, лишь незначительная часть его уходит с отходящимися газами.
Необходимая температура расплава (800 - 850 oС) поддерживается за счет тепла экзотермических реакций. Избыточное тепло отводится с помощью установленных в стенке хлоратора кессонов из графитовых плит, в которые вмонтированы стальные трубы, куда подается вода.
В процессе хлорирования в расплаве накапливаются нелетучие хлориды (MgCl2, СаС12, а также FeCl2 и FeCl3 в форме комплексов KFeCl3 и KFeCl4 и др.). Периодически часть расплава выпускают и в хлоратор заливают свежий расплав. Отработанный расплав содержит, %: KCl 30 - 40, NaCl 2 - 5, MgCl2 25 - 35, FeCl2 + FeCl3 + MnCl2 10 - 20, SiO2 3 - 6, CaCl2 2 - 4, С 7 - 9, TiO2 0,5 - 1. В отличие от хлорирования брикетированных шихт в хлораторах с расплавом в составе парогазовой смеси преобладает СO2 [объемное соотношение СO2: СО = (10÷20):1], что объясняется неблагоприятными условиями для взаимодействия СO2 с частицами углерода.
Механизм (стадии) хлорирования диоксида титана в сложной системе, содержащей газовую, жидкую и две твердые фазы (TiO2 и кокс), недостаточно изучен.
Очевидно, что с поверхностью частиц кокса и TiO2, находящихся в расплаве, могут вступать во взаимодействие только растворенные в расплаве хлор, СO2 и СО, так как при хорошем смачивании кокса расплавом его поверхность экранирована жидкой средой от непосредственного контакта с пузырьками газа.
Растворимость хлора, СО и СO2 в расплавах KCl - NaCl - MgCl2 при 800 - 900 oС равна примерно 0,04, 0,02 и 1,5 г/л соответственно. Растворимость TiO2 не превышает 0,05 г/л.
Согласно одной из предложенных схем растворенный хлор хемосорбируется на поверхности частиц углеродистого материала с образованием активного (атомарного) хлора, переносимого через расплав к поверхности оксида, где при участии растворенного СО протекает реакция:
ТiO2 + 4С1акт + 2СО = ТiС14 + 2СО2.
Далее СО2 частично взаимодействует с углеродом с образованием СО. Эта схема объясняет наблюдаемое повышение скорости хлорирования с увеличением удельной поверхности кокса и преобладание СО2 над СО в газовой фазе.
Присутствие хлоридов железа в расплаве повышает скорость хлорирования. Это объясняется хлорирующим действием FеС13, легко отщепляющего активный хлор. Как указано выше, хлориды железа находятся в расплаве в форме комплексов 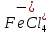 и
и 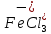 . Поэтому хлорирование ТiO2 с участием хлоридов железа можно представить суммарными реакциями:
. Поэтому хлорирование ТiO2 с участием хлоридов железа можно представить суммарными реакциями:
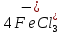 + 2С12 =
+ 2С12 = 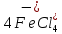 ; (4.13)
; (4.13)
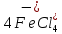 + ТiO2 + 2СО = ТiС14 +
+ ТiO2 + 2СО = ТiС14 + 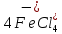 + 2СО2. (4.14)
+ 2СО2. (4.14)
Таким образом, хлориды железа выполняют роль переносчиков хлора.
Поскольку хлориды железа хорошо растворимы в расплаве, концентрация хлорирующего агента будет зависеть от содержания в нем железа. Так, достаточно содержания 1 % FeCl3 в расплаве для существенного увеличения скорости процесса. При нормальной работе хлоратора (без проскока хлора) в расплаве устанавливается отношение FeCl2 : FeCl3 = 20 + 200 (по массе), причем концентрация FeCl2 находится в пределах 15 - 20 %, a FeCl3 0,1 - 1,0 %.
Вследствие образования комплексов большая часть железа (а также алюминия, образующего комплекс КA1Cl4) остается в солевом расплаве.
Основные преимущества хлорирования в солевом расплаве по сравнению с хлорированием брикетов следующие: исключены сложные операции подготовки брикетов, что снижает себестоимость хлорида. Возможно хлорирование шлаков с повышенным содержанием СаО и МgО. Быстрый тепло- и массообмен в расплаве обеспечивает высокую скорость хлорирования и возможность отвода избыточного тепла. Преобладание СО2 над СО в составе газов резко снижает их взрывоопасность.
К недостаткам хлорирования в расплаве следует отнести периодический вывод отработанного расплава (до 200 кг на 1 т ТiС14), с которым теряется часть титана. Хлориды -вредные производственные сбросы. Важная задача - их использование или регенерация с возвратом в процесс.
Пылеулавливание и конденсация хлоридов
Парогазовая смесь, выходящая из хлораторов, имеет сложный состав. Она содержит газы (СО, СО2, СОС12, N2, НС1, С12), низкокипящие хлориды - в нормальных условиях жидкости (ТiС14, SiС14,VОС13 и др.); низкокипящие хлориды - в нормальных условиях твердые (FеС13, А1С13); высококипящие хлориды СаС12, МgС12, FеС12, а также КС1, NаС1 (при хлорировании в расплаве). Высококипящие хлориды механически увлекаются парогазовым потоком в виде тумана.
На рис. 43 приведена распространенная схема пылеулавливания и конденсации. Она состоит из пылевых камер (кулеров) для улавливания твердых хлоридов; рукавного фильтра с рукавами из стеклоткани для дополнительной очистки парогазовой смеси от твердых частиц; двух оросительных конденсаторов (конденсаторов смешения) для жидких хлоридов (ТiС14, SiС14), орошаемых охлажденным тетрахлоридом титана; во втором конденсаторе тетрахлорид, поступающий на орошение, охлаждается до -10 С. Далее газы проходят санитарный скруббер, орошаемый известковым молоком, для улавливания небольших количеств хлора, фосгена, хлористого водорода и выбрасываются в атмосферу. В кулерах газы охлаждаются с 500-600 до 140-180 °С омывающим трубы воздухом. В нижней разгрузочной части кулеров поддерживается постоянная температура (120-130 °С) органическим теплоносителем, циркулирующим в рубашке разгрузочного корыта. Термостатирование рукавного фильтра (140-160 °С) также осуществляется жидким теплоносителем.
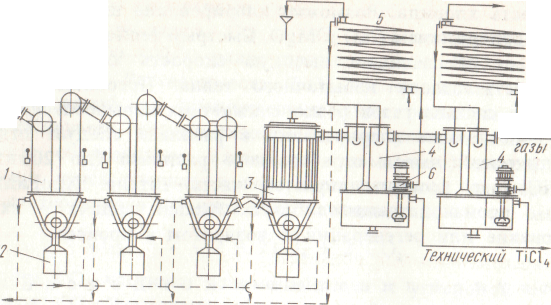
РBс.43. Схема раздельной конденсационной системы (пунктиром показан путь циркуляции теплоносителя):
1 - пылевые камеры (кулера); 2 — сборник твердых хлоридов; 5 - рукавный фильтр; 4 – оросительные конденсаторы; 5 - водяной холодильник; 6 - погружной насос; 7 - холодильник, охлаждаемый рассолом до -10 С (раствор СаС12)
Для снятия с рукавов из стеклоткани уловленной пыли производится их отдувка парами тетрахлорида титана.
В связи с осложненностью эксплуатации фильтров с рукавами из стеклоткани на некоторых предприятиях они заменены солевым расплавом NаС1 + КС1. (см. рис. 25). Расплав циркулирует с помощью аэролифтного устройства. Принцип работы солевого фильтра рассмотрен в гл. 2.
Извлечение титана из шлака в жидкий технический тетрахлорид составляет 92-93 %.
Очистка технического тетрахлорида титана
Содержание примесей в техническом ТiС14 колеблется примерно в следующих пределах, % (по массе): Si 0,01-0,3; А1 0,01-0,1; Fе 0,01-0,02; V 0,01-0,3; ТiOС12 0,04-0,5; СОС12 0,005-0,15; С1 0,003-0,08; S 0,01-0,08.
Кроме перечисленных, в хлориде титана часто содержатся примеси хлоридов ниобия, тантала, хрома и примеси органических соединений, например ацетилхлориды (СС13СОС1, СН2ClОСl), гексахлорбензол С6С16 и др.
Хлорид титана очищают от большинства примесей ректификацией, основанной на различии температур кипения хлоридов. Однако ректификации предшествует очистка от примеси ванадия.
Очистка от ванадия. Ванадия содержится в ТiС14 в составе оксихлорида VОС13. Отделение его от ТiС14 ректификацией затруднительно вследствие близости точек кипения ТiС14 и VОС13 (136 и 127 °С соответственно). Все известные методы очистки от ванадия основаны на восстановлении VОС13 до малорастворимого в тетрахлориде титана VОС12. На заводах в качестве восстановителей применяют медные или алюминиевые порошки.
Восстановление медным порошком протекает через стадию
образования СuТlС14:
Сu + ТiС14 = СuТiС14; (4.15)
СuТiС14 + VОС13 = VОС12 + CuС1 + ТiС14. (4.16)
Получаемые медно-ванадиевые осадки содержат, % Тi 6-8; V 4-6; С1
45, остальное - кислород и примеси других элементов. Разработаны схемы извлечения из осадков ванадия и меди.
Вследствие высокой стоимости медного порошка стали применять для восстановления VОС13 порошок алюминия. Последний реагирует с ТiС14 с образованием ТiС13, который затем восстанавливает VОС13:
3 ТiС14 + А1 = 3 ТiС13 + А1С13; (4.17)
ТiС13 + VОС13 = VОС12 +Т1С14. (4.18)
Кроме того, протекает реакция:
ТiOС12 + А1С13 = А1ОСl↓ + Т1С14. (4.19)
Осадок, содержащий VОС12, ТiC13, А1С13, направляется на извлечение ванадия. На некоторых зарубежных заводах для очистки от ванадия применяют восстановление сероводородом или органическими веществами (углеводороды, жирные кислоты и др.).
Очистка ректификацией. Очистку хлорида титана ректификацией проводят в колоннах из нержавеющей стали с дырчатыми тарелками (или тарелками с щелевидными прорезями) в две стадии (рис. 44). На первой стадии отделяют тетрахлорид титана от примеси кремния (температура кипения S1С14 58 °С) и других летучих примесей (СС14, СS2, SОС12 и др.), поддерживая в верхней части колонны температуру паров 132-135 °С и избыточное давление 0,66-4 кПа. Температура в кубе колонны 140-150 °С.
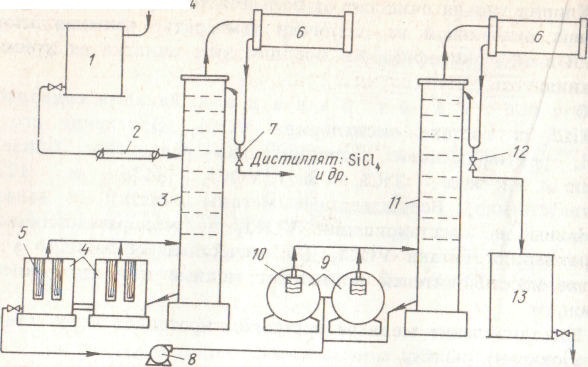

Рисунок 44 Схема установки для очистки тетрахлорида титана ректификацией:
1- напорный бак с ТЛС14; 2 - подогреватель; 3 - ректификационная колонна для отделения низкокипящих хлоридов; 4 - кубы-испарители с электронагревателями 5 (в патроне); 6 - дефлегматоры; 7 - регулирующий клапан; 8 - насос; 9 - кубы-испарители с открытыми нагревателями; 10,11 - ректификационная колонна для дистилляции Т1С14; 12 - распределительный клапан; 13 - сборник очищенного Т1С14
Неконденсируемые газы (СО2, С12, N2, СОС12) выводят из дефлегматора через гидрозатвор в систему очистки газов.
Кубовый остаток, содержащий ТiС14 и примеси высококипящих хлоридов и оксихлоридов (в частности, ТiOС12), поступает во вторую колонну, в верхней части которой поддерживают температуру 134-136 °С (точка кипения ТiС14), в нижней - 137-138 °С. Отбираемый дистиллят - чистый четыреххлористый титан. Примеси высококипящих хлоридов (ТiOС12, FеС13, А1С13, NbС15 и др.) остаются в кубовом остатке.
Очищенный тетрахлорид титана содержит примеси в количествах, близких к пределу чувствительности спектрального анализа (10-3-10-5 %). Извлечение титана из технического в очищенный тетрахлорид титана равно
96 %.
Производство диоксида титана
Сернокислотный способ
Основное количество выпускаемого диоксида титана из ильменитового концентрата (или титановых шлаков) получают сернокислотным способом, который включает следующие стадии:
-
разложение концентрата серной кислотой;
-
очистку растворов от железа;
-
гидролитическое выделение метатитановой кислоты из сернокислотного раствора;
-
прокаливание осадка с получением диоксида титана.
Этот способ обеспечивает высокое извлечение титана в готовый продукт, причем в технологии практически используют один реагент - серную кислоту.
Разложение концентрата. Разложение ведут концентрированной Н2SО4 (92-94 %) или олеумом в стальных реакторах. Вследствие экзотермичности процесса после нагревания кислоты с измельченным концентратом до 125-135°С реакция проходит интенсивно с саморазогревом до 180-200°С и заканчивается за 5-10 мин. Получающаяся полусухая масса ("плав") содержит оксосульфат титана (IV) (ТiOSО4 • Н2О), FеSО4) избыточную Н2SО4. Плав выщелачивают водой.
Очистка растворов от железа.
Растворы содержат 110-120 г/л ТiO2 (в составе ТiOSО4),
сульфаты железа SеSО4 и Fе2(SО4)3 и 200-240 г/л активной Н2S04.
Для очистки от основной массы железа восстанавливают Fе3+ до Fе2+ железной стружкой, а затем проводят кристаллизацию железного купороса FеSО4-7 Н2О, охлаждая растворы до -5 °С. В результате кристаллизации содержание железа растворе понижается до
20г/л.
Железный купорос - полезный побочный продукт, используемый в сельском хозяйстве как инсектофунгицид.
Осаждение метатитановой кислоты. Из растворов, содержащих оксосульфат титана, гидролитическим разложением выделяют метатитановую кислоту (гидратированный диоксид титана):
ТiОSO4 + 2 Н2О =ТiO2 • Н2О + Н2S04. (4.20)
Следует учитывать, что в действительности продукт гидролиза переменного состава, содержит, кроме ТiО2 и Н2О, значительные количества SО3.
Используют два способа проведения гидролиза: способ введения зародышей и способ разбавления.
При способе введения зародышей в раствор добавляют отдельно приготовленные зародыши в форме коллоидного раствора гидроксида титана в количестве
1 % от содержания ТiO
Рисунок 41 Шахтный хлоратор непрерывного действия:
1-водоохлаждаемый конус; 2 - фурма; 3 -хлорный коллектор; 4 - корпус хлоратора; 5 -волдохлаждаемый свод; 6 - бункер; 7 - золотниковый питатель; 8 - редуктор; 9 - электродвигатель; 10 - сборник огарка; 11 - разгрузочный шнек.
В печах подобного типа можно хлорировать шлаки с низким суммарным содержанием СаО и МgО (не выше 4-5 %). При (более высоком содержании образующиеся жидкие хлориды CaCl2 и МgС12 приводят к слипанию брикетов и нарушению схода шихты вдоль шахты печи.
Расход хлора составляет 0,85-0,9 т на 1 т тетрахлорида титана, что выше теоретического расхода (
0,75 т хлора) вследствие затрат хлора на хлорирование соединений примесей. В хлоратор подается анодный газ магниевых электролизеров, содержащий
85-90 % хлора или испаренный хлор из цистерн с жидким хлором.
При температурах 900-1000 °С хлорирование брикетов протекает во внешне диффузионной области, т.е. скорость процесса определяется скоростью подачи хлора. Энергия активации процесса хлорирования
12-16 кДж/моль ТiO2. Брикет приведенного выше размера полно хлорируется за 3-3,5 ч.
При принятых режимах хлорирования процесс протекает за счет теплоты реакций. При расходе хлора
400 кг/(м2 • ч) высота реакционной зоны, в пределах которой концентрация хлора изменяется примерно от начальной вблизи фурм практически до нуля (у верхней границы зоны), равна 0,8-1,0 м.
Удельная производительность шахтных хлораторов непрерывного действия при температурах хлорирования 900-1000 °С равна 1,8-2 т ТiС14 на 1 м3 объема хлоратора.
Повышение единичной мощности шахтного хлоратора путем увеличения его диаметра нецелесообразно, так как возрастает неравномерность схода шихты (центральная часть брикета перемещается быстрей периферийной) и неоднородность температурного поля по его сечению (у стен температура выше вследствие неравномерности распределения хлора).
Отношение по массе СО:СО2 в парогазовой смеси, выходящей из хлоратора, колеблется (в зависимости от режима) от 5:1 до 2:1.

Рисунок 42 Хлоратор для хлорирования в солевом расплаве:
Недостаток хлорирования брикетированной шихты - высокие затраты на приготовление брикетов, что повышает 10-15 % себестоимость хлорида; взрывоопасность отходящих газов, в которых преобладает СО. 
1 - газоход; 2 - свод; 3 -графитовый электрод; 4 -стальные трубы для отвода тепла; 5 - кожух хлоратора; 6 -шамотная футеровка; 7 - бункер с шихтой; 8 - шнековый питатель; 9 - перегородка для создания циркуляции расплава; 10 - фурма; 11,12 - донные графитовые электроды; 13 -нижний слив расплава
Хлорирование в солевом расплаве. Этот способ разработан в СНГ. Хлорирование шлака проводится в ванне из расплава хлоридов щелочных и щелочно-земельных металлов, куда подают компоненты шихты (измельченные шлак и кокс) и хлор. В качестве расплава используют отработанный электролит магниевых электролизеров, имеющий следующий примерный состав, %: КС1 72-76; NаС1 14-16, МgС12 4-6. Шихта подается шнеком на поверхность расплава, хлор поступает в нижнюю часть хлоратора через фурмы и газораспределительную решетку (рис. 42). При удельном расходе хлора 40-60 м3/ч на 1 м3 расплава обеспечивается хорошее перемешивание его барботирующим хлором. В расплаве поддерживают концентрацию ТiO2 2-3 %, углерода 7-9 %. При высоте расплава 3-3,2 м хлор успевает полностью прореагировать в объеме расплава, лишь незначительная часть его уходит с отходящимися газами.
Необходимая температура расплава (800 - 850 oС) поддерживается за счет тепла экзотермических реакций. Избыточное тепло отводится с помощью установленных в стенке хлоратора кессонов из графитовых плит, в которые вмонтированы стальные трубы, куда подается вода.
В процессе хлорирования в расплаве накапливаются нелетучие хлориды (MgCl2, СаС12, а также FeCl2 и FeCl3 в форме комплексов KFeCl3 и KFeCl4 и др.). Периодически часть расплава выпускают и в хлоратор заливают свежий расплав. Отработанный расплав содержит, %: KCl 30 - 40, NaCl 2 - 5, MgCl2 25 - 35, FeCl2 + FeCl3 + MnCl2 10 - 20, SiO2 3 - 6, CaCl2 2 - 4, С 7 - 9, TiO2 0,5 - 1. В отличие от хлорирования брикетированных шихт в хлораторах с расплавом в составе парогазовой смеси преобладает СO2 [объемное соотношение СO2: СО = (10÷20):1], что объясняется неблагоприятными условиями для взаимодействия СO2 с частицами углерода.
Механизм (стадии) хлорирования диоксида титана в сложной системе, содержащей газовую, жидкую и две твердые фазы (TiO2 и кокс), недостаточно изучен.
Очевидно, что с поверхностью частиц кокса и TiO2, находящихся в расплаве, могут вступать во взаимодействие только растворенные в расплаве хлор, СO2 и СО, так как при хорошем смачивании кокса расплавом его поверхность экранирована жидкой средой от непосредственного контакта с пузырьками газа.
Растворимость хлора, СО и СO2 в расплавах KCl - NaCl - MgCl2 при 800 - 900 oС равна примерно 0,04, 0,02 и 1,5 г/л соответственно. Растворимость TiO2 не превышает 0,05 г/л.
Согласно одной из предложенных схем растворенный хлор хемосорбируется на поверхности частиц углеродистого материала с образованием активного (атомарного) хлора, переносимого через расплав к поверхности оксида, где при участии растворенного СО протекает реакция:
ТiO2 + 4С1акт + 2СО = ТiС14 + 2СО2.
Далее СО2 частично взаимодействует с углеродом с образованием СО. Эта схема объясняет наблюдаемое повышение скорости хлорирования с увеличением удельной поверхности кокса и преобладание СО2 над СО в газовой фазе.
Присутствие хлоридов железа в расплаве повышает скорость хлорирования. Это объясняется хлорирующим действием FеС13, легко отщепляющего активный хлор. Как указано выше, хлориды железа находятся в расплаве в форме комплексов 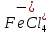 и
и 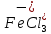 . Поэтому хлорирование ТiO2 с участием хлоридов железа можно представить суммарными реакциями:
. Поэтому хлорирование ТiO2 с участием хлоридов железа можно представить суммарными реакциями:
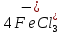 + 2С12 =
+ 2С12 = 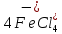 ; (4.13)
; (4.13)
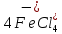 + ТiO2 + 2СО = ТiС14 +
+ ТiO2 + 2СО = ТiС14 + 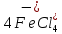 + 2СО2. (4.14)
+ 2СО2. (4.14)
Таким образом, хлориды железа выполняют роль переносчиков хлора.
Поскольку хлориды железа хорошо растворимы в расплаве, концентрация хлорирующего агента будет зависеть от содержания в нем железа. Так, достаточно содержания 1 % FeCl3 в расплаве для существенного увеличения скорости процесса. При нормальной работе хлоратора (без проскока хлора) в расплаве устанавливается отношение FeCl2 : FeCl3 = 20 + 200 (по массе), причем концентрация FeCl2 находится в пределах 15 - 20 %, a FeCl3 0,1 - 1,0 %.
Вследствие образования комплексов большая часть железа (а также алюминия, образующего комплекс КA1Cl4) остается в солевом расплаве.
Основные преимущества хлорирования в солевом расплаве по сравнению с хлорированием брикетов следующие: исключены сложные операции подготовки брикетов, что снижает себестоимость хлорида. Возможно хлорирование шлаков с повышенным содержанием СаО и МgО. Быстрый тепло- и массообмен в расплаве обеспечивает высокую скорость хлорирования и возможность отвода избыточного тепла. Преобладание СО2 над СО в составе газов резко снижает их взрывоопасность.
К недостаткам хлорирования в расплаве следует отнести периодический вывод отработанного расплава (до 200 кг на 1 т ТiС14), с которым теряется часть титана. Хлориды -вредные производственные сбросы. Важная задача - их использование или регенерация с возвратом в процесс.
Пылеулавливание и конденсация хлоридов
Парогазовая смесь, выходящая из хлораторов, имеет сложный состав. Она содержит газы (СО, СО2, СОС12, N2, НС1, С12), низкокипящие хлориды - в нормальных условиях жидкости (ТiС14, SiС14,VОС13 и др.); низкокипящие хлориды - в нормальных условиях твердые (FеС13, А1С13); высококипящие хлориды СаС12, МgС12, FеС12, а также КС1, NаС1 (при хлорировании в расплаве). Высококипящие хлориды механически увлекаются парогазовым потоком в виде тумана.
На рис. 43 приведена распространенная схема пылеулавливания и конденсации. Она состоит из пылевых камер (кулеров) для улавливания твердых хлоридов; рукавного фильтра с рукавами из стеклоткани для дополнительной очистки парогазовой смеси от твердых частиц; двух оросительных конденсаторов (конденсаторов смешения) для жидких хлоридов (ТiС14, SiС14), орошаемых охлажденным тетрахлоридом титана; во втором конденсаторе тетрахлорид, поступающий на орошение, охлаждается до -10 С. Далее газы проходят санитарный скруббер, орошаемый известковым молоком, для улавливания небольших количеств хлора, фосгена, хлористого водорода и выбрасываются в атмосферу. В кулерах газы охлаждаются с 500-600 до 140-180 °С омывающим трубы воздухом. В нижней разгрузочной части кулеров поддерживается постоянная температура (120-130 °С) органическим теплоносителем, циркулирующим в рубашке разгрузочного корыта. Термостатирование рукавного фильтра (140-160 °С) также осуществляется жидким теплоносителем.

РBс.43. Схема раздельной конденсационной системы (пунктиром показан путь циркуляции теплоносителя):
1 - пылевые камеры (кулера); 2 — сборник твердых хлоридов; 5 - рукавный фильтр; 4 – оросительные конденсаторы; 5 - водяной холодильник; 6 - погружной насос; 7 - холодильник, охлаждаемый рассолом до -10 С (раствор СаС12)
Для снятия с рукавов из стеклоткани уловленной пыли производится их отдувка парами тетрахлорида титана.
В связи с осложненностью эксплуатации фильтров с рукавами из стеклоткани на некоторых предприятиях они заменены солевым расплавом NаС1 + КС1. (см. рис. 25). Расплав циркулирует с помощью аэролифтного устройства. Принцип работы солевого фильтра рассмотрен в гл. 2.
Извлечение титана из шлака в жидкий технический тетрахлорид составляет 92-93 %.
Очистка технического тетрахлорида титана
Содержание примесей в техническом ТiС14 колеблется примерно в следующих пределах, % (по массе): Si 0,01-0,3; А1 0,01-0,1; Fе 0,01-0,02; V 0,01-0,3; ТiOС12 0,04-0,5; СОС12 0,005-0,15; С1 0,003-0,08; S 0,01-0,08.
Кроме перечисленных, в хлориде титана часто содержатся примеси хлоридов ниобия, тантала, хрома и примеси органических соединений, например ацетилхлориды (СС13СОС1, СН2ClОСl), гексахлорбензол С6С16 и др.
Хлорид титана очищают от большинства примесей ректификацией, основанной на различии температур кипения хлоридов. Однако ректификации предшествует очистка от примеси ванадия.
Очистка от ванадия. Ванадия содержится в ТiС14 в составе оксихлорида VОС13. Отделение его от ТiС14 ректификацией затруднительно вследствие близости точек кипения ТiС14 и VОС13 (136 и 127 °С соответственно). Все известные методы очистки от ванадия основаны на восстановлении VОС13 до малорастворимого в тетрахлориде титана VОС12. На заводах в качестве восстановителей применяют медные или алюминиевые порошки.
Восстановление медным порошком протекает через стадию
образования СuТlС14:
Сu + ТiС14 = СuТiС14; (4.15)
СuТiС14 + VОС13 = VОС12 + CuС1 + ТiС14. (4.16)
Получаемые медно-ванадиевые осадки содержат, % Тi 6-8; V 4-6; С1
45, остальное - кислород и примеси других элементов. Разработаны схемы извлечения из осадков ванадия и меди.
Вследствие высокой стоимости медного порошка стали применять для восстановления VОС13 порошок алюминия. Последний реагирует с ТiС14 с образованием ТiС13, который затем восстанавливает VОС13:
3 ТiС14 + А1 = 3 ТiС13 + А1С13; (4.17)
ТiС13 + VОС13 = VОС12 +Т1С14. (4.18)
Кроме того, протекает реакция:
ТiOС12 + А1С13 = А1ОСl↓ + Т1С14. (4.19)
Осадок, содержащий VОС12, ТiC13, А1С13, направляется на извлечение ванадия. На некоторых зарубежных заводах для очистки от ванадия применяют восстановление сероводородом или органическими веществами (углеводороды, жирные кислоты и др.).
Очистка ректификацией. Очистку хлорида титана ректификацией проводят в колоннах из нержавеющей стали с дырчатыми тарелками (или тарелками с щелевидными прорезями) в две стадии (рис. 44). На первой стадии отделяют тетрахлорид титана от примеси кремния (температура кипения S1С14 58 °С) и других летучих примесей (СС14, СS2, SОС12 и др.), поддерживая в верхней части колонны температуру паров 132-135 °С и избыточное давление 0,66-4 кПа. Температура в кубе колонны 140-150 °С.


Рисунок 44 Схема установки для очистки тетрахлорида титана ректификацией:
1- напорный бак с ТЛС14; 2 - подогреватель; 3 - ректификационная колонна для отделения низкокипящих хлоридов; 4 - кубы-испарители с электронагревателями 5 (в патроне); 6 - дефлегматоры; 7 - регулирующий клапан; 8 - насос; 9 - кубы-испарители с открытыми нагревателями; 10,11 - ректификационная колонна для дистилляции Т1С14; 12 - распределительный клапан; 13 - сборник очищенного Т1С14
Неконденсируемые газы (СО2, С12, N2, СОС12) выводят из дефлегматора через гидрозатвор в систему очистки газов.
Кубовый остаток, содержащий ТiС14 и примеси высококипящих хлоридов и оксихлоридов (в частности, ТiOС12), поступает во вторую колонну, в верхней части которой поддерживают температуру 134-136 °С (точка кипения ТiС14), в нижней - 137-138 °С. Отбираемый дистиллят - чистый четыреххлористый титан. Примеси высококипящих хлоридов (ТiOС12, FеС13, А1С13, NbС15 и др.) остаются в кубовом остатке.
Очищенный тетрахлорид титана содержит примеси в количествах, близких к пределу чувствительности спектрального анализа (10-3-10-5 %). Извлечение титана из технического в очищенный тетрахлорид титана равно
96 %.
Рисунок 41 Шахтный хлоратор непрерывного действия:
1-водоохлаждаемый конус; 2 - фурма; 3 -хлорный коллектор; 4 - корпус хлоратора; 5 -волдохлаждаемый свод; 6 - бункер; 7 - золотниковый питатель; 8 - редуктор; 9 - электродвигатель; 10 - сборник огарка; 11 - разгрузочный шнек.
В печах подобного типа можно хлорировать шлаки с низким суммарным содержанием СаО и МgО (не выше 4-5 %). При (более высоком содержании образующиеся жидкие хлориды CaCl2 и МgС12 приводят к слипанию брикетов и нарушению схода шихты вдоль шахты печи.
Расход хлора составляет 0,85-0,9 т на 1 т тетрахлорида титана, что выше теоретического расхода (
0,75 т хлора) вследствие затрат хлора на хлорирование соединений примесей. В хлоратор подается анодный газ магниевых электролизеров, содержащий
85-90 % хлора или испаренный хлор из цистерн с жидким хлором.
При температурах 900-1000 °С хлорирование брикетов протекает во внешне диффузионной области, т.е. скорость процесса определяется скоростью подачи хлора. Энергия активации процесса хлорирования
12-16 кДж/моль ТiO2. Брикет приведенного выше размера полно хлорируется за 3-3,5 ч.
При принятых режимах хлорирования процесс протекает за счет теплоты реакций. При расходе хлора
400 кг/(м2 • ч) высота реакционной зоны, в пределах которой концентрация хлора изменяется примерно от начальной вблизи фурм практически до нуля (у верхней границы зоны), равна 0,8-1,0 м.
Рисунок 41 Шахтный хлоратор непрерывного действия:
1-водоохлаждаемый конус; 2 - фурма; 3 -хлорный коллектор; 4 - корпус хлоратора; 5 -волдохлаждаемый свод; 6 - бункер; 7 - золотниковый питатель; 8 - редуктор; 9 - электродвигатель; 10 - сборник огарка; 11 - разгрузочный шнек.
В печах подобного типа можно хлорировать шлаки с низким суммарным содержанием СаО и МgО (не выше 4-5 %). При (более высоком содержании образующиеся жидкие хлориды CaCl2 и МgС12 приводят к слипанию брикетов и нарушению схода шихты вдоль шахты печи.
Расход хлора составляет 0,85-0,9 т на 1 т тетрахлорида титана, что выше теоретического расхода (
0,75 т хлора) вследствие затрат хлора на хлорирование соединений примесей. В хлоратор подается анодный газ магниевых электролизеров, содержащий
85-90 % хлора или испаренный хлор из цистерн с жидким хлором.Рисунок 41 Шахтный хлоратор непрерывного действия:
1-водоохлаждаемый конус; 2 - фурма; 3 -хлорный коллектор; 4 - корпус хлоратора; 5 -волдохлаждаемый свод; 6 - бункер; 7 - золотниковый питатель; 8 - редуктор; 9 - электродвигатель; 10 - сборник огарка; 11 - разгрузочный шнек.
В печах подобного типа можно хлорировать шлаки с низким суммарным содержанием СаО и МgО (не выше 4-5 %). При (более высоком содержании образующиеся жидкие хлориды CaCl2 и МgС12 приводят к слипанию брикетов и нарушению схода шихты вдоль шахты печи.
Расход хлора составляет 0,85-0,9 т на 1 т тетрахлорида титана, что выше теоретического расхода (
При температурах 900-1000 °С хлорирование брикетов протекает во внешне диффузионной области, т.е. скорость процесса определяется скоростью подачи хлора. Энергия активации процесса хлорирования
Удельная производительность шахтных хлораторов непрерывного действия при температурах хлорирования 900-1000 °С равна 1,8-2 т ТiС14 на 1 м3 объема хлоратора.
Повышение единичной мощности шахтного хлоратора путем увеличения его диаметра нецелесообразно, так как возрастает неравномерность схода шихты (центральная часть брикета перемещается быстрей периферийной) и неоднородность температурного поля по его сечению (у стен температура выше вследствие неравномерности распределения хлора).
Отношение по массе СО:СО2 в парогазовой смеси, выходящей из хлоратора, колеблется (в зависимости от режима) от 5:1 до 2:1.

Рисунок 42 Хлоратор для хлорирования в солевом расплаве:
Недостаток хлорирования брикетированной шихты - высокие затраты на приготовление брикетов, что повышает 10-15 % себестоимость хлорида; взрывоопасность отходящих газов, в которых преобладает СО.

1 - газоход; 2 - свод; 3 -графитовый электрод; 4 -стальные трубы для отвода тепла; 5 - кожух хлоратора; 6 -шамотная футеровка; 7 - бункер с шихтой; 8 - шнековый питатель; 9 - перегородка для создания циркуляции расплава; 10 - фурма; 11,12 - донные графитовые электроды; 13 -нижний слив расплава
Хлорирование в солевом расплаве. Этот способ разработан в СНГ. Хлорирование шлака проводится в ванне из расплава хлоридов щелочных и щелочно-земельных металлов, куда подают компоненты шихты (измельченные шлак и кокс) и хлор. В качестве расплава используют отработанный электролит магниевых электролизеров, имеющий следующий примерный состав, %: КС1 72-76; NаС1 14-16, МgС12 4-6. Шихта подается шнеком на поверхность расплава, хлор поступает в нижнюю часть хлоратора через фурмы и газораспределительную решетку (рис. 42). При удельном расходе хлора 40-60 м3/ч на 1 м3 расплава обеспечивается хорошее перемешивание его барботирующим хлором. В расплаве поддерживают концентрацию ТiO2 2-3 %, углерода 7-9 %. При высоте расплава 3-3,2 м хлор успевает полностью прореагировать в объеме расплава, лишь незначительная часть его уходит с отходящимися газами.
Необходимая температура расплава (800 - 850 oС) поддерживается за счет тепла экзотермических реакций. Избыточное тепло отводится с помощью установленных в стенке хлоратора кессонов из графитовых плит, в которые вмонтированы стальные трубы, куда подается вода.
В процессе хлорирования в расплаве накапливаются нелетучие хлориды (MgCl2, СаС12, а также FeCl2 и FeCl3 в форме комплексов KFeCl3 и KFeCl4 и др.). Периодически часть расплава выпускают и в хлоратор заливают свежий расплав. Отработанный расплав содержит, %: KCl 30 - 40, NaCl 2 - 5, MgCl2 25 - 35, FeCl2 + FeCl3 + MnCl2 10 - 20, SiO2 3 - 6, CaCl2 2 - 4, С 7 - 9, TiO2 0,5 - 1. В отличие от хлорирования брикетированных шихт в хлораторах с расплавом в составе парогазовой смеси преобладает СO2 [объемное соотношение СO2: СО = (10÷20):1], что объясняется неблагоприятными условиями для взаимодействия СO2 с частицами углерода.
Механизм (стадии) хлорирования диоксида титана в сложной системе, содержащей газовую, жидкую и две твердые фазы (TiO2 и кокс), недостаточно изучен.
Очевидно, что с поверхностью частиц кокса и TiO2, находящихся в расплаве, могут вступать во взаимодействие только растворенные в расплаве хлор, СO2 и СО, так как при хорошем смачивании кокса расплавом его поверхность экранирована жидкой средой от непосредственного контакта с пузырьками газа.
Растворимость хлора, СО и СO2 в расплавах KCl - NaCl - MgCl2 при 800 - 900 oС равна примерно 0,04, 0,02 и 1,5 г/л соответственно. Растворимость TiO2 не превышает 0,05 г/л.
Согласно одной из предложенных схем растворенный хлор хемосорбируется на поверхности частиц углеродистого материала с образованием активного (атомарного) хлора, переносимого через расплав к поверхности оксида, где при участии растворенного СО протекает реакция:
ТiO2 + 4С1акт + 2СО = ТiС14 + 2СО2.
Далее СО2 частично взаимодействует с углеродом с образованием СО. Эта схема объясняет наблюдаемое повышение скорости хлорирования с увеличением удельной поверхности кокса и преобладание СО2 над СО в газовой фазе.
Присутствие хлоридов железа в расплаве повышает скорость хлорирования. Это объясняется хлорирующим действием FеС13, легко отщепляющего активный хлор. Как указано выше, хлориды железа находятся в расплаве в форме комплексов
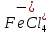 и
и 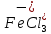 . Поэтому хлорирование ТiO2 с участием хлоридов железа можно представить суммарными реакциями:
. Поэтому хлорирование ТiO2 с участием хлоридов железа можно представить суммарными реакциями: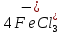 + 2С12 =
+ 2С12 = 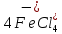 ; (4.13)
; (4.13)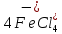 + ТiO2 + 2СО = ТiС14 +
+ ТiO2 + 2СО = ТiС14 + 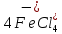 + 2СО2. (4.14)
+ 2СО2. (4.14)Таким образом, хлориды железа выполняют роль переносчиков хлора.
Поскольку хлориды железа хорошо растворимы в расплаве, концентрация хлорирующего агента будет зависеть от содержания в нем железа. Так, достаточно содержания 1 % FeCl3 в расплаве для существенного увеличения скорости процесса. При нормальной работе хлоратора (без проскока хлора) в расплаве устанавливается отношение FeCl2 : FeCl3 = 20 + 200 (по массе), причем концентрация FeCl2 находится в пределах 15 - 20 %, a FeCl3 0,1 - 1,0 %.
Вследствие образования комплексов большая часть железа (а также алюминия, образующего комплекс КA1Cl4) остается в солевом расплаве.
Основные преимущества хлорирования в солевом расплаве по сравнению с хлорированием брикетов следующие: исключены сложные операции подготовки брикетов, что снижает себестоимость хлорида. Возможно хлорирование шлаков с повышенным содержанием СаО и МgО. Быстрый тепло- и массообмен в расплаве обеспечивает высокую скорость хлорирования и возможность отвода избыточного тепла. Преобладание СО2 над СО в составе газов резко снижает их взрывоопасность.
К недостаткам хлорирования в расплаве следует отнести периодический вывод отработанного расплава (до 200 кг на 1 т ТiС14), с которым теряется часть титана. Хлориды -вредные производственные сбросы. Важная задача - их использование или регенерация с возвратом в процесс.
Пылеулавливание и конденсация хлоридов
Парогазовая смесь, выходящая из хлораторов, имеет сложный состав. Она содержит газы (СО, СО2, СОС12, N2, НС1, С12), низкокипящие хлориды - в нормальных условиях жидкости (ТiС14, SiС14,VОС13 и др.); низкокипящие хлориды - в нормальных условиях твердые (FеС13, А1С13); высококипящие хлориды СаС12, МgС12, FеС12, а также КС1, NаС1 (при хлорировании в расплаве). Высококипящие хлориды механически увлекаются парогазовым потоком в виде тумана.
На рис. 43 приведена распространенная схема пылеулавливания и конденсации. Она состоит из пылевых камер (кулеров) для улавливания твердых хлоридов; рукавного фильтра с рукавами из стеклоткани для дополнительной очистки парогазовой смеси от твердых частиц; двух оросительных конденсаторов (конденсаторов смешения) для жидких хлоридов (ТiС14, SiС14), орошаемых охлажденным тетрахлоридом титана; во втором конденсаторе тетрахлорид, поступающий на орошение, охлаждается до -10 С. Далее газы проходят санитарный скруббер, орошаемый известковым молоком, для улавливания небольших количеств хлора, фосгена, хлористого водорода и выбрасываются в атмосферу. В кулерах газы охлаждаются с 500-600 до 140-180 °С омывающим трубы воздухом. В нижней разгрузочной части кулеров поддерживается постоянная температура (120-130 °С) органическим теплоносителем, циркулирующим в рубашке разгрузочного корыта. Термостатирование рукавного фильтра (140-160 °С) также осуществляется жидким теплоносителем.

РBс.43. Схема раздельной конденсационной системы (пунктиром показан путь циркуляции теплоносителя):
1 - пылевые камеры (кулера); 2 — сборник твердых хлоридов; 5 - рукавный фильтр; 4 – оросительные конденсаторы; 5 - водяной холодильник; 6 - погружной насос; 7 - холодильник, охлаждаемый рассолом до -10 С (раствор СаС12)
Для снятия с рукавов из стеклоткани уловленной пыли производится их отдувка парами тетрахлорида титана.
В связи с осложненностью эксплуатации фильтров с рукавами из стеклоткани на некоторых предприятиях они заменены солевым расплавом NаС1 + КС1. (см. рис. 25). Расплав циркулирует с помощью аэролифтного устройства. Принцип работы солевого фильтра рассмотрен в гл. 2.
Извлечение титана из шлака в жидкий технический тетрахлорид составляет 92-93 %.
Очистка технического тетрахлорида титана
Содержание примесей в техническом ТiС14 колеблется примерно в следующих пределах, % (по массе): Si 0,01-0,3; А1 0,01-0,1; Fе 0,01-0,02; V 0,01-0,3; ТiOС12 0,04-0,5; СОС12 0,005-0,15; С1 0,003-0,08; S 0,01-0,08.
Кроме перечисленных, в хлориде титана часто содержатся примеси хлоридов ниобия, тантала, хрома и примеси органических соединений, например ацетилхлориды (СС13СОС1, СН2ClОСl), гексахлорбензол С6С16 и др.
Хлорид титана очищают от большинства примесей ректификацией, основанной на различии температур кипения хлоридов. Однако ректификации предшествует очистка от примеси ванадия.
Очистка от ванадия. Ванадия содержится в ТiС14 в составе оксихлорида VОС13. Отделение его от ТiС14 ректификацией затруднительно вследствие близости точек кипения ТiС14 и VОС13 (136 и 127 °С соответственно). Все известные методы очистки от ванадия основаны на восстановлении VОС13 до малорастворимого в тетрахлориде титана VОС12. На заводах в качестве восстановителей применяют медные или алюминиевые порошки.
Восстановление медным порошком протекает через стадию
образования СuТlС14:
Сu + ТiС14 = СuТiС14; (4.15)
СuТiС14 + VОС13 = VОС12 + CuС1 + ТiС14. (4.16)
Получаемые медно-ванадиевые осадки содержат, % Тi 6-8; V 4-6; С1
Производство диоксида титана
Сернокислотный способ
Основное количество выпускаемого диоксида титана из ильменитового концентрата (или титановых шлаков) получают сернокислотным способом, который включает следующие стадии:
-
разложение концентрата серной кислотой; -
очистку растворов от железа; -
гидролитическое выделение метатитановой кислоты из сернокислотного раствора; -
прокаливание осадка с получением диоксида титана.
Этот способ обеспечивает высокое извлечение титана в готовый продукт, причем в технологии практически используют один реагент - серную кислоту.
Разложение концентрата. Разложение ведут концентрированной Н2SО4 (92-94 %) или олеумом в стальных реакторах. Вследствие экзотермичности процесса после нагревания кислоты с измельченным концентратом до 125-135°С реакция проходит интенсивно с саморазогревом до 180-200°С и заканчивается за 5-10 мин. Получающаяся полусухая масса ("плав") содержит оксосульфат титана (IV) (ТiOSО4 • Н2О), FеSО4) избыточную Н2SО4. Плав выщелачивают водой.
Очистка растворов от железа.
Растворы содержат 110-120 г/л ТiO2 (в составе ТiOSО4),
сульфаты железа SеSО4 и Fе2(SО4)3 и 200-240 г/л активной Н2S04.
Для очистки от основной массы железа восстанавливают Fе3+ до Fе2+ железной стружкой, а затем проводят кристаллизацию железного купороса FеSО4-7 Н2О, охлаждая растворы до -5 °С. В результате кристаллизации содержание железа растворе понижается до
2. После нагревания до кипения в осадок выпадает 95-96% ТiO2.
В случае применения способа разбавления исходные растворы концентрируют выпариванием до содержания 240 -260 г/л ТiO2 и затем нагретый раствор по определенному режиму разбавляют, вливая в воду. При разбавлении раствора возникают зародыши - центры кристаллизации, а затем образуется осадок метатитановой кислоты.
Прокаливание метатитановой кислоты. Отфильтрованные и промытые осадки метатитановой кислоты прокаливают в барабанных печах, футерованных высокоглиноземистым кирпичом, при максимальной температуре 850-1000 °С (в зависимости от назначения ТiO2). Помимо воды при прокаливании удаляется содержащийся в осадках SО3.
Способ "сжигания" тетрахлорида титана.
В последние годы получает все большее развитие производство диоксида титана из тетрахлорида титана методом "сжигания", который основан на реакции:
ТiС14 + О2 = ТiO2 + 2 С12,
Δ
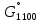 k = -81,5 кДж. (4.21)
k = -81,5 кДж. (4.21)Эта реакция при 900-1000 °С протекает с достаточной скоростью. Получаемый хлор возвращают на хлорирование титанового сырья.
Известно несколько вариантов проведения процесса "сжигания". Рассмотрим два из них.
-
Реакцию проводят в камере, в которой установлена
форсунка, куда поступают кислород и пары тетрахлорида титана, предварительно нагретые до 1000-1100 °С. На выходе из форсунки пары ТiС14 реагируют с кислородом с образованием желто-зеленого пламени. Поток газа уносит частицы
диоксида титана в пылевую камеру и рукавные фильтры. От
ходящие газы, содержащие 80-85 % хлора, пригодны для использования в производстве ТiС14.
Основное затруднение при использовании способа состоит в необходимости предварительного нагрева реагирующих компонентов до 1000-1100 °С.
-
Применение плазмы в качестве источника тепла - наиболее перспективный метод. Целесообразно использовать высокочастотную плазменную горелку с факелом кислородной плазмы. В факел, имеющий температуру 6000-10000 °С, вводят пары тетрахлорида титана, которые при столь высокой
температуре быстро реагируют с кислородом с образованием
тонкодисперсного диоксида титана рутильной модификации.
Основные преимущества технологии получения диоксида титана из тетрахлорида титана по способу "сжигания" в сравнении с сернокислотным способом:
-
технологическая схема проще, капитальные затраты в
среднем в 1,5 раза ниже; -
схема замкнута (хлор утилизируется), тогда как в
сернокислотной схеме затруднительна утилизация гидролизной серной кислоты; -
диоксид титана более высокой чистоты, а качество
получаемого из него пигмента выше, чем получаемого сернокислотным способом.
- 1 2 3 4 5
ПРОИЗВОДСТВО ХИМИЧЕСКИХ СОЕДИНЕНИЙ ЦИРКОНИЯ И ГАФНИЯ
Циркониевые минералы, руды и рудные концентраты
Содержание циркония в земной коре относительно высокое - 0,025 % (по массе). По распространенности он превосходит медь, цинк, олово, никель и свинец. Известно около 20 минералов циркония. Они концентрируются главным образом в гранитных и щелочных (нефелин-сиенитовых) пегматитах. Основными промышленными источниками в настоящее время служат минералы бедделеит и циркон. Сырьем могут служить также минералы эвдиалит и эвколит, но они значительно бедней по содержанию циркония.
Бадделеит. По составу представляет собой почти чистый диоксид циркония. В наиболее чистых образцах до 98 % ZrО2. Обычно содержит примесь гафния (до нескольких процентов), изредка уран (до 1 %) и торий (до 0,2 %). Месторождения редки. Плотность минерала 5,5-6. Наиболее крупное месторождение найдено в Бразилии.
Основные методы обогащения руд - гравитационные. Для отделения минералов железа и ильменита используют электромагнитное обогащение.
Циркон - ортосиликат циркония ZrSiО4 (67,2 % ZrО2, 32,8 % SiО2). Это наиболее распространенный минерал циркония. Концентрируется главным образом в пегматитах гранитной и особенно щелочной магмы. Часто встречается в россыпях, образующихся при разрушении коренных пород. Циркон большей частью имеет коричневый цвет, плотность минерала 4,4-4.7 г/см3, твердость 7,5 по минералогической шкале. Минерал обычно содержит гафний (0,5-4 %). Основные запасы циркона сосредоточены в прибрежно-морских россыпях. Здесь циркон накапливается вместе с ильменитом, рутилом, монацитом и рядом других минералов.
Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепарациями.
Выпускаемые цирконовые концентраты первого сорта должны содержать не менее 65% ZrО2. В них лимитируется содержание следующих примесей, % (не 6oлее): FeO 0,1; TiО2 0,4; A12O3 2,0; СаО и MgO 0,1; P2O5 0,15. Концентраты второго сорта должны содержать не менее 60% ZrО2, примеси не лимитируются.
Наиболее крупные месторождения циркона за рубежом расположены в Австралии, Индии, Бразилии, ЮАР, США. В СНГ циркон найден на Урале, Украине и в других районах страны.
Эвдиалит и эвколит. Состав эвдиалита может быть выражен общей эмпирической формулой: (Nа, Са)6 Zr [Si 6О18][ОН,С1]2.
Эвколит - разновидность эвдиалита, содержащего ионы Fе2+. Химический состав эвдиалита, %: Nа2О 11,6-17,3; ZrO2 12-14,5; FеО 3,1-7,1; SiO2 47,2-51,2; С1 0,7-1,6. Цвет минерала - розовый или малиновый. Минерал легко разлагается кислотами.
Эвдиалит и эвколит встречаются в магматических щелочных породах (нефелиновых сиенитах). Известны месторождения в СССР (на Кольском полуострове), Португалии, Гренландии, Трансваале, Бразилии и других странах.
В капиталистических странах в 1986г. было добыто 830 тыс.т цирконовых концентратов, в том числе в Австралии - 470, ЮАР - 150, США - 85.
Продукты переработки цирконовых концентратов
Цирконовые концентраты служат исходным материалом для производства ферросиликоциркония, ферроциркония и химических соединений циркония: диоксида циркония, фтороцирконата калия и тетрахлорида циркония, а также соединений гафния.
Ферросиликоцирконий непосредственно выплавляют из цирконовых концентратов. Технический диоксид циркония служит исходным материалом для получения ферроциркония и используется в производстве огнеупоров и керамики. Диоксид циркония высокой чистоты применяют для производства высококачественных огнеупорных изделий и порошкообразного циркония. Фтороцирконат калия и тетрахлорид циркония используют главным образом для производства металлического циркония. Ниже рассмотрены основные способы производства соединений циркония.
Производство диоксида циркония
Разложение концентрата
Циркон практически не разлагается соляной, серной и азотной кислотами. Для его разложения с целью перевода циркония в раствор используют большей частью спекание (или сплавление) с содой или спекание с карбонатом кальция (мелом). Образующиеся цирконаты натрия или кальция растворяются в кислотах, из раствора затем выделяют гид-роксид или основные соли циркония. Последние термически разлагают, получая диоксид циркония.
Разложение циркона спеканием с карбонатом натрия. При 1100-1200 °С сода реагирует с цирконом с образованием метацирконата и ортосиликата натрия:
ZrSiO4 + 3Na2CO3= Na2ZrO3+Na4SiO4+2CO2. (4.23)
Процесс можно проводить в барабанных печах непрерывного действия, питая печь гранулированной шихтой (размер гранул 5-10 мм). Грануляцию проводят на чашевом грануляторе при увлажнении шихты. Измельченный спек первоначально выщелачивают водой для извлечения в раствор большей части ортосиликата натрия. Осадки после водного выщелачивания обрабатывают соляной или серной кислотой. В первом случае получают солянокислый раствор, содержащий основной хлорид цирконила ZrОС12, во втором случае - растворы, содержащие основной сульфат циркония Zr(ОН)2SО4. При кислотной обработке образуется кремниевая кислота, для коагуляции которой в пульпу добавляют флокулянт полиакриламид. Осадки отделяют от цирконийсодержащих растворов фильтрацией.
Разложение циркона спекании с карбонатом кальция. Процесс основан на взаимодействии циркона с СаСО3:
ZrSiO4 + 3СаСО3 = СаZrО3 + Са2SiO4 + 3 СО2. (4.24)
Эта реакция протекает с достаточной скоростью лишь при 1400-1500 °С. Однако добавки в шихту небольшого количества хлорида кальция (
5 % от массы цирконового концентрата) позволяют снизить температуру спекания до 1100-1200 °С. Ускорение процесса в присутствии малых добавок СаС12 объясняется, вероятно, частичным образованием жидкой фазы (температура плавления СаС12 774 °С), а также увеличением структурных дефектов в кристаллах компонентов шихты под действием хлористого 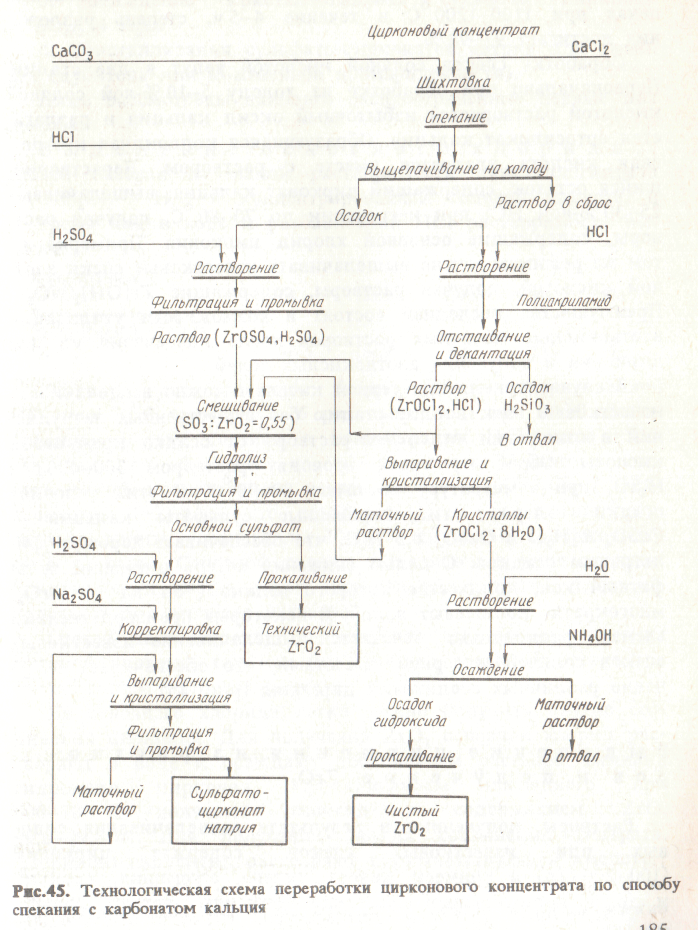 кальция.
кальция.
Рис.45. Технологическая схема переработки цирконового концентрата по способу спекания с карбонатом кальция
Шихту, содержащую измельченный цирконовый концентрат, мел и хлорид кальция, нагревают во вращающихся барабанных печах при 1100-1200 °С в течение 4-5 ч, степень разложения достигает 97-98 %.
Обработку спеков соляной кислотой ведут в две стадии. Первоначально при обработке на холоду 5-10 %-ной соляной кислотой растворяется избыточный оксид кальция и разлагается ортосиликат кальция. Образующаяся колоидная кремниевая кислота удаляется вместе с раствором. Нерастворившийся остаток, содержащий цирконат кальция, выщелачивают 25-30 %-ной НС1 при нагревании до 70-80 °C, получая растворы, содержащие основной хлорид циркония. Примерно по тем же режимам можно выщелачивать известковые спеки азотной кислотой, получая растворы, содержащие Zr(ОН)2(NО3)2. Преимущества последней состоят в возможноти утилизации азотнокислых маточных растворов после излечения из них циркония и получения азотнокислых солей.
В случае применения серной кислоты можно выщелачивать известковый спек в одну стадию без существенных затруднений в отношении отделения раствора от осадка кремниевой кислоты. Обработку спека проводят раствором 300-400 г/л Н2SО4 при температуре не выше 80-90 °С. В этих условиях осадки содержат гидратированные сульфаты кальция СаSО4 • 2 Н2О и СаSО4 • 0,5 Н2О, что обеспечивает хорошую фильтрацию осадков. С целью снижения потерь циркония сульфатный кек, количество которого велико (
6 т на 1т ZrО2) многократно промывают водой. В некоторых производственных схемах рационально сочетается выщелачивание известковых спеков соляной и серной кислотами, что обспечивает получение различных соединений циркония (рис. 45).
Выделение циркония из растворов и получение ZrО2
Растворы, полученные в результате выщелачивания содовых или известковых спеков, содержат цирконий (100-200 г/л) и примеси железа, титана, алюминия, кремния и др. В промышленной практике применяют четыре способа выделения циркония из растворов:
-
Выделение основного хлорида Zr(ОН)2С12•7 Н2О.
-
Выделение основных сульфатов циркония.
-
Осаждение кристаллогидрата сульфата циркония Zг(S04)2•4 Н20.
-
Кристаллизация сульфато-цирконатов натрия или аммония (дубитель для кожевенной промышленности).
Ниже рассмотрены наиболее распространенные первые два способа.
Выделение основного хлорида. Способ основан на малой растворимости кристаллогидрата Zг(ОН)2С12•7 Н2О в концентрированной соляной кислоте, в то время как в воде и разбавленной НС1 растворимость высокая.
Концентрация HCI, г/л
7,2
135,6
231,5
318
370
Растворимость при 20 °С Zг(ОН)2С12•7 Н2О г/л
567,5
164,9
20,5
10,8
17,8
Растворимость основного хлорида в концентрированной НС1 при 70 °С примерно в 5 раз выше, чем при 20 °С. Выпариванием нельзя достигнуть концентрации НС1 выше
220 г/л, так как образуется азеотропная смесь. Однако в кислоте такой концентрации растворимость Zr(ОН)2С12•7 Н2О невысокая (
25 г/л), что позволяет после охлаждения раствора выделить в кристаллы 70-80 % циркония, содержащегося в растворе. Основной хлорид выделяется в виде крупных кристаллов, имеющих форму тетрагональных призм, легко отделяемых от маточного раствора.
Способ дает возможность получить соединения циркония высокой чистоты, так как большинство примесей остается в солянокислом маточном растворе.
Из основного хлорида легко можно получить другие соединения циркония. Для получения ZгО2 основной хлорид растворяют в воде и осаждают добавлением раствора аммиака гидроксид циркония. Прокаливанием последнего при 600-700 °С получают диоксид с содержанием ZгО2 99,6-99,8 %. Для получения других соединений (нитрата, фторидов) гидроксид растворяют в соответствующей кислоте.
Выделение основных сульфатов. Малорастворимые основные сульфаты, состав которых можно выразить общей формулой х ZгО2• у SО3•z Н2О (х>у), выделяются из растворов при рН = 2+3 и мольном отношении SО3:ZгО2 в исходном растворе в пределах 0,55-0,9.
При нейтрализации сернокислого раствора, содержащего значительный избыток кислоты, содой или аммиаком, гидролитическое выделение основного сульфата циркония не происходит. Это объясняется тем, что в таких растворах цирконий находится в составе прочных анионов [ZгО(SО4)2]2-, образующих с катионами натрия и аммония хорошо растворимые соли. Гидролиз наступает лишь в случае вывода части ионов 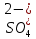 из растворов, например добавлением ВаС12 или СаС12, что усложняет технологию.
из растворов, например добавлением ВаС12 или СаС12, что усложняет технологию.
Значительно проще гидролитическое выделение основных сульфатов из солянокислых или азотнокислых растворов, так как в этом случае в раствор вводится дозированное количество сульфат-ионов (добавляют Н2SО4 или Ка2SО4).
Для осаждения основного сульфата в солянокислый раствор, содержащий 40-60 г/л циркония, добавляют Н2SО4 (0,5-0,7 моля на 1 моль ZгО2), нейтрализацией и разбавлением доводят кислотность до 1-1,5 г/л по НС1, а затем нагревают раствор до 70-80 °С. В осадок выделяется 97-98 % циркония, его состав примерно соответствует формуле 2ZгО2-SО3-5 Н2О.
Осадок основного сульфата после промывки, фильтрации и сушки прокаливают для удаления SО3 при 850-900 С в муфельных печах, футерованных высокоглиноземистым огнеупором. Получаемый технический диоксид циркония содержит 97-98 % ZгО2. Основные примеси следующие, %: ТiO2 0,25-0,5; SO2 0,2-0,5; Fе2О3 0,05-0,15; СаО 0,2-0,5; SО3 0,3-0,4.
Получение фтороцирконата калия
Наиболее просто фтороцирконат калия можно получить из цирконового концентрата по технологии, разработанной Н.П.Сажиным и Е.А.Пепеляевой. Способ основан на реакции, протекающей при нагревании циркона с фторосиликатом калия:
ZrSO4 + К2SiF6 = К2ZrF6 + 2 SiO2.
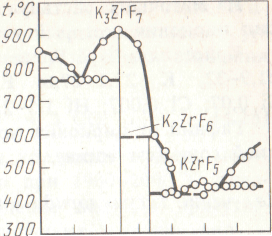
Рuс.46. Диаграмма состояния системы
О Ю 20 30 40 50 60 70
КF %(мол.) ZrF4
Как видно из диаграммы состояния системы КF-ZrF4 (рис.46), выше 600 °С К22гР6 разлагается с образованием К3ZrF7 и расплава, содержащего КF и ZrF4:
2 К2ZrF6 = К3ZrF7 + КF + ZrF4.
Поэтому продукт спекания, помимо К2ZrF6, может содержать некоторое количество К3ZrF7.
Полно циркон разлагается в интервале 650—700 С при условии введения в шихту хлористого калия, подавляющего диссоциацию К2SiF6 с образованием летучего SiF4.
При температурах спекания в шихте в результате взаимодействия компонентов образуется жидкая фаза, что способствует быстрому протеканию процесса. Получающийся в результате разложения спек выщелачивают водой. Из раствора затем кристаллизуют К2ZrF6.
Шихту, состоящую из измельченного циркона, фторосиликата калия (взятого с избытком
50 % от стехиометрического количества) и КС1 (10-40 % от массы циркона) спекают в барабанной печи. Спек состоит из слегка оплавленных гранул размером 0,5-10 мм. Его измельчают и выщелачивают подкисленной водой (1 % НС1) при соотношении Т:Ж = 1:7 и температуре 85 С.
Это позволяет охлаждением раствора до 15 С выкристаллизовать 80-90 % циркония
Из маточного раствора осаждают аммиачной водой гидроксид циркония, который возвращают в шихту для спекания.
Кристаллы К2ZrF6 имеют следующий состав, %: (Zr+Нf) 31,9-32; К 27,2-27,6; F 39,9-40,05; Fе 0,045; Тi 0,042; 81 0,07; С1 0,007; Hf 1,5-2,5 (по отношению к цирконию).
Гафний от циркония можно отделить дробной кристаллизацией соли.
Получение тетрахлорида циркония
Тетрахлорид циркония получают хлорированием трех продуктов: цирконового концентрата, карбида (карбонитрида) циркония, предварительно полученного из концентрата, и диоксида циркония. ,
Хлорирование цирконового концентрата. Цирконовый концентрат в смеси с углеродистым материалом хлорируется с
достаточной для практических целей скоростью при
900-1000 °С. Основные реакции процесса:
2ZrSiО4 + 4 С12 + 2 С = ZгС14 + SiС14 + 2 СО2;
CO2 + C= 2 CO
Теплоты реакции
125кДж недостаточно для самопроизвольного протекания процесса, необходим постоянный подвод тепла. Хлорирование проводят в шахтных хлораторах непрерывного действия, куда загружается брикетированная шихта. При содержании в брикетах 25-30 % углерода брикеты при температуре хлорирования обладают достаточной электропроводностью, что позволяет нагревать шихту с помощью графитовых электродов, вмонтированных в стенках хлоратора. Для прохождения тока через горячую шихту требуется напряжение
25В. Выгружаемый из печи остаток неполно прохлорированных брикетов возвращается на шихтовку.
Система улавливания состоит из пылевых камер для улавливания ZгС14 и оросительных конденсаторов (орошение охлажденным до -10 С ТiС14) для конденсации SiС14. Смесь жидких ТiС14 + SiС14 затем разделяют ректификацией. Состав технического тетрахлорида циркония следующий, %: Zг 33-36; С1 58-60; Fе 0,2-0,8; А1 1-1,6; Тi 0,05-0,1; Si « 0,01. Технический хлорид очищают возгонкой.
Тетрахлорид кремния используют для получения кремния и в производстве кремнийорганических соединений.
Хлорирование карбонитрида циркония. В этом технологическом варианте циркон первоначально восстанавливают углеродом при 1900-2000 С с образованием карбида циркония по основной реакции:
ZгSiO4 + 4 С = ZгС + SiO↑ + 3 СО.
Большая часть кремния при этом удаляется в виде монооксида 8Ю, давление пара которого при 1900-2000 С близко к ОД МПа. Поскольку восстановление ведут в присутствии азота воздуха, практически получают карбонитрид -твердый раствор ZгС-ZгN.
Таким образом, в результате восстановления отделяют большую часть кремния (95-96 %) и получают продукт с высоким содержанием циркония, который хлорируется с высокой скоростью.
Восстановление можно проводить в электродуговой печи или, как показали исследования, в печи кипящего слоя с непрерывным питанием ее гранулированной шихтой. Кипящий слой создается потоком азота. Примерный состав карбонитрида, получаемого в печи КС, %: Zг 70-73; Si 2-4; С 6-8; Fе 0,26; Тi 3-5; N 0,6.
Карбонитрид хлорируется с высокой скоростью, начиная с 400 С, причем выделяемого тепла достаточно для самопроизвольного протекания процесса даже в хлораторах небольшого размера. Реакции хлорирования:
ZгС + 2 С12 = ZгС14 + С + 846 кДж;
ZrN + 2 С12 = ZгС14 + 1/2 N2 + 670 кДж.
На одном из предприятий США хлорирование карбонитрида, полученного в результате карбидизации в электродуговой печи, проводили в шахтной печи, схема которой дана на рис. 47.
Шахта печи диаметром 1,0 м и высотой
2,5 м футерована динасовым кирпичом. Хлор поступает в печь через дырчатую графитовую плиту, на которую загружают слой кускового кокса. Процесс начинается с разогрева коксовой постели нагретым воздухом. Затем на нагретую постель загружают карбонитрид и впускают хлор. Интенсивное хлорирование начинается при 400 С и далее продолжается за счет теплоты реакции.
ПРОИЗВОДСТВО ХИМИЧЕСКИХ СОЕДИНЕНИЙ ЦИРКОНИЯ И ГАФНИЯ
Циркониевые минералы, руды и рудные концентраты
Содержание циркония в земной коре относительно высокое - 0,025 % (по массе). По распространенности он превосходит медь, цинк, олово, никель и свинец. Известно около 20 минералов циркония. Они концентрируются главным образом в гранитных и щелочных (нефелин-сиенитовых) пегматитах. Основными промышленными источниками в настоящее время служат минералы бедделеит и циркон. Сырьем могут служить также минералы эвдиалит и эвколит, но они значительно бедней по содержанию циркония.
Бадделеит. По составу представляет собой почти чистый диоксид циркония. В наиболее чистых образцах до 98 % ZrО2. Обычно содержит примесь гафния (до нескольких процентов), изредка уран (до 1 %) и торий (до 0,2 %). Месторождения редки. Плотность минерала 5,5-6. Наиболее крупное месторождение найдено в Бразилии.
Основные методы обогащения руд - гравитационные. Для отделения минералов железа и ильменита используют электромагнитное обогащение.
Циркон - ортосиликат циркония ZrSiО4 (67,2 % ZrО2, 32,8 % SiО2). Это наиболее распространенный минерал циркония. Концентрируется главным образом в пегматитах гранитной и особенно щелочной магмы. Часто встречается в россыпях, образующихся при разрушении коренных пород. Циркон большей частью имеет коричневый цвет, плотность минерала 4,4-4.7 г/см3, твердость 7,5 по минералогической шкале. Минерал обычно содержит гафний (0,5-4 %). Основные запасы циркона сосредоточены в прибрежно-морских россыпях. Здесь циркон накапливается вместе с ильменитом, рутилом, монацитом и рядом других минералов.
Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепарациями.
Выпускаемые цирконовые концентраты первого сорта должны содержать не менее 65% ZrО2. В них лимитируется содержание следующих примесей, % (не 6oлее): FeO 0,1; TiО2 0,4; A12O3 2,0; СаО и MgO 0,1; P2O5 0,15. Концентраты второго сорта должны содержать не менее 60% ZrО2, примеси не лимитируются.
Наиболее крупные месторождения циркона за рубежом расположены в Австралии, Индии, Бразилии, ЮАР, США. В СНГ циркон найден на Урале, Украине и в других районах страны.
Эвдиалит и эвколит. Состав эвдиалита может быть выражен общей эмпирической формулой: (Nа, Са)6 Zr [Si 6О18][ОН,С1]2.
Эвколит - разновидность эвдиалита, содержащего ионы Fе2+. Химический состав эвдиалита, %: Nа2О 11,6-17,3; ZrO2 12-14,5; FеО 3,1-7,1; SiO2 47,2-51,2; С1 0,7-1,6. Цвет минерала - розовый или малиновый. Минерал легко разлагается кислотами.
Эвдиалит и эвколит встречаются в магматических щелочных породах (нефелиновых сиенитах). Известны месторождения в СССР (на Кольском полуострове), Португалии, Гренландии, Трансваале, Бразилии и других странах.
В капиталистических странах в 1986г. было добыто 830 тыс.т цирконовых концентратов, в том числе в Австралии - 470, ЮАР - 150, США - 85.
Продукты переработки цирконовых концентратов
Цирконовые концентраты служат исходным материалом для производства ферросиликоциркония, ферроциркония и химических соединений циркония: диоксида циркония, фтороцирконата калия и тетрахлорида циркония, а также соединений гафния.
Ферросиликоцирконий непосредственно выплавляют из цирконовых концентратов. Технический диоксид циркония служит исходным материалом для получения ферроциркония и используется в производстве огнеупоров и керамики. Диоксид циркония высокой чистоты применяют для производства высококачественных огнеупорных изделий и порошкообразного циркония. Фтороцирконат калия и тетрахлорид циркония используют главным образом для производства металлического циркония. Ниже рассмотрены основные способы производства соединений циркония.
Производство диоксида циркония
Разложение концентрата
Циркон практически не разлагается соляной, серной и азотной кислотами. Для его разложения с целью перевода циркония в раствор используют большей частью спекание (или сплавление) с содой или спекание с карбонатом кальция (мелом). Образующиеся цирконаты натрия или кальция растворяются в кислотах, из раствора затем выделяют гид-роксид или основные соли циркония. Последние термически разлагают, получая диоксид циркония.
Разложение циркона спеканием с карбонатом натрия. При 1100-1200 °С сода реагирует с цирконом с образованием метацирконата и ортосиликата натрия:
ZrSiO4 + 3Na2CO3= Na2ZrO3+Na4SiO4+2CO2. (4.23)
Процесс можно проводить в барабанных печах непрерывного действия, питая печь гранулированной шихтой (размер гранул 5-10 мм). Грануляцию проводят на чашевом грануляторе при увлажнении шихты. Измельченный спек первоначально выщелачивают водой для извлечения в раствор большей части ортосиликата натрия. Осадки после водного выщелачивания обрабатывают соляной или серной кислотой. В первом случае получают солянокислый раствор, содержащий основной хлорид цирконила ZrОС12, во втором случае - растворы, содержащие основной сульфат циркония Zr(ОН)2SО4. При кислотной обработке образуется кремниевая кислота, для коагуляции которой в пульпу добавляют флокулянт полиакриламид. Осадки отделяют от цирконийсодержащих растворов фильтрацией.
Разложение циркона спекании с карбонатом кальция. Процесс основан на взаимодействии циркона с СаСО3:
ZrSiO4 + 3СаСО3 = СаZrО3 + Са2SiO4 + 3 СО2. (4.24)
Эта реакция протекает с достаточной скоростью лишь при 1400-1500 °С. Однако добавки в шихту небольшого количества хлорида кальция (
5 % от массы цирконового концентрата) позволяют снизить температуру спекания до 1100-1200 °С. Ускорение процесса в присутствии малых добавок СаС12 объясняется, вероятно, частичным образованием жидкой фазы (температура плавления СаС12 774 °С), а также увеличением структурных дефектов в кристаллах компонентов шихты под действием хлористого  кальция.
кальция.
Рис.45. Технологическая схема переработки цирконового концентрата по способу спекания с карбонатом кальция
Шихту, содержащую измельченный цирконовый концентрат, мел и хлорид кальция, нагревают во вращающихся барабанных печах при 1100-1200 °С в течение 4-5 ч, степень разложения достигает 97-98 %.
Обработку спеков соляной кислотой ведут в две стадии. Первоначально при обработке на холоду 5-10 %-ной соляной кислотой растворяется избыточный оксид кальция и разлагается ортосиликат кальция. Образующаяся колоидная кремниевая кислота удаляется вместе с раствором. Нерастворившийся остаток, содержащий цирконат кальция, выщелачивают 25-30 %-ной НС1 при нагревании до 70-80 °C, получая растворы, содержащие основной хлорид циркония. Примерно по тем же режимам можно выщелачивать известковые спеки азотной кислотой, получая растворы, содержащие Zr(ОН)2(NО3)2. Преимущества последней состоят в возможноти утилизации азотнокислых маточных растворов после излечения из них циркония и получения азотнокислых солей.
В случае применения серной кислоты можно выщелачивать известковый спек в одну стадию без существенных затруднений в отношении отделения раствора от осадка кремниевой кислоты. Обработку спека проводят раствором 300-400 г/л Н2SО4 при температуре не выше 80-90 °С. В этих условиях осадки содержат гидратированные сульфаты кальция СаSО4 • 2 Н2О и СаSО4 • 0,5 Н2О, что обеспечивает хорошую фильтрацию осадков. С целью снижения потерь циркония сульфатный кек, количество которого велико (
6 т на 1т ZrО2) многократно промывают водой. В некоторых производственных схемах рационально сочетается выщелачивание известковых спеков соляной и серной кислотами, что обспечивает получение различных соединений циркония (рис. 45).
Выделение циркония из растворов и получение ZrО2
Растворы, полученные в результате выщелачивания содовых или известковых спеков, содержат цирконий (100-200 г/л) и примеси железа, титана, алюминия, кремния и др. В промышленной практике применяют четыре способа выделения циркония из растворов:
-
Выделение основного хлорида Zr(ОН)2С12•7 Н2О.
-
Выделение основных сульфатов циркония.
-
Осаждение кристаллогидрата сульфата циркония Zг(S04)2•4 Н20.
-
Кристаллизация сульфато-цирконатов натрия или аммония (дубитель для кожевенной промышленности).
Ниже рассмотрены наиболее распространенные первые два способа.
Выделение основного хлорида. Способ основан на малой растворимости кристаллогидрата Zг(ОН)2С12•7 Н2О в концентрированной соляной кислоте, в то время как в воде и разбавленной НС1 растворимость высокая.
Концентрация HCI, г/л
7,2
135,6
231,5
318
370
Растворимость при 20 °С Zг(ОН)2С12•7 Н2О г/л
567,5
164,9
20,5
10,8
17,8
Растворимость основного хлорида в концентрированной НС1 при 70 °С примерно в 5 раз выше, чем при 20 °С. Выпариванием нельзя достигнуть концентрации НС1 выше
220 г/л, так как образуется азеотропная смесь. Однако в кислоте такой концентрации растворимость Zr(ОН)2С12•7 Н2О невысокая (
25 г/л), что позволяет после охлаждения раствора выделить в кристаллы 70-80 % циркония, содержащегося в растворе. Основной хлорид выделяется в виде крупных кристаллов, имеющих форму тетрагональных призм, легко отделяемых от маточного раствора.
Способ дает возможность получить соединения циркония высокой чистоты, так как большинство примесей остается в солянокислом маточном растворе.
Из основного хлорида легко можно получить другие соединения циркония. Для получения ZгО2 основной хлорид растворяют в воде и осаждают добавлением раствора аммиака гидроксид циркония. Прокаливанием последнего при 600-700 °С получают диоксид с содержанием ZгО2 99,6-99,8 %. Для получения других соединений (нитрата, фторидов) гидроксид растворяют в соответствующей кислоте.
Выделение основных сульфатов. Малорастворимые основные сульфаты, состав которых можно выразить общей формулой х ZгО2• у SО3•z Н2О (х>у), выделяются из растворов при рН = 2+3 и мольном отношении SО3:ZгО2 в исходном растворе в пределах 0,55-0,9.
При нейтрализации сернокислого раствора, содержащего значительный избыток кислоты, содой или аммиаком, гидролитическое выделение основного сульфата циркония не происходит. Это объясняется тем, что в таких растворах цирконий находится в составе прочных анионов [ZгО(SО4)2]2-, образующих с катионами натрия и аммония хорошо растворимые соли. Гидролиз наступает лишь в случае вывода части ионов 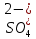 из растворов, например добавлением ВаС12 или СаС12, что усложняет технологию.
из растворов, например добавлением ВаС12 или СаС12, что усложняет технологию.
Значительно проще гидролитическое выделение основных сульфатов из солянокислых или азотнокислых растворов, так как в этом случае в раствор вводится дозированное количество сульфат-ионов (добавляют Н2SО4 или Ка2SО4).
Для осаждения основного сульфата в солянокислый раствор, содержащий 40-60 г/л циркония, добавляют Н2SО4 (0,5-0,7 моля на 1 моль ZгО2), нейтрализацией и разбавлением доводят кислотность до 1-1,5 г/л по НС1, а затем нагревают раствор до 70-80 °С. В осадок выделяется 97-98 % циркония, его состав примерно соответствует формуле 2ZгО2-SО3-5 Н2О.
Осадок основного сульфата после промывки, фильтрации и сушки прокаливают для удаления SО3 при 850-900 С в муфельных печах, футерованных высокоглиноземистым огнеупором. Получаемый технический диоксид циркония содержит 97-98 % ZгО2. Основные примеси следующие, %: ТiO2 0,25-0,5; SO2 0,2-0,5; Fе2О3 0,05-0,15; СаО 0,2-0,5; SО3 0,3-0,4.
Получение фтороцирконата калия
Наиболее просто фтороцирконат калия можно получить из цирконового концентрата по технологии, разработанной Н.П.Сажиным и Е.А.Пепеляевой. Способ основан на реакции, протекающей при нагревании циркона с фторосиликатом калия:
ZrSO4 + К2SiF6 = К2ZrF6 + 2 SiO2.
Рuс.46. Диаграмма состояния системы

О Ю 20 30 40 50 60 70
КF %(мол.) ZrF4
Как видно из диаграммы состояния системы КF-ZrF4 (рис.46), выше 600 °С К22гР6 разлагается с образованием К3ZrF7 и расплава, содержащего КF и ZrF4:
2 К2ZrF6 = К3ZrF7 + КF + ZrF4.
Поэтому продукт спекания, помимо К2ZrF6, может содержать некоторое количество К3ZrF7.
Полно циркон разлагается в интервале 650—700 С при условии введения в шихту хлористого калия, подавляющего диссоциацию К2SiF6 с образованием летучего SiF4.
При температурах спекания в шихте в результате взаимодействия компонентов образуется жидкая фаза, что способствует быстрому протеканию процесса. Получающийся в результате разложения спек выщелачивают водой. Из раствора затем кристаллизуют К2ZrF6.
Шихту, состоящую из измельченного циркона, фторосиликата калия (взятого с избытком
50 % от стехиометрического количества) и КС1 (10-40 % от массы циркона) спекают в барабанной печи. Спек состоит из слегка оплавленных гранул размером 0,5-10 мм. Его измельчают и выщелачивают подкисленной водой (1 % НС1) при соотношении Т:Ж = 1:7 и температуре 85 С.
Это позволяет охлаждением раствора до 15 С выкристаллизовать 80-90 % циркония
Из маточного раствора осаждают аммиачной водой гидроксид циркония, который возвращают в шихту для спекания.
Кристаллы К2ZrF6 имеют следующий состав, %: (Zr+Нf) 31,9-32; К 27,2-27,6; F 39,9-40,05; Fе 0,045; Тi 0,042; 81 0,07; С1 0,007; Hf 1,5-2,5 (по отношению к цирконию).
Гафний от циркония можно отделить дробной кристаллизацией соли.
Получение тетрахлорида циркония
Тетрахлорид циркония получают хлорированием трех продуктов: цирконового концентрата, карбида (карбонитрида) циркония, предварительно полученного из концентрата, и диоксида циркония. ,
Хлорирование цирконового концентрата. Цирконовый концентрат в смеси с углеродистым материалом хлорируется с
достаточной для практических целей скоростью при
900-1000 °С. Основные реакции процесса:
2ZrSiО4 + 4 С12 + 2 С = ZгС14 + SiС14 + 2 СО2;
CO2 + C= 2 CO
Теплоты реакции
125кДж недостаточно для самопроизвольного протекания процесса, необходим постоянный подвод тепла. Хлорирование проводят в шахтных хлораторах непрерывного действия, куда загружается брикетированная шихта. При содержании в брикетах 25-30 % углерода брикеты при температуре хлорирования обладают достаточной электропроводностью, что позволяет нагревать шихту с помощью графитовых электродов, вмонтированных в стенках хлоратора. Для прохождения тока через горячую шихту требуется напряжение
ПРОИЗВОДСТВО ХИМИЧЕСКИХ СОЕДИНЕНИЙ ЦИРКОНИЯ И ГАФНИЯ
Циркониевые минералы, руды и рудные концентраты
Содержание циркония в земной коре относительно высокое - 0,025 % (по массе). По распространенности он превосходит медь, цинк, олово, никель и свинец. Известно около 20 минералов циркония. Они концентрируются главным образом в гранитных и щелочных (нефелин-сиенитовых) пегматитах. Основными промышленными источниками в настоящее время служат минералы бедделеит и циркон. Сырьем могут служить также минералы эвдиалит и эвколит, но они значительно бедней по содержанию циркония.
Бадделеит. По составу представляет собой почти чистый диоксид циркония. В наиболее чистых образцах до 98 % ZrО2. Обычно содержит примесь гафния (до нескольких процентов), изредка уран (до 1 %) и торий (до 0,2 %). Месторождения редки. Плотность минерала 5,5-6. Наиболее крупное месторождение найдено в Бразилии.
Основные методы обогащения руд - гравитационные. Для отделения минералов железа и ильменита используют электромагнитное обогащение.
Циркон - ортосиликат циркония ZrSiО4 (67,2 % ZrО2, 32,8 % SiО2). Это наиболее распространенный минерал циркония. Концентрируется главным образом в пегматитах гранитной и особенно щелочной магмы. Часто встречается в россыпях, образующихся при разрушении коренных пород. Циркон большей частью имеет коричневый цвет, плотность минерала 4,4-4.7 г/см3, твердость 7,5 по минералогической шкале. Минерал обычно содержит гафний (0,5-4 %). Основные запасы циркона сосредоточены в прибрежно-морских россыпях. Здесь циркон накапливается вместе с ильменитом, рутилом, монацитом и рядом других минералов.
Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепарациями.
Выпускаемые цирконовые концентраты первого сорта должны содержать не менее 65% ZrО2. В них лимитируется содержание следующих примесей, % (не 6oлее): FeO 0,1; TiО2 0,4; A12O3 2,0; СаО и MgO 0,1; P2O5 0,15. Концентраты второго сорта должны содержать не менее 60% ZrО2, примеси не лимитируются.
Наиболее крупные месторождения циркона за рубежом расположены в Австралии, Индии, Бразилии, ЮАР, США. В СНГ циркон найден на Урале, Украине и в других районах страны.
Эвдиалит и эвколит. Состав эвдиалита может быть выражен общей эмпирической формулой: (Nа, Са)6 Zr [Si 6О18][ОН,С1]2.
Эвколит - разновидность эвдиалита, содержащего ионы Fе2+. Химический состав эвдиалита, %: Nа2О 11,6-17,3; ZrO2 12-14,5; FеО 3,1-7,1; SiO2 47,2-51,2; С1 0,7-1,6. Цвет минерала - розовый или малиновый. Минерал легко разлагается кислотами.
Эвдиалит и эвколит встречаются в магматических щелочных породах (нефелиновых сиенитах). Известны месторождения в СССР (на Кольском полуострове), Португалии, Гренландии, Трансваале, Бразилии и других странах.
В капиталистических странах в 1986г. было добыто 830 тыс.т цирконовых концентратов, в том числе в Австралии - 470, ЮАР - 150, США - 85.
Продукты переработки цирконовых концентратов
Цирконовые концентраты служат исходным материалом для производства ферросиликоциркония, ферроциркония и химических соединений циркония: диоксида циркония, фтороцирконата калия и тетрахлорида циркония, а также соединений гафния.
Ферросиликоцирконий непосредственно выплавляют из цирконовых концентратов. Технический диоксид циркония служит исходным материалом для получения ферроциркония и используется в производстве огнеупоров и керамики. Диоксид циркония высокой чистоты применяют для производства высококачественных огнеупорных изделий и порошкообразного циркония. Фтороцирконат калия и тетрахлорид циркония используют главным образом для производства металлического циркония. Ниже рассмотрены основные способы производства соединений циркония.
Производство диоксида циркония
Разложение концентрата
Циркон практически не разлагается соляной, серной и азотной кислотами. Для его разложения с целью перевода циркония в раствор используют большей частью спекание (или сплавление) с содой или спекание с карбонатом кальция (мелом). Образующиеся цирконаты натрия или кальция растворяются в кислотах, из раствора затем выделяют гид-роксид или основные соли циркония. Последние термически разлагают, получая диоксид циркония.
Разложение циркона спеканием с карбонатом натрия. При 1100-1200 °С сода реагирует с цирконом с образованием метацирконата и ортосиликата натрия:
ZrSiO4 + 3Na2CO3= Na2ZrO3+Na4SiO4+2CO2. (4.23)
Процесс можно проводить в барабанных печах непрерывного действия, питая печь гранулированной шихтой (размер гранул 5-10 мм). Грануляцию проводят на чашевом грануляторе при увлажнении шихты. Измельченный спек первоначально выщелачивают водой для извлечения в раствор большей части ортосиликата натрия. Осадки после водного выщелачивания обрабатывают соляной или серной кислотой. В первом случае получают солянокислый раствор, содержащий основной хлорид цирконила ZrОС12, во втором случае - растворы, содержащие основной сульфат циркония Zr(ОН)2SО4. При кислотной обработке образуется кремниевая кислота, для коагуляции которой в пульпу добавляют флокулянт полиакриламид. Осадки отделяют от цирконийсодержащих растворов фильтрацией.
Разложение циркона спекании с карбонатом кальция. Процесс основан на взаимодействии циркона с СаСО3:
ZrSiO4 + 3СаСО3 = СаZrО3 + Са2SiO4 + 3 СО2. (4.24)
Эта реакция протекает с достаточной скоростью лишь при 1400-1500 °С. Однако добавки в шихту небольшого количества хлорида кальция (
5 % от массы цирконового концентрата) позволяют снизить температуру спекания до 1100-1200 °С. Ускорение процесса в присутствии малых добавок СаС12 объясняется, вероятно, частичным образованием жидкой фазы (температура плавления СаС12 774 °С), а также увеличением структурных дефектов в кристаллах компонентов шихты под действием хлористого  кальция.
кальция.
Рис.45. Технологическая схема переработки цирконового концентрата по способу спекания с карбонатом кальция
Шихту, содержащую измельченный цирконовый концентрат, мел и хлорид кальция, нагревают во вращающихся барабанных печах при 1100-1200 °С в течение 4-5 ч, степень разложения достигает 97-98 %.
Обработку спеков соляной кислотой ведут в две стадии. Первоначально при обработке на холоду 5-10 %-ной соляной кислотой растворяется избыточный оксид кальция и разлагается ортосиликат кальция. Образующаяся колоидная кремниевая кислота удаляется вместе с раствором. Нерастворившийся остаток, содержащий цирконат кальция, выщелачивают 25-30 %-ной НС1 при нагревании до 70-80 °C, получая растворы, содержащие основной хлорид циркония. Примерно по тем же режимам можно выщелачивать известковые спеки азотной кислотой, получая растворы, содержащие Zr(ОН)2(NО3)2. Преимущества последней состоят в возможноти утилизации азотнокислых маточных растворов после излечения из них циркония и получения азотнокислых солей.
В случае применения серной кислоты можно выщелачивать известковый спек в одну стадию без существенных затруднений в отношении отделения раствора от осадка кремниевой кислоты. Обработку спека проводят раствором 300-400 г/л Н2SО4 при температуре не выше 80-90 °С. В этих условиях осадки содержат гидратированные сульфаты кальция СаSО4 • 2 Н2О и СаSО4 • 0,5 Н2О, что обеспечивает хорошую фильтрацию осадков. С целью снижения потерь циркония сульфатный кек, количество которого велико (
6 т на 1т ZrО2) многократно промывают водой. В некоторых производственных схемах рационально сочетается выщелачивание известковых спеков соляной и серной кислотами, что обспечивает получение различных соединений циркония (рис. 45).
Выделение циркония из растворов и получение ZrО2
Растворы, полученные в результате выщелачивания содовых или известковых спеков, содержат цирконий (100-200 г/л) и примеси железа, титана, алюминия, кремния и др. В промышленной практике применяют четыре способа выделения циркония из растворов:
-
Выделение основного хлорида Zr(ОН)2С12•7 Н2О.
-
Выделение основных сульфатов циркония.
-
Осаждение кристаллогидрата сульфата циркония Zг(S04)2•4 Н20.
-
Кристаллизация сульфато-цирконатов натрия или аммония (дубитель для кожевенной промышленности).
Ниже рассмотрены наиболее распространенные первые два способа.
Выделение основного хлорида. Способ основан на малой растворимости кристаллогидрата Zг(ОН)2С12•7 Н2О в концентрированной соляной кислоте, в то время как в воде и разбавленной НС1 растворимость высокая.
Концентрация HCI, г/л
7,2
135,6
231,5
318
370
Растворимость при 20 °С Zг(ОН)2С12•7 Н2О г/л
567,5
164,9
20,5
10,8
17,8
Растворимость основного хлорида в концентрированной НС1 при 70 °С примерно в 5 раз выше, чем при 20 °С. Выпариванием нельзя достигнуть концентрации НС1 выше
220 г/л, так как образуется азеотропная смесь. Однако в кислоте такой концентрации растворимость Zr(ОН)2С12•7 Н2О невысокая (
25 г/л), что позволяет после охлаждения раствора выделить в кристаллы 70-80 % циркония, содержащегося в растворе. Основной хлорид выделяется в виде крупных кристаллов, имеющих форму тетрагональных призм, легко отделяемых от маточного раствора.
ПРОИЗВОДСТВО ХИМИЧЕСКИХ СОЕДИНЕНИЙ ЦИРКОНИЯ И ГАФНИЯ
Циркониевые минералы, руды и рудные концентраты
Содержание циркония в земной коре относительно высокое - 0,025 % (по массе). По распространенности он превосходит медь, цинк, олово, никель и свинец. Известно около 20 минералов циркония. Они концентрируются главным образом в гранитных и щелочных (нефелин-сиенитовых) пегматитах. Основными промышленными источниками в настоящее время служат минералы бедделеит и циркон. Сырьем могут служить также минералы эвдиалит и эвколит, но они значительно бедней по содержанию циркония.
Бадделеит. По составу представляет собой почти чистый диоксид циркония. В наиболее чистых образцах до 98 % ZrО2. Обычно содержит примесь гафния (до нескольких процентов), изредка уран (до 1 %) и торий (до 0,2 %). Месторождения редки. Плотность минерала 5,5-6. Наиболее крупное месторождение найдено в Бразилии.
Основные методы обогащения руд - гравитационные. Для отделения минералов железа и ильменита используют электромагнитное обогащение.
Циркон - ортосиликат циркония ZrSiО4 (67,2 % ZrО2, 32,8 % SiО2). Это наиболее распространенный минерал циркония. Концентрируется главным образом в пегматитах гранитной и особенно щелочной магмы. Часто встречается в россыпях, образующихся при разрушении коренных пород. Циркон большей частью имеет коричневый цвет, плотность минерала 4,4-4.7 г/см3, твердость 7,5 по минералогической шкале. Минерал обычно содержит гафний (0,5-4 %). Основные запасы циркона сосредоточены в прибрежно-морских россыпях. Здесь циркон накапливается вместе с ильменитом, рутилом, монацитом и рядом других минералов.
Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепарациями.
Выпускаемые цирконовые концентраты первого сорта должны содержать не менее 65% ZrО2. В них лимитируется содержание следующих примесей, % (не 6oлее): FeO 0,1; TiО2 0,4; A12O3 2,0; СаО и MgO 0,1; P2O5 0,15. Концентраты второго сорта должны содержать не менее 60% ZrО2, примеси не лимитируются.
Наиболее крупные месторождения циркона за рубежом расположены в Австралии, Индии, Бразилии, ЮАР, США. В СНГ циркон найден на Урале, Украине и в других районах страны.
Эвдиалит и эвколит. Состав эвдиалита может быть выражен общей эмпирической формулой: (Nа, Са)6 Zr [Si 6О18][ОН,С1]2.
Эвколит - разновидность эвдиалита, содержащего ионы Fе2+. Химический состав эвдиалита, %: Nа2О 11,6-17,3; ZrO2 12-14,5; FеО 3,1-7,1; SiO2 47,2-51,2; С1 0,7-1,6. Цвет минерала - розовый или малиновый. Минерал легко разлагается кислотами.
Эвдиалит и эвколит встречаются в магматических щелочных породах (нефелиновых сиенитах). Известны месторождения в СССР (на Кольском полуострове), Португалии, Гренландии, Трансваале, Бразилии и других странах.
В капиталистических странах в 1986г. было добыто 830 тыс.т цирконовых концентратов, в том числе в Австралии - 470, ЮАР - 150, США - 85.
Продукты переработки цирконовых концентратов
Цирконовые концентраты служат исходным материалом для производства ферросиликоциркония, ферроциркония и химических соединений циркония: диоксида циркония, фтороцирконата калия и тетрахлорида циркония, а также соединений гафния.
Ферросиликоцирконий непосредственно выплавляют из цирконовых концентратов. Технический диоксид циркония служит исходным материалом для получения ферроциркония и используется в производстве огнеупоров и керамики. Диоксид циркония высокой чистоты применяют для производства высококачественных огнеупорных изделий и порошкообразного циркония. Фтороцирконат калия и тетрахлорид циркония используют главным образом для производства металлического циркония. Ниже рассмотрены основные способы производства соединений циркония.
Производство диоксида циркония
Разложение концентрата
Циркон практически не разлагается соляной, серной и азотной кислотами. Для его разложения с целью перевода циркония в раствор используют большей частью спекание (или сплавление) с содой или спекание с карбонатом кальция (мелом). Образующиеся цирконаты натрия или кальция растворяются в кислотах, из раствора затем выделяют гид-роксид или основные соли циркония. Последние термически разлагают, получая диоксид циркония.
Разложение циркона спеканием с карбонатом натрия. При 1100-1200 °С сода реагирует с цирконом с образованием метацирконата и ортосиликата натрия:
ZrSiO4 + 3Na2CO3= Na2ZrO3+Na4SiO4+2CO2. (4.23)
Процесс можно проводить в барабанных печах непрерывного действия, питая печь гранулированной шихтой (размер гранул 5-10 мм). Грануляцию проводят на чашевом грануляторе при увлажнении шихты. Измельченный спек первоначально выщелачивают водой для извлечения в раствор большей части ортосиликата натрия. Осадки после водного выщелачивания обрабатывают соляной или серной кислотой. В первом случае получают солянокислый раствор, содержащий основной хлорид цирконила ZrОС12, во втором случае - растворы, содержащие основной сульфат циркония Zr(ОН)2SО4. При кислотной обработке образуется кремниевая кислота, для коагуляции которой в пульпу добавляют флокулянт полиакриламид. Осадки отделяют от цирконийсодержащих растворов фильтрацией.
Разложение циркона спекании с карбонатом кальция. Процесс основан на взаимодействии циркона с СаСО3:
ZrSiO4 + 3СаСО3 = СаZrО3 + Са2SiO4 + 3 СО2. (4.24)
Эта реакция протекает с достаточной скоростью лишь при 1400-1500 °С. Однако добавки в шихту небольшого количества хлорида кальция (
5 % от массы цирконового концентрата) позволяют снизить температуру спекания до 1100-1200 °С. Ускорение процесса в присутствии малых добавок СаС12 объясняется, вероятно, частичным образованием жидкой фазы (температура плавления СаС12 774 °С), а также увеличением структурных дефектов в кристаллах компонентов шихты под действием хлористого  кальция.
кальция.
Рис.45. Технологическая схема переработки цирконового концентрата по способу спекания с карбонатом кальция
Шихту, содержащую измельченный цирконовый концентрат, мел и хлорид кальция, нагревают во вращающихся барабанных печах при 1100-1200 °С в течение 4-5 ч, степень разложения достигает 97-98 %.
Обработку спеков соляной кислотой ведут в две стадии. Первоначально при обработке на холоду 5-10 %-ной соляной кислотой растворяется избыточный оксид кальция и разлагается ортосиликат кальция. Образующаяся колоидная кремниевая кислота удаляется вместе с раствором. Нерастворившийся остаток, содержащий цирконат кальция, выщелачивают 25-30 %-ной НС1 при нагревании до 70-80 °C, получая растворы, содержащие основной хлорид циркония. Примерно по тем же режимам можно выщелачивать известковые спеки азотной кислотой, получая растворы, содержащие Zr(ОН)2(NО3)2. Преимущества последней состоят в возможноти утилизации азотнокислых маточных растворов после излечения из них циркония и получения азотнокислых солей.
В случае применения серной кислоты можно выщелачивать известковый спек в одну стадию без существенных затруднений в отношении отделения раствора от осадка кремниевой кислоты. Обработку спека проводят раствором 300-400 г/л Н2SО4 при температуре не выше 80-90 °С. В этих условиях осадки содержат гидратированные сульфаты кальция СаSО4 • 2 Н2О и СаSО4 • 0,5 Н2О, что обеспечивает хорошую фильтрацию осадков. С целью снижения потерь циркония сульфатный кек, количество которого велико (
6 т на 1т ZrО2) многократно промывают водой. В некоторых производственных схемах рационально сочетается выщелачивание известковых спеков соляной и серной кислотами, что обспечивает получение различных соединений циркония (рис. 45).ПРОИЗВОДСТВО ХИМИЧЕСКИХ СОЕДИНЕНИЙ ЦИРКОНИЯ И ГАФНИЯ
Циркониевые минералы, руды и рудные концентраты
Содержание циркония в земной коре относительно высокое - 0,025 % (по массе). По распространенности он превосходит медь, цинк, олово, никель и свинец. Известно около 20 минералов циркония. Они концентрируются главным образом в гранитных и щелочных (нефелин-сиенитовых) пегматитах. Основными промышленными источниками в настоящее время служат минералы бедделеит и циркон. Сырьем могут служить также минералы эвдиалит и эвколит, но они значительно бедней по содержанию циркония.
Бадделеит. По составу представляет собой почти чистый диоксид циркония. В наиболее чистых образцах до 98 % ZrО2. Обычно содержит примесь гафния (до нескольких процентов), изредка уран (до 1 %) и торий (до 0,2 %). Месторождения редки. Плотность минерала 5,5-6. Наиболее крупное месторождение найдено в Бразилии.
Основные методы обогащения руд - гравитационные. Для отделения минералов железа и ильменита используют электромагнитное обогащение.
Циркон - ортосиликат циркония ZrSiО4 (67,2 % ZrО2, 32,8 % SiО2). Это наиболее распространенный минерал циркония. Концентрируется главным образом в пегматитах гранитной и особенно щелочной магмы. Часто встречается в россыпях, образующихся при разрушении коренных пород. Циркон большей частью имеет коричневый цвет, плотность минерала 4,4-4.7 г/см3, твердость 7,5 по минералогической шкале. Минерал обычно содержит гафний (0,5-4 %). Основные запасы циркона сосредоточены в прибрежно-морских россыпях. Здесь циркон накапливается вместе с ильменитом, рутилом, монацитом и рядом других минералов.
Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепарациями.
Выпускаемые цирконовые концентраты первого сорта должны содержать не менее 65% ZrО2. В них лимитируется содержание следующих примесей, % (не 6oлее): FeO 0,1; TiО2 0,4; A12O3 2,0; СаО и MgO 0,1; P2O5 0,15. Концентраты второго сорта должны содержать не менее 60% ZrО2, примеси не лимитируются.
Наиболее крупные месторождения циркона за рубежом расположены в Австралии, Индии, Бразилии, ЮАР, США. В СНГ циркон найден на Урале, Украине и в других районах страны.
Эвдиалит и эвколит. Состав эвдиалита может быть выражен общей эмпирической формулой: (Nа, Са)6 Zr [Si 6О18][ОН,С1]2.
Эвколит - разновидность эвдиалита, содержащего ионы Fе2+. Химический состав эвдиалита, %: Nа2О 11,6-17,3; ZrO2 12-14,5; FеО 3,1-7,1; SiO2 47,2-51,2; С1 0,7-1,6. Цвет минерала - розовый или малиновый. Минерал легко разлагается кислотами.
Эвдиалит и эвколит встречаются в магматических щелочных породах (нефелиновых сиенитах). Известны месторождения в СССР (на Кольском полуострове), Португалии, Гренландии, Трансваале, Бразилии и других странах.
В капиталистических странах в 1986г. было добыто 830 тыс.т цирконовых концентратов, в том числе в Австралии - 470, ЮАР - 150, США - 85.
Продукты переработки цирконовых концентратов
Цирконовые концентраты служат исходным материалом для производства ферросиликоциркония, ферроциркония и химических соединений циркония: диоксида циркония, фтороцирконата калия и тетрахлорида циркония, а также соединений гафния.
Ферросиликоцирконий непосредственно выплавляют из цирконовых концентратов. Технический диоксид циркония служит исходным материалом для получения ферроциркония и используется в производстве огнеупоров и керамики. Диоксид циркония высокой чистоты применяют для производства высококачественных огнеупорных изделий и порошкообразного циркония. Фтороцирконат калия и тетрахлорид циркония используют главным образом для производства металлического циркония. Ниже рассмотрены основные способы производства соединений циркония.
Производство диоксида циркония
Разложение концентрата
Циркон практически не разлагается соляной, серной и азотной кислотами. Для его разложения с целью перевода циркония в раствор используют большей частью спекание (или сплавление) с содой или спекание с карбонатом кальция (мелом). Образующиеся цирконаты натрия или кальция растворяются в кислотах, из раствора затем выделяют гид-роксид или основные соли циркония. Последние термически разлагают, получая диоксид циркония.
Разложение циркона спеканием с карбонатом натрия. При 1100-1200 °С сода реагирует с цирконом с образованием метацирконата и ортосиликата натрия:
ZrSiO4 + 3Na2CO3= Na2ZrO3+Na4SiO4+2CO2. (4.23)
Процесс можно проводить в барабанных печах непрерывного действия, питая печь гранулированной шихтой (размер гранул 5-10 мм). Грануляцию проводят на чашевом грануляторе при увлажнении шихты. Измельченный спек первоначально выщелачивают водой для извлечения в раствор большей части ортосиликата натрия. Осадки после водного выщелачивания обрабатывают соляной или серной кислотой. В первом случае получают солянокислый раствор, содержащий основной хлорид цирконила ZrОС12, во втором случае - растворы, содержащие основной сульфат циркония Zr(ОН)2SО4. При кислотной обработке образуется кремниевая кислота, для коагуляции которой в пульпу добавляют флокулянт полиакриламид. Осадки отделяют от цирконийсодержащих растворов фильтрацией.
Разложение циркона спекании с карбонатом кальция. Процесс основан на взаимодействии циркона с СаСО3:
ZrSiO4 + 3СаСО3 = СаZrО3 + Са2SiO4 + 3 СО2. (4.24)
Эта реакция протекает с достаточной скоростью лишь при 1400-1500 °С. Однако добавки в шихту небольшого количества хлорида кальция (
Выделение циркония из растворов и получение ZrО2
Растворы, полученные в результате выщелачивания содовых или известковых спеков, содержат цирконий (100-200 г/л) и примеси железа, титана, алюминия, кремния и др. В промышленной практике применяют четыре способа выделения циркония из растворов:
-
Выделение основного хлорида Zr(ОН)2С12•7 Н2О. -
Выделение основных сульфатов циркония. -
Осаждение кристаллогидрата сульфата циркония Zг(S04)2•4 Н20. -
Кристаллизация сульфато-цирконатов натрия или аммония (дубитель для кожевенной промышленности).
Ниже рассмотрены наиболее распространенные первые два способа.
Выделение основного хлорида. Способ основан на малой растворимости кристаллогидрата Zг(ОН)2С12•7 Н2О в концентрированной соляной кислоте, в то время как в воде и разбавленной НС1 растворимость высокая.
| Концентрация HCI, г/л | 7,2 | 135,6 | 231,5 | 318 | 370 |
| Растворимость при 20 °С Zг(ОН)2С12•7 Н2О г/л | 567,5 | 164,9 | 20,5 | 10,8 | 17,8 |
Растворимость основного хлорида в концентрированной НС1 при 70 °С примерно в 5 раз выше, чем при 20 °С. Выпариванием нельзя достигнуть концентрации НС1 выше
Способ дает возможность получить соединения циркония высокой чистоты, так как большинство примесей остается в солянокислом маточном растворе.
Из основного хлорида легко можно получить другие соединения циркония. Для получения ZгО2 основной хлорид растворяют в воде и осаждают добавлением раствора аммиака гидроксид циркония. Прокаливанием последнего при 600-700 °С получают диоксид с содержанием ZгО2 99,6-99,8 %. Для получения других соединений (нитрата, фторидов) гидроксид растворяют в соответствующей кислоте.
Выделение основных сульфатов. Малорастворимые основные сульфаты, состав которых можно выразить общей формулой х ZгО2• у SО3•z Н2О (х>у), выделяются из растворов при рН = 2+3 и мольном отношении SО3:ZгО2 в исходном растворе в пределах 0,55-0,9.
При нейтрализации сернокислого раствора, содержащего значительный избыток кислоты, содой или аммиаком, гидролитическое выделение основного сульфата циркония не происходит. Это объясняется тем, что в таких растворах цирконий находится в составе прочных анионов [ZгО(SО4)2]2-, образующих с катионами натрия и аммония хорошо растворимые соли. Гидролиз наступает лишь в случае вывода части ионов
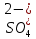 из растворов, например добавлением ВаС12 или СаС12, что усложняет технологию.
из растворов, например добавлением ВаС12 или СаС12, что усложняет технологию.Значительно проще гидролитическое выделение основных сульфатов из солянокислых или азотнокислых растворов, так как в этом случае в раствор вводится дозированное количество сульфат-ионов (добавляют Н2SО4 или Ка2SО4).
Для осаждения основного сульфата в солянокислый раствор, содержащий 40-60 г/л циркония, добавляют Н2SО4 (0,5-0,7 моля на 1 моль ZгО2), нейтрализацией и разбавлением доводят кислотность до 1-1,5 г/л по НС1, а затем нагревают раствор до 70-80 °С. В осадок выделяется 97-98 % циркония, его состав примерно соответствует формуле 2ZгО2-SО3-5 Н2О.
Осадок основного сульфата после промывки, фильтрации и сушки прокаливают для удаления SО3 при 850-900 С в муфельных печах, футерованных высокоглиноземистым огнеупором. Получаемый технический диоксид циркония содержит 97-98 % ZгО2. Основные примеси следующие, %: ТiO2 0,25-0,5; SO2 0,2-0,5; Fе2О3 0,05-0,15; СаО 0,2-0,5; SО3 0,3-0,4.
Получение фтороцирконата калия
Наиболее просто фтороцирконат калия можно получить из цирконового концентрата по технологии, разработанной Н.П.Сажиным и Е.А.Пепеляевой. Способ основан на реакции, протекающей при нагревании циркона с фторосиликатом калия:
ZrSO4 + К2SiF6 = К2ZrF6 + 2 SiO2.
Рuс.46. Диаграмма состояния системы

О Ю 20 30 40 50 60 70
КF %(мол.) ZrF4
Как видно из диаграммы состояния системы КF-ZrF4 (рис.46), выше 600 °С К22гР6 разлагается с образованием К3ZrF7 и расплава, содержащего КF и ZrF4:
2 К2ZrF6 = К3ZrF7 + КF + ZrF4.
Поэтому продукт спекания, помимо К2ZrF6, может содержать некоторое количество К3ZrF7.
Полно циркон разлагается в интервале 650—700 С при условии введения в шихту хлористого калия, подавляющего диссоциацию К2SiF6 с образованием летучего SiF4.
При температурах спекания в шихте в результате взаимодействия компонентов образуется жидкая фаза, что способствует быстрому протеканию процесса. Получающийся в результате разложения спек выщелачивают водой. Из раствора затем кристаллизуют К2ZrF6.
Шихту, состоящую из измельченного циркона, фторосиликата калия (взятого с избытком
