Файл: Липиды 1 Классификация липидов. Переваривание и всасывание липидов. Введение.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.03.2024
Просмотров: 144
Скачиваний: 0
СОДЕРЖАНИЕ
По функциональной нагрузке в организме различают две группы липидов:
По химическому строению липиды разделяют на омыляемые и неомыляемые
Жирные кислоты - это алифатические карбоновые кислоты.
Функции ацилглицеролов в организме многообразны
Сложные липиды - главные компоненты биологических мембран
Фосфолипиды - сложные липиды, содержащие фосфор
Сфингофосфолипиды содержат в своем составе сфингозин
Плазмалогены - это эфирные производные глицерофосфолипидов
Гликолипиды - это сфинголипиды, содержащие углеводы
Неомыляемые липиды не гидролизуются щелочью
Высшие углеводороды - производные изопрена
Простагландины - продукты окисления жирных кислот
Липиды транспортируются в крови в составе липопротеинов
Номенклатура и характеристика липопротеинов
Липиды, поступившие из кишечника (экзогенные), транспортируются в кровотоке в составе хиломикронов
ЛИПОПРОТЕИНЫ
Липопротеины - это сферические частицы, в которых можно выделить гидрофобную сердцевину, состоящую из триглицеридов (ТРГ) и эфиров холестерина (ЭХС) и амфифильную оболочку, в составе которой – фосфолипиды, гликолипиды и белки.
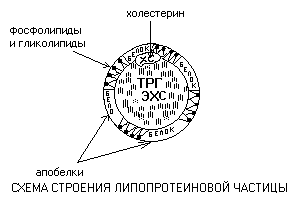
Белки оболочки называются апобелками. Холестерин (ХС) обычно занимает промежуточное положение между оболочкой и сердцевиной. Компоненты частицы связаны слабыми типами связей и находятся в состоянии постоянной диффузии – способны перемещаться друг относительно друга.
Основная роль липопротеинов – транспорт липидов, поэтому обнаружить их можно в биологических жидкостях.
При изучении липидов плазмы крови оказалось, что их можно разделить на группы, так как они отличаются друг от друга по соотношению компонентов. У разных липопротеинов наблюдается различное соотношение липидов и белка в составе частицы, поэтому различна и плотность.
Липопротеины разделяют по плотности методом ультрацентрифугирования, при этом они не осаждаются, а всплывают (флотируют). Мерой всплывания является константа флотации, обозначаемая Sf (сведберг флотации). В соответствии с этим показателем различают следующие группы липопротеинов:

Липопротеины можно разделить и методом электрофореза. При классическом щелочном электрофорезе разные липопротеины ведут себя по-разному. При помещении липопротеинов в электрическое поле хиломикроны остаются на старте. ЛОНП и ЛПП можно обнаружить во фракции пре-глобулинов, ЛНП - во фракции -глобулинов, а ЛВП - -глобулинов:
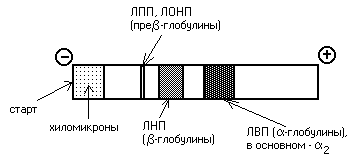
Определение липопротеинового спектра плазмы крови применяется в медицине для диагностики атеросклероза.
Все эти липопротеины отличаются по своей функции.
1. Хиломикроны (ХМ) - образуются в клетках кишечника, их функция: перенос экзогенного жира из кишечника в ткани (в основном - в жировую ткань), а также - транспорт экзогенного холестерина из кишечника в печень.
2. Липопротеины Очень Низкой Плотности
(ЛОНП) - образуются в печени, их роль: транспорт эндогенного жира, синтезированного в печени из углеводов, в жировую ткань.
3. Липопротеины Низкой Плотности (ЛНП) - образуются в кровеносном русле из ЛОНП через стадию образования Липопротеинов Промежуточной Плотности (ЛПП). Их роль: транспорт эндогенного холестерина в ткани.
4. Липопротеины Высокой Плотности (ЛВП) - образуются в печени, основная роль - транспорт холестерина из тканей в печень, то есть удаление холестерина из тканей, а дальше холестерин выводится с желчью.
При определении содержания в крови липопротеинов различной плотности их обычно разделяют методом электрофореза. При этом ХМ остаются на старте, ЛОНП оказываются во фракции пре-глобулинов, ЛНП и ЛПП находят во фракции -глобулинов, а ЛВП - 2-глобулинов. Если в крови повышено содержание -глобулинов (ЛНП) - это означает, что холестерин откладывается в тканях (развивается атеросклероз).
Общая характеристика апопротеинов в составе липопротеинов плазмы крови
| Апопротеин | Липопротеин | Мол. масса | Свойства |
| А - I | ЛПВП, хиломикроны | 28.000 | Активатор ЛХАТ |
| A - II | ЛПВП, хиломикроны | 17.000 | Два одинаковых мономера, связанных через дисульфидный мостик |
| B - 100 | ЛПНП, ЛПОНП, ЛППП | 550.000 | Лиганд для рецептора к ЛПНП; синтезируется в печени |
| B - 48 | Хиломикроны и обломки хиломикронов | 260.000 | Синтезируется в кишечнике |
| C - I | ЛПОНП, ЛПВП | 7.600 | Возможный активатор ЛХАТ (?) |
| C - II | ЛПОНП, ЛПНП, хиломикроны | 8.800 | Активатор внепеченочной липопротеинлипазы |
| C - III | ЛПОНП, ЛПВП, хиломикроны | 8.750 | Различные формы, содержащие сиаловую кислоту |
| D | ЛПВП | | Белок, переносящий ЭХ |
| E | ЛПОНП, ЛПВП, хиломикроны, обломки хиломикронов | | Лиганд для рецепторов, взаимодействующих с обломками ХМ |
Липиды, поступившие из кишечника (экзогенные), транспортируются в кровотоке в составе хиломикронов
Если образец плазмы крови, полученной у человека вскоре после приема жирной пищи, оставить стоять в пробирке на ночь, то на поверхности её появится сметанообразный слой. Этот слой состоит из хиломикронов - основного вида липопротеинов, секретируемых кишечником. Поскольку эти частицы содержат более 99% липидов, они имеют меньшую плотность, чем плазма крови и всплывают на поверхность пробирки. Частицы хиломикронов имеют большие размеры (100-250 нм в диаметре). Поэтому при прохождении через них света возникает рефракция, и плазма крови приобретает "молочный вид".
Синтез хиломикронов (ХМ). В клетках слизистой кишечника (энтероцитах) идет эстерификация 2-МАГ и ХС жирными кислотами, образуются ТАГ и ЭХ, из которых затем формируются ХМ. ХМ - это частицы, имеющие самую низкую плотность среди липопротеинов. ТАГ-ам в их составе принадлежит 95% всей массы. Размеры ХМ, которые являются самыми большими липопротеинами, колеблются в зависимости от количества ТАГ пищи (0,5-5 м в диаметре). Важнейшим структурным компонентом ХМ является апоВ-48, аналог апоВ-1002. В составе одной частицы ХМ находится одна молекула апоВ-48. Этот белок отличается от апоВ-100 тем, что будучи усеченным, он лишен места связывания для рецептора ЛПН.
Переход свободного холестерола из клеток на ЛПВП обусловлен разницей его концентраций на поверхности клеточных мембран и липопротеиновых частиц. Следовательно, он продолжается до тех пор, пока не выровняется концентрация холестерола между донором (поверхность мембран) и акцептором (ЛПВП). Поддержание градиента концентрации обеспечивается постоянным превращением свободного холестерола, поступающего на ЛПВП, в эфиры холестерола. Эта реакция, как уже указывалось, катализируется ферментом лецитин-холестерол-ацилтрансферазой (ЛХАТ3).
БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
Состоят из фосфолипидов, гликолипидов, белков и холестерина. В состав липидных компонентов мембран входят только фосфолипиды, а жира и эфиров холестерина в мембранах нет. Липидные участки мембран построены из фосфолипидов (ФЛ), гликолипидов (ГЛ) и ХС.
Мембраны можно рассматривать как белково-липидные комплексы. Белки и липиды, входящие в состав этих комплексов,
связаны слабыми типами связей, из которых наиболее часто встречается гидрофобное взаимодействие. Соотношение белков и липидов в различных мембранах разное. Но в большинстве плазматических мембран 50% белков и 50% липидов. Но есть мембраны, в которых много белков: внутренняя мембрана митохондрий на 80% состоит из белков, и только 20% составляют липиды. В миелиновых оболочках нервов, наоборот, 80% - липиды и 20% - белки. ХС встречается в основном в в плазматических мембранах.
В состав мембран входят только ЛИПОИДЫ (сложные липиды): ФОСФОЛИПИДЫ (ФЛ), ГЛИКОЛИПИДЫ (ГЛ) и из стероидов - ХОЛЕСТЕРИН (ХС).
РЕАКЦИИ СИНТЕЗА КЕТОНОВЫХ ТЕЛ
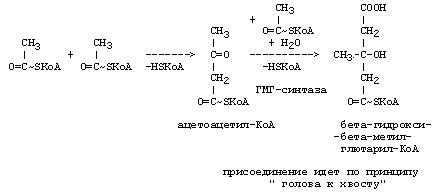
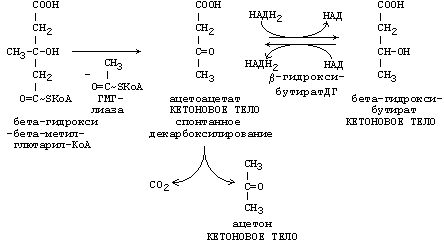
Ацетон, который образуется при спонтанном (неферментативном) декарбоксилировании ацетоацетата, в организме не используется. Он выводится с выдыхаемым воздухом, секретом потовых желёз и мочой. В норме концентрация ацетона в крови мала и обычными реакциями не определяется.
Кетоновые тела синтезируются в печени, легко проходят через митохондриальные и клеточные мембраны и поступают в кровь. Кровью они транспортируются во все другие ткани. Используются только ацетоацетат и бета-гидроксибутират.
УТИЛИЗАЦИЯ КЕТОНОВЫХ ТЕЛ
Происходит в митохондриях (кроме клеток печени).
Бета-гидроксибутират превращается в ацетоацетат, а ацетоацетат вступает в реакцию с промежуточным продуктом ЦТК - сукцинил-КоА.
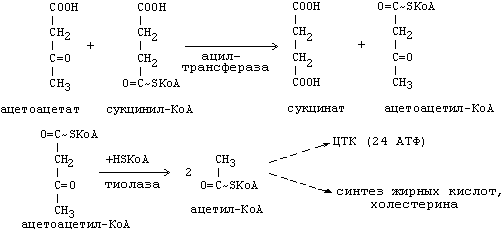
Пути использования образовавшегося из кетоновых тел АцетилКоА зависят от функционального состояния клетки (энергетический заряд) и ее специфики.
В ткани, которая получила этот Ацетил-КоА, он может быть использован для разных целей, но чаще всего в ЦТК для получения энергии.
В норме процессы синтеза и использования кетоновых тел уравновешены, поэтому концентрация кетоновых тел в крови и в тканях обычно очень низка, и составляет 0.12 - 0.30 ммоль/л.
Однако при общем или при углеводном голодании может нарушаться баланс между образованием и утилизацией кетоновых тел. Это связано с тем, что скорость образования кетоновых тел зависит от скорости -окисления жирных кислот в печени, а процесс -окисления ускоряется при усилении липолиза (распада жира) в жировой ткани. Усиление липолиза может происходить под действием гормона адреналина, при мышечной работе, при голодании. При недостатке инсулина (сахарный диабет) также происходит усиление липолиза. При усилении липолиза увеличивается скорость утилизации кетоновых тел, которые являются важными источниками энергии при мышечной работе, голодании.
Постепенное истощение запасов углеводов при сахарном диабете приводит к относительному отставанию утилизации кетоновых тел от кетогенеза. Причина отставания: не хватает сукцинил-КоА и ЩУК, которые, в основном, являются продуктом обмена углеводов. Поэтому верно выражение: "Жиры сгорают в пламени углеводов". Это означает, что для эффективного использования продуктов распада жира необходимы продукты углеводного обмена: сукцинил-КоА и ЩУК.
Таким образом, при углеводном голодании концентрация кетоновых тел в крови увеличивается. На 3-й день голодания концентрация кетоновых тел в крови будет примерно 2 - 3 ммоль/л, а при дальнейшем голодании - гораздо более высокой. Это состояние называют ГИПЕРКЕТОНЕМИЯ. У здоровых людей при мышечной работе и при голодании наблюдается гиперкетонемия, но она незначительна.
Похожая ситуация характерна для САХАРНОГО ДИАБЕТА. При сахарном диабете клетки постоянное сильнейшее углеводное голодание, потому что глюкоза плохо проникает в клетки. Наблюдается активация липолиза и повышается образование кетоновых тел. При тяжелых формах сахарного диабета концентрация кетоновых тел в крови может быть еще выше, и достигать опасных для жизни значений: до 20 ммоль/л и более.
Почему же накопление кетоновых тел является опасным для организма?
Все кетоновые тела являются органическими кислотами. Их накопление приводит к сдвигу pH в кислую сторону. В клинике повышение концентрации кетоновых тел в крови называется "ГИПЕРКЕТОНЕМИЯ", а сдвиг pH при этом в кислую сторону - "КЕТОАЦИДОЗ". Нарушается работа многих ферментативных систем. Увеличение концентрации ацетоацетата приводит к ускоренному образованию ацетона. Ацетон - токсичное вещество (органический растворитель). Он растворяется в липидных компонентах клеточных мембран и дезорганизует их. Страдают все ткани организма, а больше всего - клетки нервной ткани. Это может проявляться потерей сознания (ГИПЕРГЛИКЕМИЧЕСКАЯ КОМА). В очень тяжелых случаях может наступить гибель организма. Организм пытается защититься, поэтому часть кетоновых тел удаляется с мочой. Появление кетоновых тел в моче - это КЕТОНУРИЯ. Для распознавания гипер- и гипогликемической комы применяется экспресс-диагностика кетоновых тел. Основана на том, что гиперкетонемия приводит к выведению кетоновых тел с мочой (кетонурия). Поэтому проводят цветную реакцию на наличие кетоновых тел в моче. Раньше диагноз ставили по запаху ацетона изо рта больного при гипергликемической коме ("запах гнилых яблок").
