ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.04.2024
Просмотров: 16
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Тема I. Химическая термодинамика (1-й закон)
План
Введение
. Основные понятия раздела «химическая термодинамика»
.1 Термодинамическая химическая система, виды систем
.2 Термодинамические параметры
.3 Процесс, классификация процессов. Цикл
. Термодинамические функции - ΔU, ΔH
. Теплота Q и работа A
. Первый закон термодинамики
.1 Формулировки, аналитическое выражение, следствия
.2 Энтальпия - ΔH
.3 Теплоемкость
Введение
Термодинамика - как наука возникла в начале XIX века (в связи с необходимостью совершенствования тепловых машин).
В переводе с греческого «термос» означает тепло, а «динамос» - силу и мощь. Классическая термодинамика занимается исследованием энергии и работы в макроскопических системах. Этим объясняется ее значение для таких наук, как физика, химия, биология, геология, для многочисленных отраслей техники, так как любые процессы, происходящие в природе, сопровождаются изменением энергии.
Химическая термодинамика - это раздел химии, который изучает превращения энергии при химических процессах и способность химических систем (реагенты - продукты) выполнять полезную работу.
Использование законов этого раздела химии позволяет:
1 предсказывать возможность протекания химической реакции;
2 вычислять количество энергии, которое теоретически необходимо для проведения реакции, либо выделяется в результате самопроизвольного протекания реакции;
предсказать до какой степени продвинется реакция, прежде чем она достигнет состояния равновесия.
Эти и другие важные вопросы химическая термодинамика решает, не прибегая к данным о внутреннем строении вещества, используя лишь определяемые экспериментально параметры, такие как давление, температура, объем, концентрация и др.
В настоящее время законы термодинамики используют для расчетов, позволяющих предсказывать условия протекания и эффективность различных процессов и реакций, в том числе металлургических.
1. Основные понятия раздела «химическая термодинамика»
.1 Термодинамическая химическая система, виды систем
Система означает ту часть материального мира, который является предметом нашего наблюдения или исследования.
Термодинамическая химическая система это комплекс взаимодействующих между собой веществ, мысленно обособленный от окружающей среды.
Например, системой может быть химический стакан, содержащий определенное количество воды, либо теплообменник, используемый на химическом предприятии и т.д.
Различают три основных типа термодинамических систем (рис. 1)

Изолированные системы - не могут обмениваться с окружающей средой ни энергией, ни массой. Например, изолированный термостат, Вселенная в целом.
Закрытые системы - могут обмениваться с окружающей средой только энергией, но не массой. Например, совокупность молекул растворенного вещества можно рассматривать как закрытую систему, а в качестве внешней среды может быть все остальное (возможно растворитель, если он не участвует в реакции). Поэтому в химической термодинамике наиболее часто рассматривают именно закрытые системы.
Открытые системы - это системы, которые могут обмениваться с окружающей средой энергией и массой. Например, живые объекты животного или растительного мира.
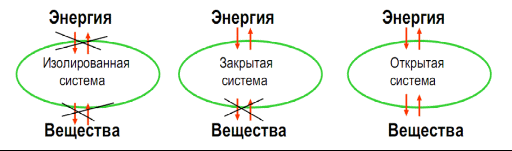
Рис. 1
Системы также можно разделить на гомогенные и гетерогенные.
Гомогенная система (однородная) - термодинамическая система, интенсивные свойства которой одинаковы во всех ее частях. Гомогенная среда состоит из одной фазы.
Гетерогенная система (неоднородная) - термодинамическая система, в которой хотя бы одно интенсивное свойство изменяется скачкообразно. Гетерогенная система состоит из двух и более фаз ,например:
а) система «бензол-вода» - система с непрерывными фазами
б) система «кусочки льда, плавающие в воде» (лед - прерывная фаза, состав фаз одинаков)
в) смесь кристаллов NaCl и KCl - обе фазы прерывны, химический состав обеих фаз различен.
1.2 Термодинамические параметры
Какую бы систему мы не рассматривали, она может быть в различных состояниях. А чтобы описать то или иное состояние, используют термодинамические характеристики (рис.2). С точки зрения одного из видов классификации: термодинамические характеристики можно рассматривать как основные, которые определяют состояние системы. Их называют параметрами состояния. Обычно это температура (Т), давление (Р) и количество вещества (n).
Остальные термодинамические характеристики зависят от этих трех параметров (Т, Р, n), а значит в целом и от состояния системы. Поэтому их называют функциями состояния.
Рис. 2
С точки зрения другой разновидности классификации, термодинамические характеристики можно разделить на:
| Экстенсивные параметры | Интенсивные параметры |
| Зависят от количества вещества и складываются при сложении однородных компонентов. V - объем m - масса n - количество вещества E - энергия системы S - энтропия | Не зависят от количества вещества и выравниваются при контакте систем или частей системы. T - температура P - давление ρ - плотность С - концентрация |
.3 Процесс, классификация процессов. Цикл
Процесс - это изменение термодинамических параметров.
Процессы делятся на:
· Обратимые
· Равновесные
· Необратимые
Для термодинамики принципиальное значение имеет деление всех процессов на обратимые и необратимые.
Обратимые процессы - это такие процессы, совершив которые, система возвращается в исходное состояние, не оставив изменений ни в системе, ни в окружающей среде. Все промежуточные состояния системы и окружающей среды в таком процессе - равновесные. Поэтому часто обратимые процессы называют еще равновесными. Процесс может протекать в равновесных условиях, когда при бесконечно малых воздействиях со стороны внешней среды происходят бесконечно малые изменения параметров.
Равновесный процесс - процесс, проходящий в прямом и обратном направлении через одни и те же состояния, бесконечно близкие к равновесию. Работа равновесного процесса является максимальной и обозначается Amax (рис.3).


Рис. 3
химический термодинамика сила закон
Примерами равновесных процессов являются идеальные механические процессы, протекающие без трения. Реальные физические, химические процессы всегда неравновесные.
Примерами крайних случаев неравновесных процессов являются:
· переход тепла от горячего тела к холодному;
· переход механической работы в тепло при трении;
· взрыв смеси;
· расширение газа в пустоту;
· самопроизвольное смешение газов, жидкостей.
Необратимые процессы - это процесс, при котором изменения в системе происходят и при этом система не возвращается в исходное состояние.
После термодинамически необратимого процесса систему только при определенных условиях можно вернуть в исходное состояние (т.е. осуществить химическую обратимость). Но для этого необходимо произвести какие-либо изменения в системе или окружающей среде, например, повысить концентрацию продуктов реакции или подвести дополнительную теплоту.
Таким образом, термодинамическая необратимость и химическая необратимость понятия различные.
Практически каждый реальный процесс является термодинамически необратимым, но представление об идеально обратимом процессе очень полезно.
Типы процессов:
· Изохорный (V = const)
· Изобарный (P = const)
· Изотермический (T = const)
· Адиабатный (Q = const, нет обмена с окружающей средой)
· Изобарно-изотермический (P,T = const)
· Изохорно-изотермический (T,V = const)
Наиболее распространены в химических системах изобарно-изотермические процессы (реакции, протекающие в открытых системах) и изохорно-изотермические процессы (протекающие в автоклавах)
Цикл - это обратимый термодинамический процесс, т.е. когда в результате изменения термодинамических параметров система приходит в первоначальное состояние.
2. Термодинамические функции - ΔU, ΔH
Каждая система обладает внутренней энергией (U).
U - внутренняя энергия имеет молекулярную природу, она складывается из кинетической энергии движущихся молекул (
Внутренняя энергия зависит от:
· химической природы тел и их состава
· температуры T (она является мерой средней кинетической энергии всех частиц в системе)
· объема V (потенциальная энергия зависит от расстояния между молекулами).
Таким образом,
Возможен случай (идеальный газ), когда при протекании процесса изменяется только кинетическая энергия, а потенциальная энергия остается постоянной.
Внутренняя энергия (U) определяет состояние системы и изменяется в результате участия системы в тех или иных процессах. Изменение внутренней энергии ΔU зависит от энергии начального (U1) и конечного (U2) состояний системы и не зависит от пути, по которому протекает процесс.
Это является следствием закона сохранения энергии.
Внутренняя энергия U имеет вполне определенное значение для каждого равновесного состояния независимо от предыдущих состояний системы, следовательно, она является функцией состояния. Значит, имеет смысл говорить о полном дифференциале внутренней энергии dU.
= f(V, T)à
Абсолютное значение U экспериментально определить невозможно. Практически можно измерить только изменение внутренней энергии:
ΔU = U2 - U1.
Энтальпия H, как и внутренняя энергия U, является функцией состояния, ее изменение не зависит от пути процесса, т.к. изменение p и V определяется только начальным и конечным состоянием.(Смотри с.13, пункт 4.2.)
3. Теплота Q и работа A
| Способы передачи энергии | |
| Теплота Q | Работа A |
Энергия (в переводе с греческого) - это мера способности совершать работу. Энергия, как и работа, в системе СИ измеряется в Дж. Внутренняя энергия системы, которая совершает работу, уменьшается, а в случае когда работу совершают над системой ее внутренняя энергия увеличивается, если одновременно не происходит передачи теплоты.
Для работы можно говорить лишь о ее бесконечно малом элементе δ, а не о полном дифференциале, т. к. она зависит от пути процесса и не является функцией состояния.
В отличие от внутренней энергии, теплота Q и работа A не являются функцией состояния системы. Теплота и работа возникают только тогда, когда имеет место процесс, т. е. при изменениях состояния системы. Теплота и работа являются формой передачи энергии, а не самой энергией. Именно поэтому не имеет смысла говорить о «запасе тепла» или о «запасе работы». Вместе с тем правильным будет, например, утверждение, что тело при данном процессе совершило определенную работу или получило определенное количество тепла.


