ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.04.2024
Просмотров: 18
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
с учетом стехиометрических коэффициентов.
S - греческая буква сигма, обозначающая математическую операцию суммирования.
Например, нужно определить тепловой эффект химической реакции

Решение:
Запишем следствие из закона Гесса в общем виде:
 (1)
(1)Запишем следствие из закона Гесса для реакции:
 (2)
(2)Значения стандартных энтальпий образования веществ находим по таблице 2.

Подставим числовые значения в уравнение (2)
Не только химические, но и физико-химические процессы могут сопровождаться выделением или поглощением теплоты (рис 5).
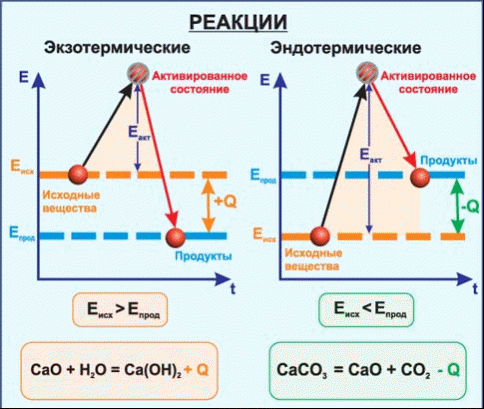
Рис. 5
4. Повторим еще раз
. Химическая термодинамика - раздел химии, который изучает переходи энергии с одной формы в другую при химических процессах (I-й закон термодинамики) и устанавливает направление и границы их самопроизвольного протекания при данных условиях (II -й закон термодинамики).
. Первый закон термодинамики: (математическая формула)
теплота, ΔU- изменение внутренней энергии, РΔV- работа расширения
3. Первый закон термодинамики для изохорного процесса (V=const):
4.Первый закон термодинамики для изобарного процесса (Р=const):
Экзотермическая реакция
. Эндотермическая реакция
5. DН0обр,298 (стандартная энтальпия образования) - это теплота реакции образования сложного вещества, например, СО2 из простых веществ карбона и кислорода (или элементов) при стандартных условиях.
. Вывод из закона Гесса
Тепловой эффект химической реакции может быть найден, как разность между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ, с учетом стехиометрических коэффициентов.
Задачи для самоконтроля!
. Запишите термохимическое уравнение реакции образования 1 моля вещества и рассчитайте тепловой эффект. К какому типу реакций (по тепловому эффекту и агрегатному состоянию веществ) относятся реакции:
а) фторида кальция из оксида кальция и фтороводорода;
б) карбоната кальция из гидроксида кальция и углекислого газа;
в) оксида углерода (II) из углекислого газа и водорода;
г) нитрата аммония из аммиака оксида азота (V) и воды;
д) хлорида магния из оксида магния и хлороводорода.
е) углекислого газа из метана (СН4) и кислорода
ж) углекислого газа из этана (С2Н6) и кислорода
з) углекислого газа из этилена (С2Н4) и кислорода
и) углекислого газа из ацетилена (С2Н2) и кислорода
. Какое количество тепла выделится или поглотится
а) при образовании 39 мг фторида кальция из оксида кальция и фтороводорода;
б) при образовании 200 г карбоната кальция из гидроксида кальция и углекислого газа;
в) при образовании 100 моль оксида углерода (II) из углекислого газа и водорода;
г) при образовании 158 кг нитрата аммония из аммиака оксида азота (V) и воды;
д) при образовании 285 г хлорида магния из оксида магния и хлороводорода.
е) при образовании 20 моль углекислого газа из метана (СН4) и кислорода
ж) при образовании 5 моль углекислого газа из этана (С2Н6) и кислорода
з) при образовании 0,1 моль углекислого газа из этилена (С2Н4) и кислорода
и) при образовании 0,05 моль углекислого газа из ацетилена (С2Н2) и кислорода


