ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.04.2024
Просмотров: 156
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
n-1.
Таким образом, расчетное выражение абсолютного значения энтропии можно представить в виде
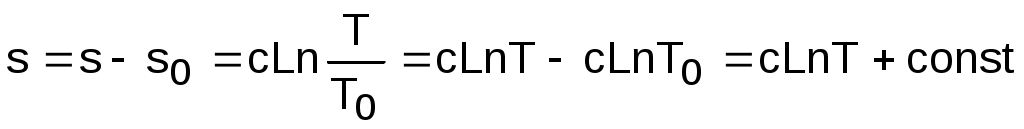 . (4.31)
. (4.31)
Выражение (4.31) соответствует логарифмической кривой. При положительной теплоемкости c>0 эта кривая в s,T- координатах изображена на рис. 4.4, а. Та же кривая в Т,s- координатах (перевернутых) показана на рис. 4.4, б. Таким образом, в Т,s- координатах политропа представляет логарифмическую кривую.
Политропа с отрицательной теплоемкостью представляет собой логарифмику в виде зеркального отражения политропы с такой же, но положительной теплоемкостью относительно оси Т (рис.4.5).
П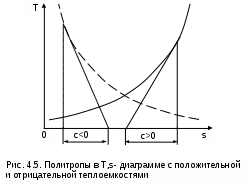
ричем, если подкасательная любой точки политропы (подкасательная в Т,s- координатах соответствует теплоемкости данной точки процесса) расположена слева от нее, то теплоемкость этой политропы положительная (c>0), если подкасательная расположена справа от точки – теплоемкость политропы отрицательная (с<0) (рис.4.5).
Численное значение теплоемкости политропы определяет ее круризну в Т,s- диаграмме. Чем больше теплоемкость, тем больше подкасательная и меньше крутизна политропы.
Х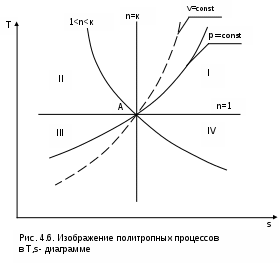
арактер основных политропных процессов в Т,s- диаграмме показан на рис.4.6.
Для наглядности сопоставления характера политропных процессов они проведены через общую точку А.
Политропы, проходящие через I и III квадранты, относительно точки А имеют положительную теплоемкость, причем изохора круче изобары, т.к. cp > cv. Самая крутая политропа – адиабата, для нее теплоемкость равна нулю. Самая пологая политропа – изотерма, для нее теплоемкость равна бесконечности.
Политропы, проходящие через II и IV квадранты, имеют отрицательную теплоемкость.
Процессы идеальных газов с одинаковыми показателями политропы в T,s- диаграмме представляют собой эквидистантные по оси s кривые (непересекающиеся, с одинаковым расстоянием друг от друга по оси s). На рис.4.7 изображены в Т,s- диаграмме две политропы идеального газа А1А2 и В1В2 с одинаковым показателем n и соответственно с одинаковыми теплоемкостями. Доказать, что эти политропы эквидистантны несложно. Достаточно рассмотреть расстояние между ними вдоль оси s по двум произвольным изотермам Т1 и Т2. Поскольку теплоемкости этих процессов одинаковые, то изменение энропии на интервале температур Т
1-Т2 в этих процессах тоже одинаковое и соответствует отрезкам
А1С1 = В1С2 = .
.
В прямоугольнике С1А2В2С2 противоположные стороны равны (А2В2=С1С2), равны и отрезки А1С1 и В1С2 (А1С1 = В1С2), следовательно, равны и отрезки А1С1 и В1С2 (А1С1 = В1С2). Расстояние между этими политропами по иси s можно рассчитать по формуле оределения изменения энтропии изотермического процесса (4.13) при любой температуре:
s2 - s1 =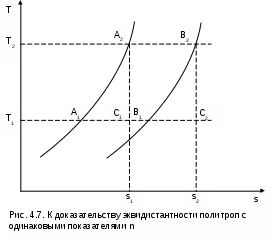
sB - sA = А1В1 = А2В2 =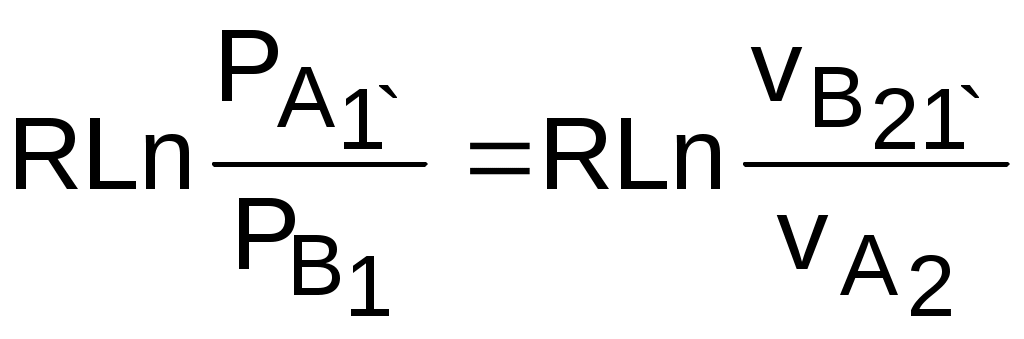 .
.
Изобары и изохоры являются частными случаями политроп, следовательно, и они представляют в Т,s- диаграмме эквидистантные по оси s кривые. В Т,s- координатах (рис.4.8) изобары находятся одна над другой по возрастающей, а изохоры одна под другой по возрастающей, т.к. если брать расстояние между ними по изотерме, оно будет равно положительной разности энтропий,
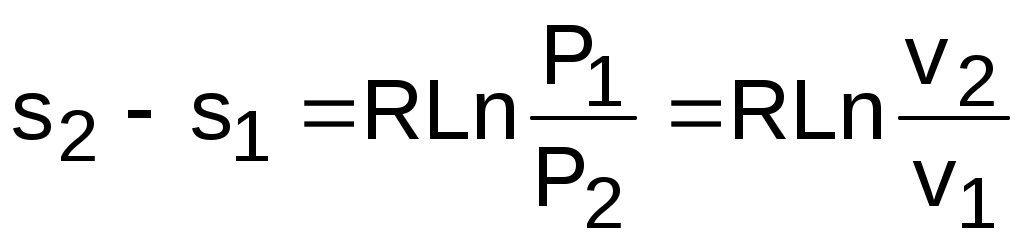 ,
,
только при Р1 > Р2 и v2 > v1.

4.4. Установление показателя политропы по опытным данным
Все, что было изложено ранее относительно политропных процессов, применимо к идеальным газам с постоянной изохорной теплоемкостью – сv. Для реальных газов изохорная теплоемкость величина переменная, следовательно, политропному процессу реального газа, отвечающему соотношению du/q==const, будет соответствовать переменная теплоемкость с=сv/. Переменная величина теплоемкости политропного процесса реального газа приводит к сложным зависимостям между термическими и энергетическими параметрами газа в таких процессах. Однако с достаточной для технических расчетов степенью точности для реальных газов можно использовать большинство полученных ранее формул для политропного процесса идеального газа [8], понимая при этом под политропным процессом реального газа процесс, удовлетворяющий уравнению
Pvn=const.
Величина показателя политропы n считается постоянной. Для уменьшения погрешности расчетов изохорную теплоемкость сv берут как среднюю cvm в интервале температур рассматриваемого процесса. Используя среднюю изохорную теплоемкость реального газа, можно приближенно рассчитать показатель политропы n. По заданной величине определяют среднее значение теплоемкости политропного процесса на данном интервале температур как сm=сvm/, и по этой теплоемкости рассчитывается показатель политропы:
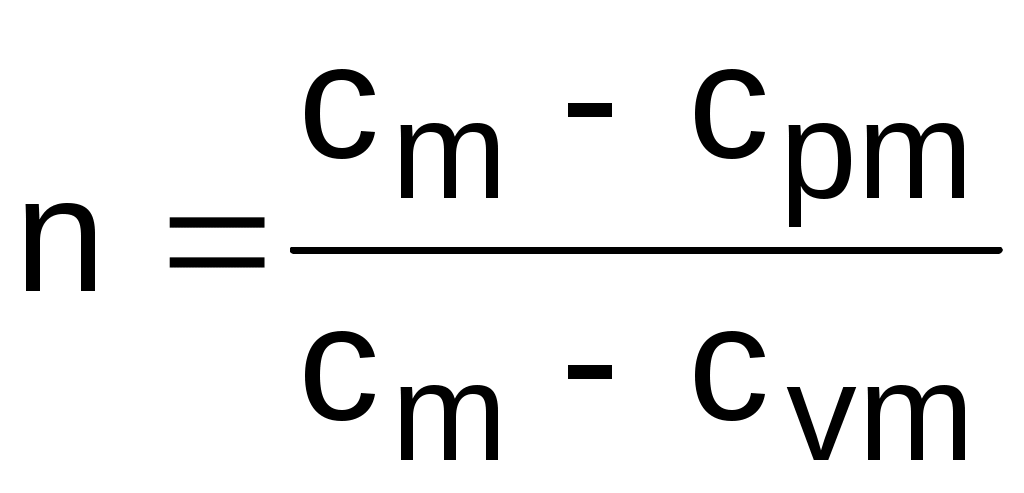 , (a)
, (a)
где срm=cvm+R.
При экспериментальном исследовании процессов изменения состояния газов получают опытные данные серии мгновенных значений термических параметров в виде графического или цифрового материала. Для проведения термодинамического анализа таких процессов необходимо установить, являются ли они политропными. В случае, если процесс соответствует политропному процессу, необходимо определить показатель политропы n. Если весь процесс не может рассматриваться как политропный, то он может быть разделен на участки, которые с достаточной степенью точности могут рассматриваться как политропные, и для каждого из этих участков определяется свое среднее значение показателя политропы n.
Рассмотрим некоторые из методов обработки и анализа опытных данных закономерных газовых процессов.
Оценить, относится газовый процесс к политропному или нет, наиболее просто, изобразив его в логарифмических координатах LnP–Lnv. Прологарифмировав уравнение политропы Pvn=const, получим уравнение
LnP + nLnv = A. (б)
В логарифмической системе координат LnP–Lnv это уравнение прямой линии. Следовательно, нанеся опытные точки процесса в данной системе координат, можно сделать вывод, относится ли данный процесс к политропному. Если все опытные точки ложатся на одну прямую (рис.4.9), то процесс подчиняется уравнению политропы Pvn=const. Если точки не ложатся на одну прямую, то это не политропный процесс. Однако в этом случае может быть проведена аппроксимация опытных точек с заменой действительного процесса политропным. Оценить пригодность такой политропы для расчетов процесса с заданной степенью точности можно по отклонению опытных точек от политропы.
Д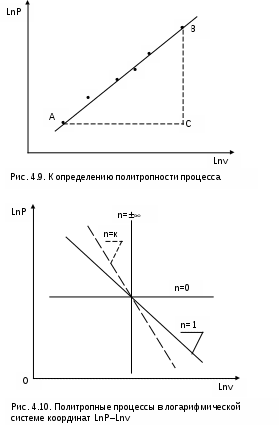
ля политропного процесса, изображенного в виде прямой в системе координат LnP–Lnv, показатель политропы легко определяется из уравнения (б) в виде углового коэффициента, который можно выразить через отношение отезков (см. рис.4.9):
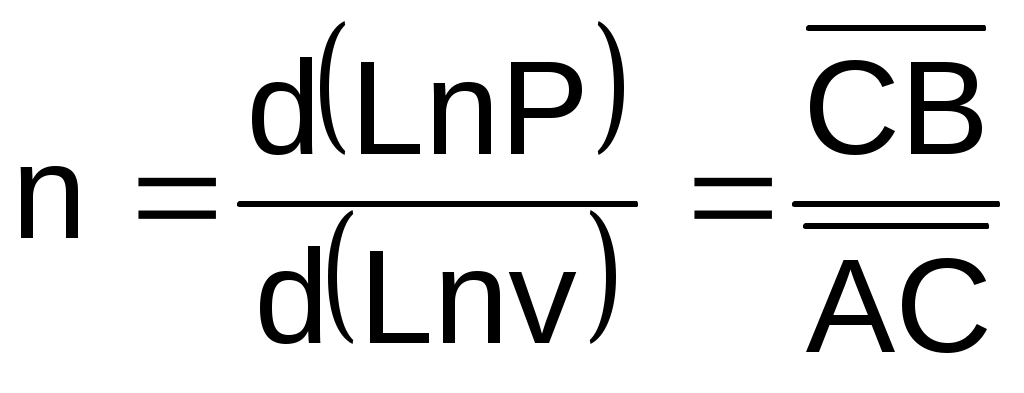 . (в)
. (в)
На рис.4.10 изображены политропные процессы в логарифмической системе координат с различными показателями политропы: n=0 – изобара, n=1 – изотерма, n=к – адиабата, n= – изохора.
Определить показатель политропы можно и по параметрам двух точек процесса. В случае если процесс соответствует политропе, для двух его точек можно записать равенство
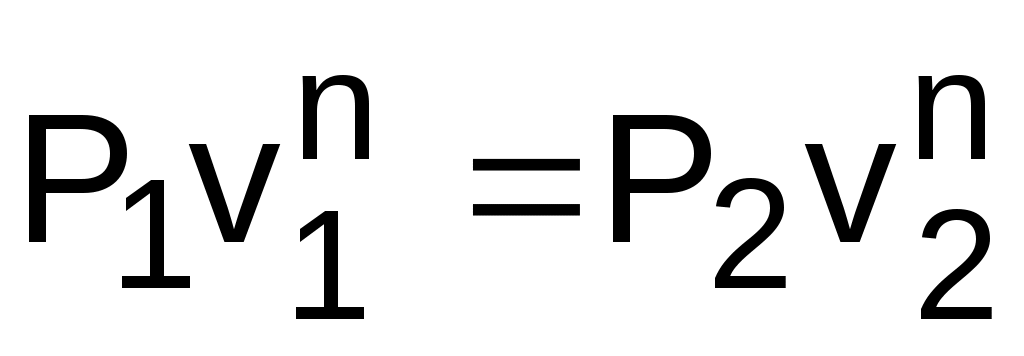 или
или 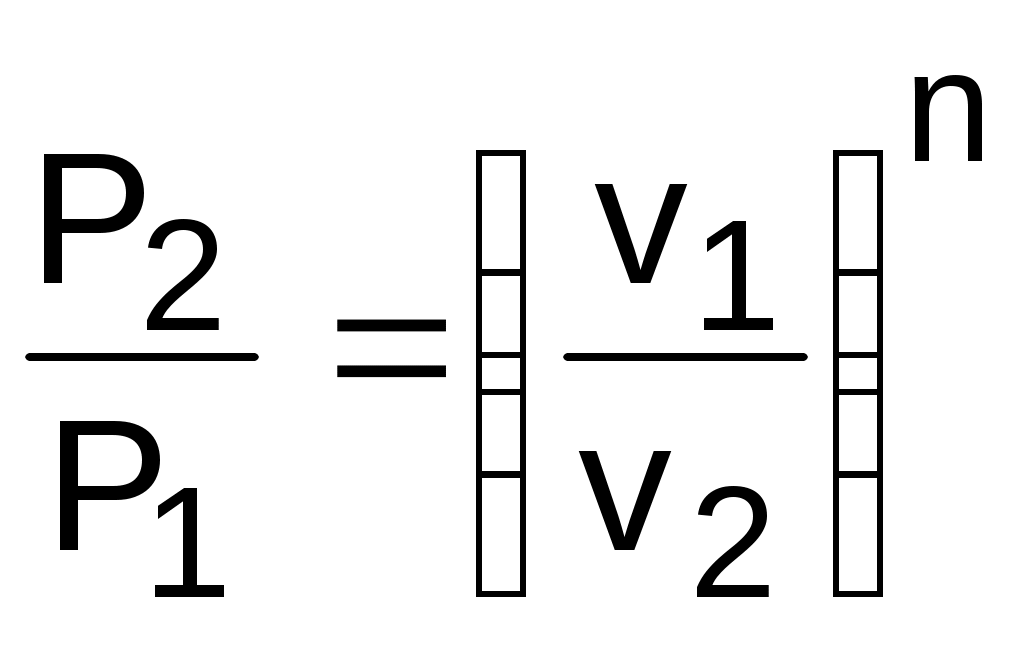 .
.
Прологарифмировав полученное равенство, получим расчетное выражение для показателя политропы:
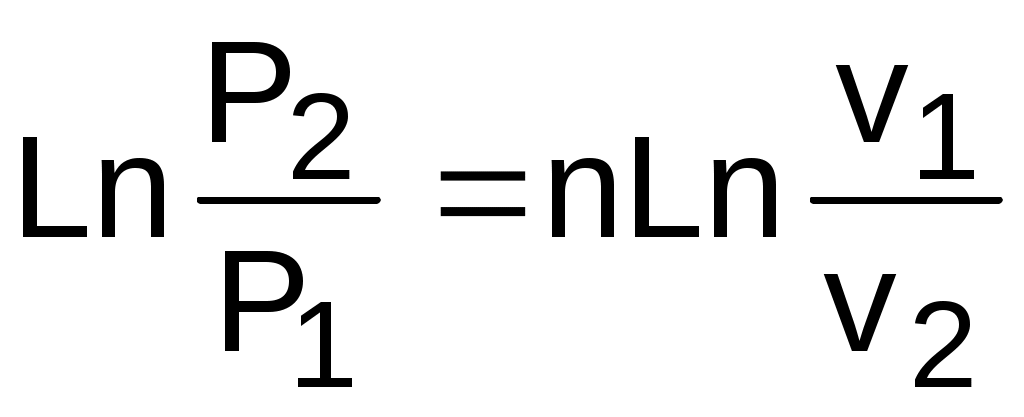 ,
, 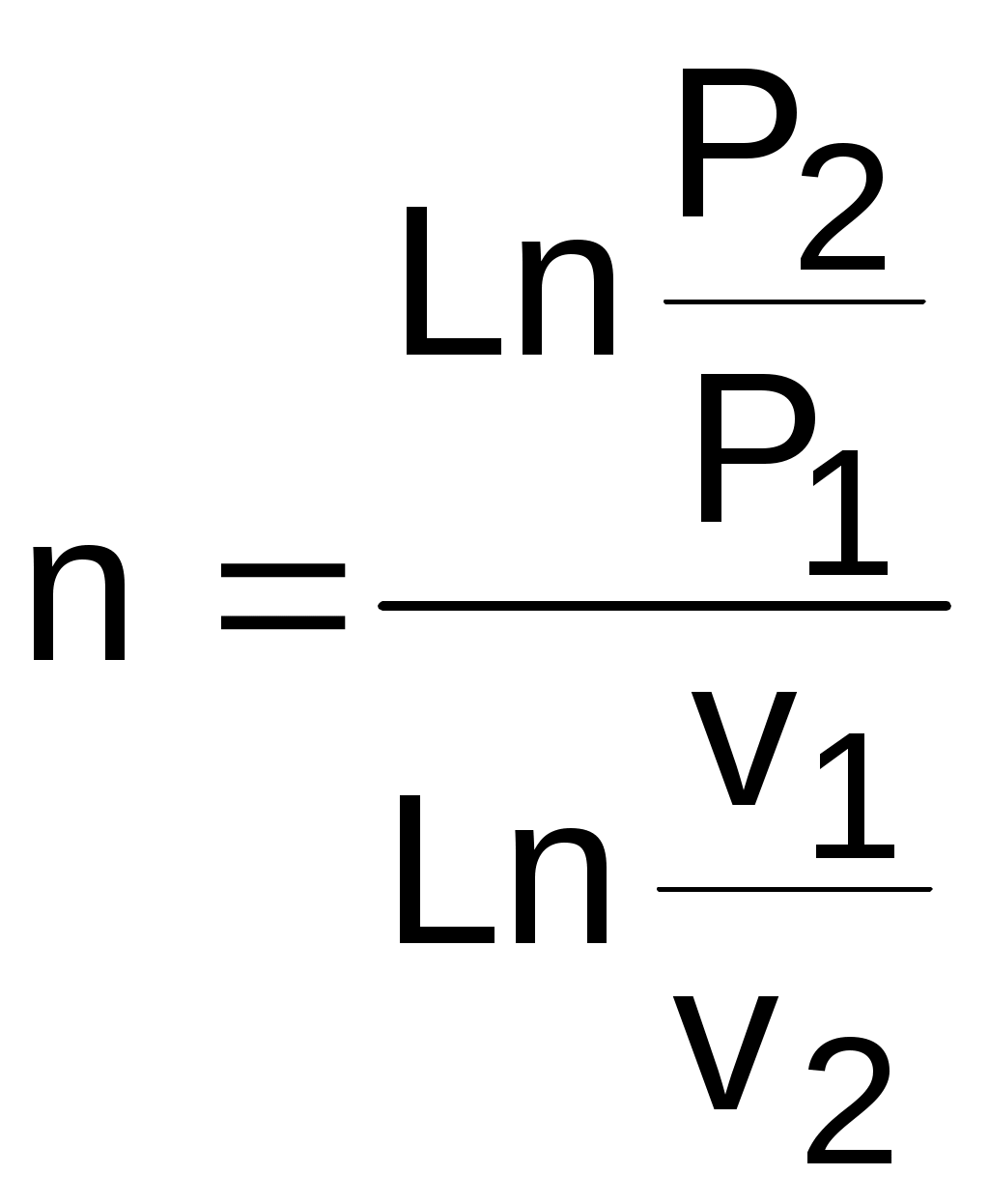 . (г)
. (г)
0>
4.5. Качественный и количественный анализ политропных
процессов в Р,v- и T,s- диаграммах
При протекании любого газового процесса происходит энергообмен газа с внешней средой и изменение его параметров. Имея изображение политропного процесса в Р,v- и T,s- диаграммах, всегда можно определить знак теплоты, работы и знак изменения параметров этого процесса, т.е. провести качественный анализ процесса. Для иллюстрации этого на рис. 4.11 и 4.12 через произвольную точку А, определяющую начало процесса в Р,v- и T,s- диаграммах, проведены основные термодинамические процессы: изобара, изохора, изотерма, адиабата.
Во всех процессах, начинающихся в точке А и располагающихся справа от изохоры (n = ), объем увеличивается (dv>0), и, следовательно, работа имеет положительный знак (l=Pdv>0). В процессах, заканчивающихся слева от изохоры, знаки dv и l отрицательные.
В процессах, располагающихся справа от адиабаты (n=к), энтропия возрастает (ds>0), и теплота имеет положительный знак (q=Tds>0), т.е. теплота к газу подводится. В процессах, заканчивающихся с левой стороны от адиабаты, знаки ds и q отрицательные.
В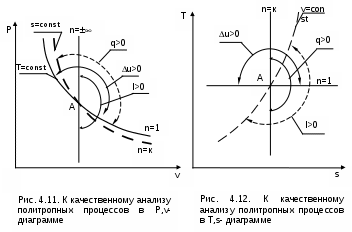
процессах, заканчивающихся выше изотермы (n=1), температура возрастает (dT>0), и увеличивается внутренняя энергия и энтальпия газа (du=cvdT>0, dh=cpdT>0). В процессах с противоположной стороны от изотермы величины dT, du и dh отрицательные.
Поскольку площадь под процессом в P,v- диаграмме есть работа изменения объема, а в T,s- диаграмме – теплота, то, имея изображение процесса в этих координатах, можно дать и количественную характеристику процесса.
Например, на рис.4.13 изображен политропный процесс идеального газа 12 в Р,v- диаграмме. Площадь под процессом 122'1'1 есть работа изменения объема l. Изменению внутренней энергии процесса 12 соответствует работа любого адиабатного процесса в пределах температур от T1 до T2, т.е.
u=u2-u1=ls=сv(T2- T1)=пл.2аа'2'2. (а)
Проведя адиабату через точку 2 и найдя точку пересечения с ней изотермы T1=const, получим процесс 2а, площадь под которым есть изменение внутренней энергии u2-u1. Сумма двух заштрихованных площадей представляет теплоту процесса
q = u2 - u1 + l = пл.12аа'1'1. (б)
Выражение первого закона термодинамики с использованием энтальпии,
Таким образом, расчетное выражение абсолютного значения энтропии можно представить в виде
Выражение (4.31) соответствует логарифмической кривой. При положительной теплоемкости c>0 эта кривая в s,T- координатах изображена на рис. 4.4, а. Та же кривая в Т,s- координатах (перевернутых) показана на рис. 4.4, б. Таким образом, в Т,s- координатах политропа представляет логарифмическую кривую.
Политропа с отрицательной теплоемкостью представляет собой логарифмику в виде зеркального отражения политропы с такой же, но положительной теплоемкостью относительно оси Т (рис.4.5).
П

ричем, если подкасательная любой точки политропы (подкасательная в Т,s- координатах соответствует теплоемкости данной точки процесса) расположена слева от нее, то теплоемкость этой политропы положительная (c>0), если подкасательная расположена справа от точки – теплоемкость политропы отрицательная (с<0) (рис.4.5).
Численное значение теплоемкости политропы определяет ее круризну в Т,s- диаграмме. Чем больше теплоемкость, тем больше подкасательная и меньше крутизна политропы.
Х

арактер основных политропных процессов в Т,s- диаграмме показан на рис.4.6.
Для наглядности сопоставления характера политропных процессов они проведены через общую точку А.
Политропы, проходящие через I и III квадранты, относительно точки А имеют положительную теплоемкость, причем изохора круче изобары, т.к. cp > cv. Самая крутая политропа – адиабата, для нее теплоемкость равна нулю. Самая пологая политропа – изотерма, для нее теплоемкость равна бесконечности.
Политропы, проходящие через II и IV квадранты, имеют отрицательную теплоемкость.
Процессы идеальных газов с одинаковыми показателями политропы в T,s- диаграмме представляют собой эквидистантные по оси s кривые (непересекающиеся, с одинаковым расстоянием друг от друга по оси s). На рис.4.7 изображены в Т,s- диаграмме две политропы идеального газа А1А2 и В1В2 с одинаковым показателем n и соответственно с одинаковыми теплоемкостями. Доказать, что эти политропы эквидистантны несложно. Достаточно рассмотреть расстояние между ними вдоль оси s по двум произвольным изотермам Т1 и Т2. Поскольку теплоемкости этих процессов одинаковые, то изменение энропии на интервале температур Т
1-Т2 в этих процессах тоже одинаковое и соответствует отрезкам
А1С1 = В1С2 =
В прямоугольнике С1А2В2С2 противоположные стороны равны (А2В2=С1С2), равны и отрезки А1С1 и В1С2 (А1С1 = В1С2), следовательно, равны и отрезки А1С1 и В1С2 (А1С1 = В1С2). Расстояние между этими политропами по иси s можно рассчитать по формуле оределения изменения энтропии изотермического процесса (4.13) при любой температуре:
s2 - s1 =

sB - sA = А1В1 = А2В2 =
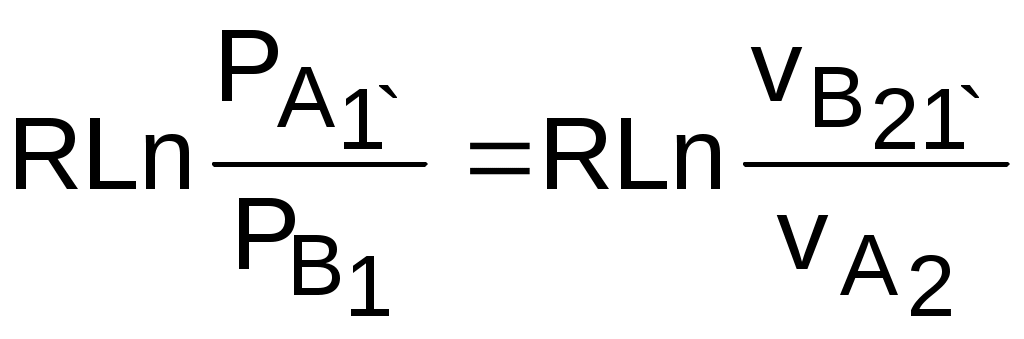 .
.Изобары и изохоры являются частными случаями политроп, следовательно, и они представляют в Т,s- диаграмме эквидистантные по оси s кривые. В Т,s- координатах (рис.4.8) изобары находятся одна над другой по возрастающей, а изохоры одна под другой по возрастающей, т.к. если брать расстояние между ними по изотерме, оно будет равно положительной разности энтропий,
только при Р1 > Р2 и v2 > v1.

4.4. Установление показателя политропы по опытным данным
Все, что было изложено ранее относительно политропных процессов, применимо к идеальным газам с постоянной изохорной теплоемкостью – сv. Для реальных газов изохорная теплоемкость величина переменная, следовательно, политропному процессу реального газа, отвечающему соотношению du/q==const, будет соответствовать переменная теплоемкость с=сv/. Переменная величина теплоемкости политропного процесса реального газа приводит к сложным зависимостям между термическими и энергетическими параметрами газа в таких процессах. Однако с достаточной для технических расчетов степенью точности для реальных газов можно использовать большинство полученных ранее формул для политропного процесса идеального газа [8], понимая при этом под политропным процессом реального газа процесс, удовлетворяющий уравнению
Pvn=const.
Величина показателя политропы n считается постоянной. Для уменьшения погрешности расчетов изохорную теплоемкость сv берут как среднюю cvm в интервале температур рассматриваемого процесса. Используя среднюю изохорную теплоемкость реального газа, можно приближенно рассчитать показатель политропы n. По заданной величине определяют среднее значение теплоемкости политропного процесса на данном интервале температур как сm=сvm/, и по этой теплоемкости рассчитывается показатель политропы:
где срm=cvm+R.
При экспериментальном исследовании процессов изменения состояния газов получают опытные данные серии мгновенных значений термических параметров в виде графического или цифрового материала. Для проведения термодинамического анализа таких процессов необходимо установить, являются ли они политропными. В случае, если процесс соответствует политропному процессу, необходимо определить показатель политропы n. Если весь процесс не может рассматриваться как политропный, то он может быть разделен на участки, которые с достаточной степенью точности могут рассматриваться как политропные, и для каждого из этих участков определяется свое среднее значение показателя политропы n.
Рассмотрим некоторые из методов обработки и анализа опытных данных закономерных газовых процессов.
Оценить, относится газовый процесс к политропному или нет, наиболее просто, изобразив его в логарифмических координатах LnP–Lnv. Прологарифмировав уравнение политропы Pvn=const, получим уравнение
LnP + nLnv = A. (б)
В логарифмической системе координат LnP–Lnv это уравнение прямой линии. Следовательно, нанеся опытные точки процесса в данной системе координат, можно сделать вывод, относится ли данный процесс к политропному. Если все опытные точки ложатся на одну прямую (рис.4.9), то процесс подчиняется уравнению политропы Pvn=const. Если точки не ложатся на одну прямую, то это не политропный процесс. Однако в этом случае может быть проведена аппроксимация опытных точек с заменой действительного процесса политропным. Оценить пригодность такой политропы для расчетов процесса с заданной степенью точности можно по отклонению опытных точек от политропы.
Д

ля политропного процесса, изображенного в виде прямой в системе координат LnP–Lnv, показатель политропы легко определяется из уравнения (б) в виде углового коэффициента, который можно выразить через отношение отезков (см. рис.4.9):
На рис.4.10 изображены политропные процессы в логарифмической системе координат с различными показателями политропы: n=0 – изобара, n=1 – изотерма, n=к – адиабата, n= – изохора.
Определить показатель политропы можно и по параметрам двух точек процесса. В случае если процесс соответствует политропе, для двух его точек можно записать равенство
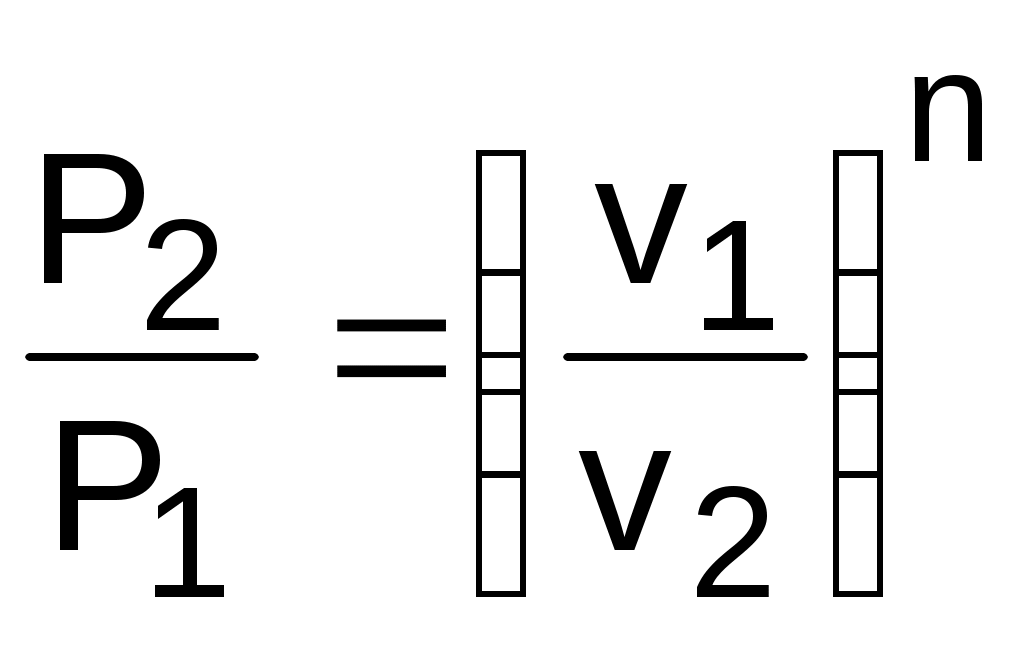 .
.Прологарифмировав полученное равенство, получим расчетное выражение для показателя политропы:
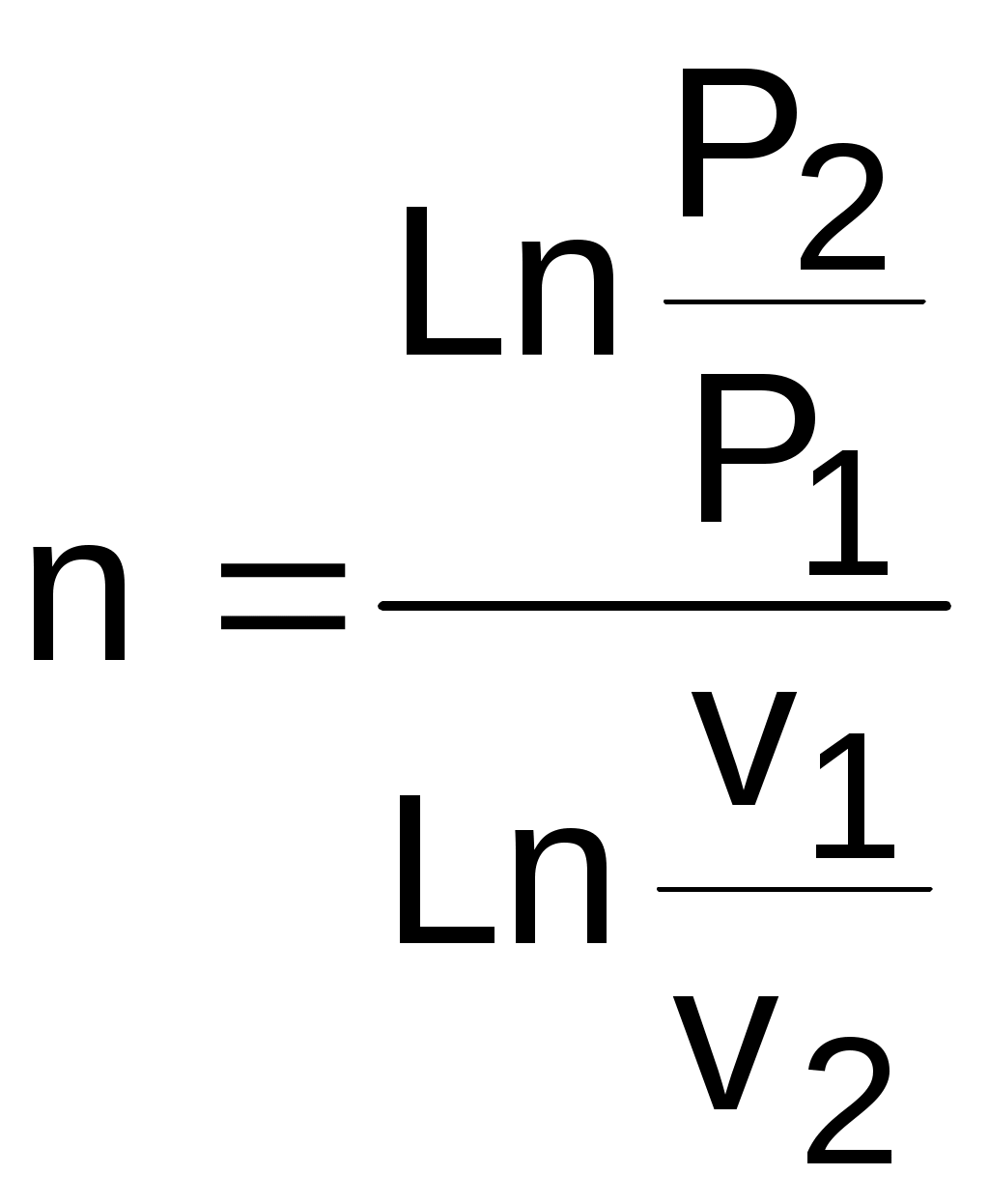 . (г)
. (г)0>
4.5. Качественный и количественный анализ политропных
процессов в Р,v- и T,s- диаграммах
При протекании любого газового процесса происходит энергообмен газа с внешней средой и изменение его параметров. Имея изображение политропного процесса в Р,v- и T,s- диаграммах, всегда можно определить знак теплоты, работы и знак изменения параметров этого процесса, т.е. провести качественный анализ процесса. Для иллюстрации этого на рис. 4.11 и 4.12 через произвольную точку А, определяющую начало процесса в Р,v- и T,s- диаграммах, проведены основные термодинамические процессы: изобара, изохора, изотерма, адиабата.
Во всех процессах, начинающихся в точке А и располагающихся справа от изохоры (n = ), объем увеличивается (dv>0), и, следовательно, работа имеет положительный знак (l=Pdv>0). В процессах, заканчивающихся слева от изохоры, знаки dv и l отрицательные.
В процессах, располагающихся справа от адиабаты (n=к), энтропия возрастает (ds>0), и теплота имеет положительный знак (q=Tds>0), т.е. теплота к газу подводится. В процессах, заканчивающихся с левой стороны от адиабаты, знаки ds и q отрицательные.
В

процессах, заканчивающихся выше изотермы (n=1), температура возрастает (dT>0), и увеличивается внутренняя энергия и энтальпия газа (du=cvdT>0, dh=cpdT>0). В процессах с противоположной стороны от изотермы величины dT, du и dh отрицательные.
Поскольку площадь под процессом в P,v- диаграмме есть работа изменения объема, а в T,s- диаграмме – теплота, то, имея изображение процесса в этих координатах, можно дать и количественную характеристику процесса.
Например, на рис.4.13 изображен политропный процесс идеального газа 12 в Р,v- диаграмме. Площадь под процессом 122'1'1 есть работа изменения объема l. Изменению внутренней энергии процесса 12 соответствует работа любого адиабатного процесса в пределах температур от T1 до T2, т.е.
u=u2-u1=ls=сv(T2- T1)=пл.2аа'2'2. (а)
Проведя адиабату через точку 2 и найдя точку пересечения с ней изотермы T1=const, получим процесс 2а, площадь под которым есть изменение внутренней энергии u2-u1. Сумма двух заштрихованных площадей представляет теплоту процесса
q = u2 - u1 + l = пл.12аа'1'1. (б)
Выражение первого закона термодинамики с использованием энтальпии,


