ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.04.2024
Просмотров: 158
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
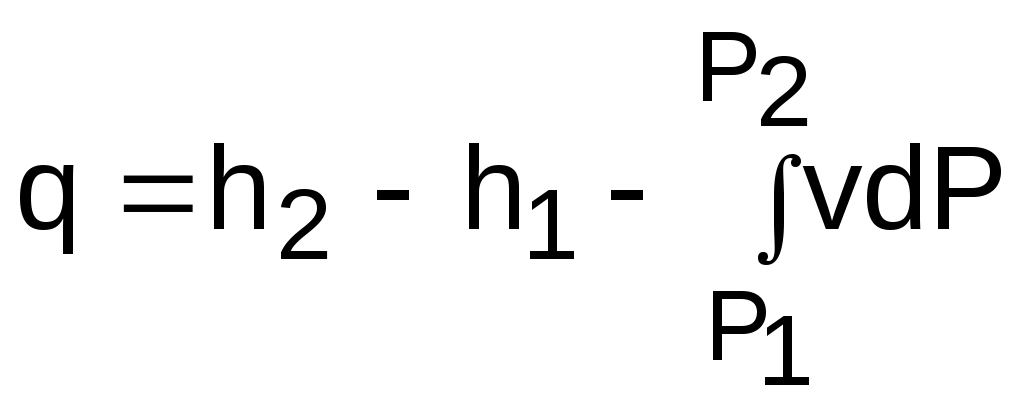 , (в)
, (в)позволяет графически представить его составляющие в Р,v- координатах.
Величине –
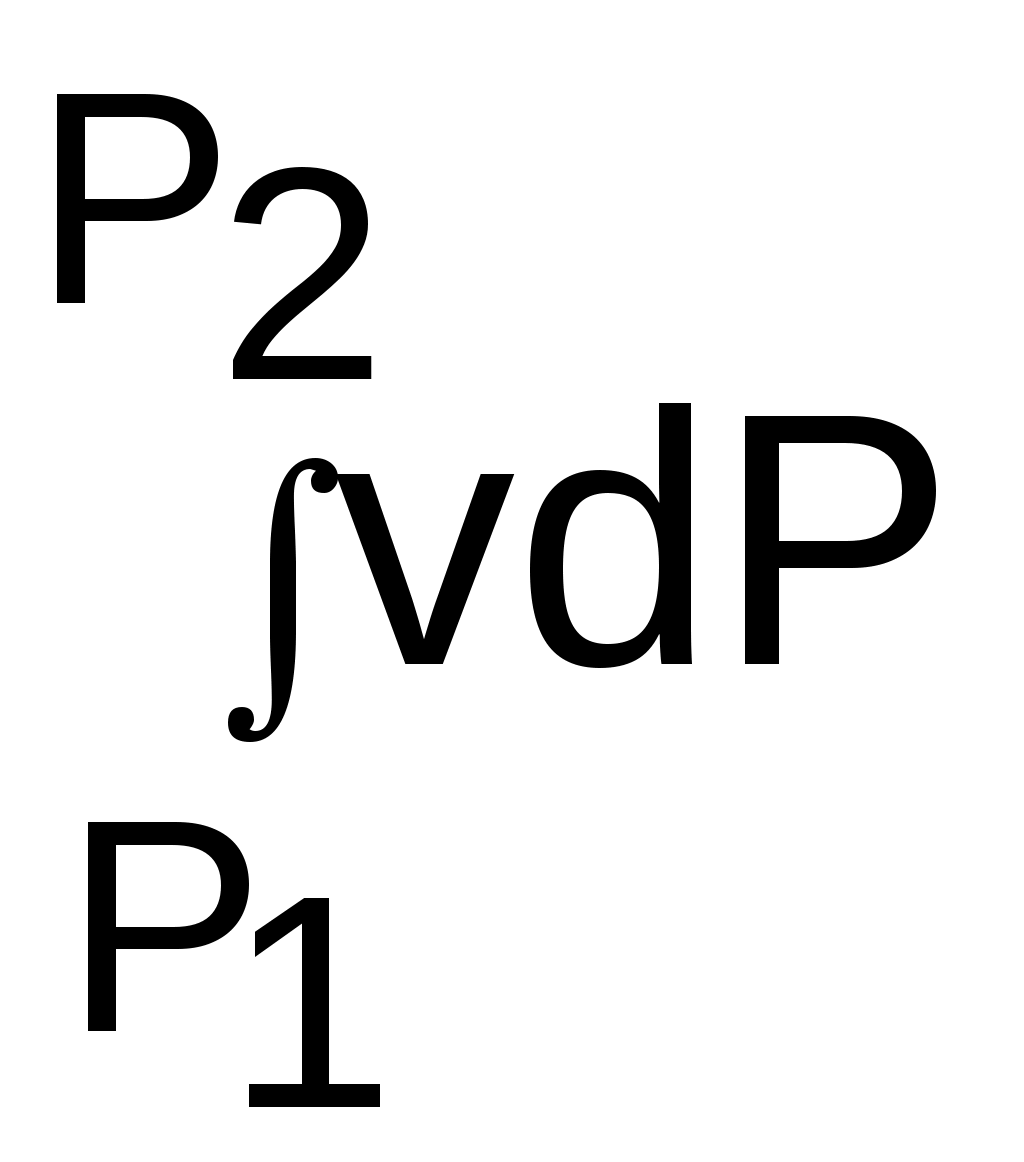 в Р,v- диаграмме соответствует площадь под процессом 12 в проекции на ось давлений 122"1"1.
в Р,v- диаграмме соответствует площадь под процессом 12 в проекции на ось давлений 122"1"1.Р
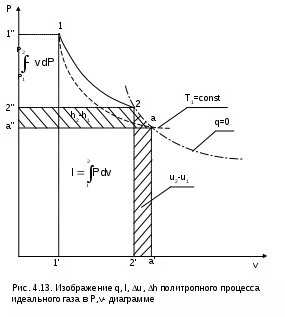
азницу энтальпий можно представить в виде площади под адиабатным процессом 2а (q = 0) в проекции на ось Р в интервале температур T1 и T2:
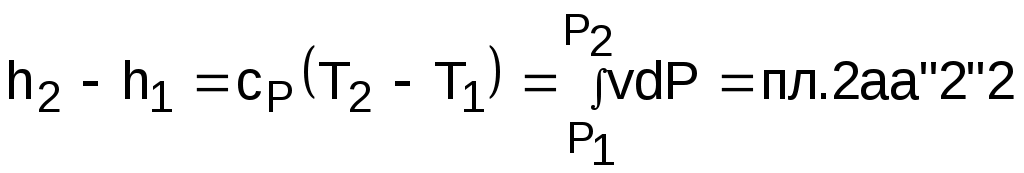 . (г)
. (г)Сумма этих площадей есть теплота процесса q = пл.12aa"1"1.
В T,s- диаграмме площадь под процессом 1-2 (рис. 4.14) представляет теплоту этого процесса q=пл.122'1'1. Эту площадь, согласно первому закону термодинамики, можно представить в виде двух частей:
изменения внутренней энергии – площадь под любой изохорой в интервале температур Т1 и Т2:
u2 - u1 = qv = cv(Т2 - Т1) = пл.22'а'а2 ; (д)
и работы изменения объема, представляющей разность теплоты и изменения внутренней энергии процесса 12:
l = q - (u2 - u1) = пл.12аа'1'1. (е)
Изменение энтальпии в процессе 12 можно представить в виде площади под любой изобарой в интервале температур Т1 и Т2:
h

2 - h1 = qp = сp(Т2 - Т1) = пл.2вв'2'2. (ж)
Таким образом, имея изображение политропного процесса газа в Р,v- или T,s- диаграмме, можно оценить величину и знак теплоты, работы изменения объема, изменения внутренней энергии, энтальпии и других термодинамических параметров состояния.
4.6. Определение термодинамических свойств идеальных газов
с учетом влияния температуры на их изобарную и изохорную
теплоемкости
Как известно[9, 12], теплоемкость реальных газов зависит от температуры и давления. Причем зависимость теплоемкости от давления проявляется в большей степени для состояний газов и паров, близких к области насыщения (см. гл. 6). Для газов и паров, состояния которых далеки от области насыщения, зависимость c
p и cv от давления незначительна и при практических расчетах ею пренебрегают. Зависимость cp и cv от температуры столь существенна, что ею при точных расчетах пренебрегать нельзя.
Изменение cp и cv при изменении температуры объясняет квантовая теория теплоемкости. В отличие от кинетической теории газов квантовая теория позволяет учесть колебательное движение атомов внутри молекул двух - и многоатомных газов. Квантовая теория теплоемкости разработана Энштейном. В соответствии с этой теорией мольная изохорная теплоемкость газа представляет следующую функциональную зависимость:
где h=6,6237710-27 эрг/с – постоянная Планка;
k = R/N = 1,38710-16 эрг/К – постоянная Больцмана;
– частота колебания атомов в молекуле;
Т – абсолютная температура.
Уравнения изохорной и изобарной теплоемкостей идеальных газов с учетом влияния температуры на их значения имеют весьма сложный вид и включают в себя ряд физических констант, которые могут быть определены только экспериментально. На базе последних достижений в физике в области определения точных значений фундаментальных физических констант по спектроскопическим данным были вычислены теплоемкости многих газов (cp и cv) в зависимости от температуры. Данные теплоемкости занимают промежуточное положение между теплоемкостями идеальных и реальных газов, поскольку они рассчитаны на базе квантовой теории теплоемкостей идеальных газов с привлечением экспериментальных данных по константам, входящим в расчетные уравнения этих теплоемкостей.
Область практического применения этих теплоемкостей ограничена. Однако для газов и их смесей, широко используемых в практике (воздух, азот, кислород, водород, окись и двуокись углерода, гелий, продукты сгорания органического топлива и т.п.) в большом диапазоне температур и давлений справедливо уравнение Pv=RT, следовательно, в расчетах процессов этих газов можно использовать значения теплоемкостей идеальных газов cp и cv, рассчитанных по квантовой теории теплоемкостей. В свою очередь, используя значения этих теплоемкостей, можно рассчитать энергетические параметры газов. Так в литературе [12] значения теплоемкостей и производных от них энергетических параметров, приведенные в таблицах, дают погрешность не более 0,5 % по сравнению с экспериментальными значениями тех же величин для давлений до 3 МПа и температур от -50 до +1500
оС. Такой диапазон изменения параметров позволяет рассчитать большинство газовых процессов, проходящих в промышленном и энергетическом оборудовании.
Определение энергетических параметров идеальных газов
с учетом влияния температуры на cp и cv
Рассчитанные по квантовой теории значения теплоемкостей идеальных газов cp и cv для различных температур позволяют аппроксимировать их зависимость от температуры в степенной полином вида
cp = a + b1t + b2t2 + ... + bntn. (4.33)
Таким образом, мы имеем функциональные зависимости cp=F1(t) и cv=F2(t). В принципе достаточно знать функциональную зависимость cp или cv от температуры, поскольку для идеальных газов cp = cv + R. На практике для удобства расчетов в справочных таблицах приводят обе теплоемкости как функции от температуры.
Зная зависимости cp и cv от температуры, можно рассчитать энергетические параметры идеальных газов u, h, s, используя уравнение состояния идеального газа и первый закон термодинамики.
В таблицах термодинамических свойств газов [8] расчет энергетических параметров совмещен с расчетом обратимого адиабатного процесса. Такое совмещение имеет определенную целесообразность, т.к. адиабатный процесс имеет широкое распространение в практике (в компрессорах, газовых турбинах, двигателях внутреннего сгорания и т.п.), кроме того, этот процесс довольно громоздкий в своей расчетной части.
Расчет других процессов идеальных газов также может осуществляться по этим таблицам, но в этом случае определение всех энергетических параметров ведется только по температурам.
Рассмотрим принцип построения таких таблиц и их использование для расчета газовых процессов.
В основу построения этих таблиц положены уравнения первого закона термодинамики для обратимого адиабатного процесса идеального газа:
δq = du + δl = cvdT + Pdv = 0;
δq = dh - vdP = cpdT - vdP = 0.
Поделив эти уравнения на уравнение состояния идеального газа Pv=RT, получим соотношения
Зафиксировав начало адиабатного процесса в виде точки с постоянными параметрами Ро
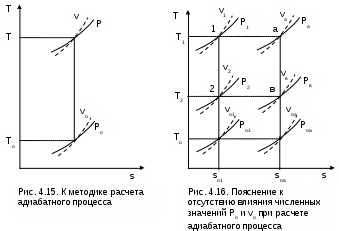
, Tо, vо, проинтегрируем эти выражения от точки на адиабатном процессе с температурой То до точки с температурой Т и соответствующими ей давлением и объемом Р и v (рис.4.15). В результате интегрирования получим выражения
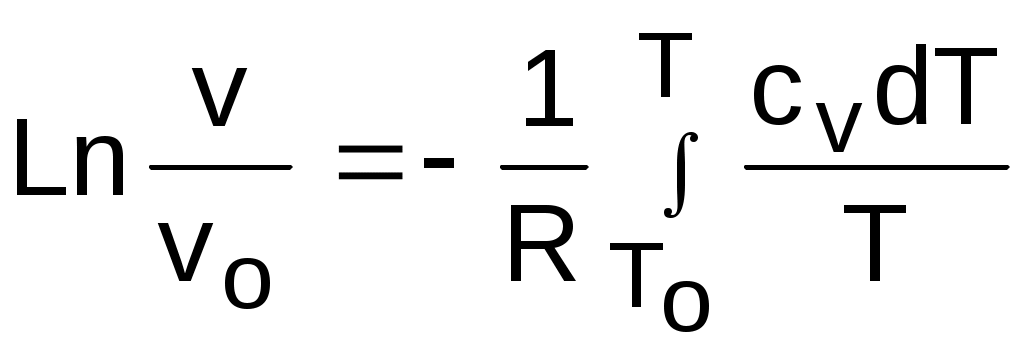 ; (4.36)
; (4.36)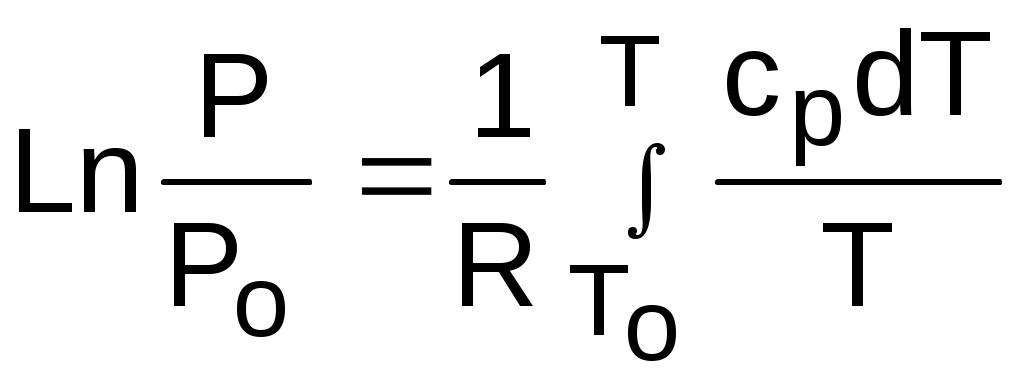 . (4.37)
. (4.37)Введем понятия относительного объема o и относительного давления o:
Для адиабатного процесса 12 (рис.4.16) с параметрами в начальной точке Р1, T1 и v1 и в конечной точке Р2, T2 и v2 относительные объемы и давления будут рассчитываться в соответствии с уравнениями (4.35) и (4.36) по формулам
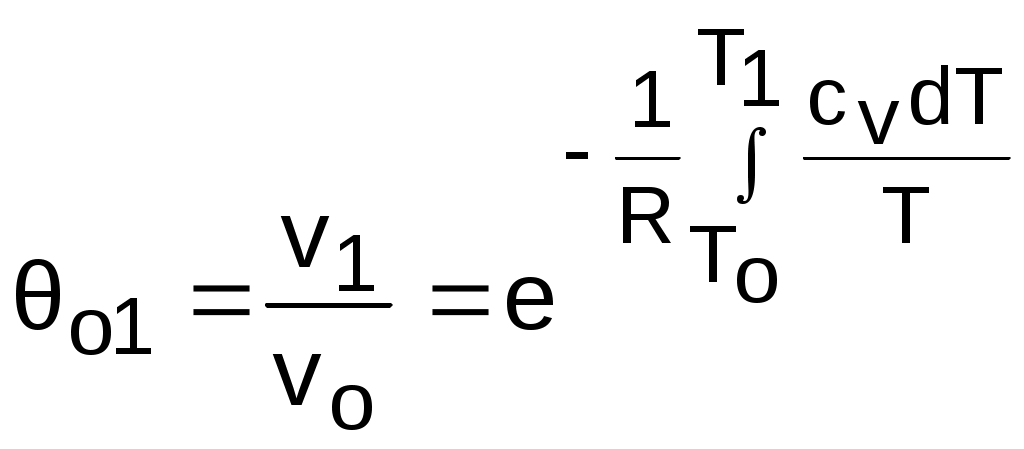 ;
; 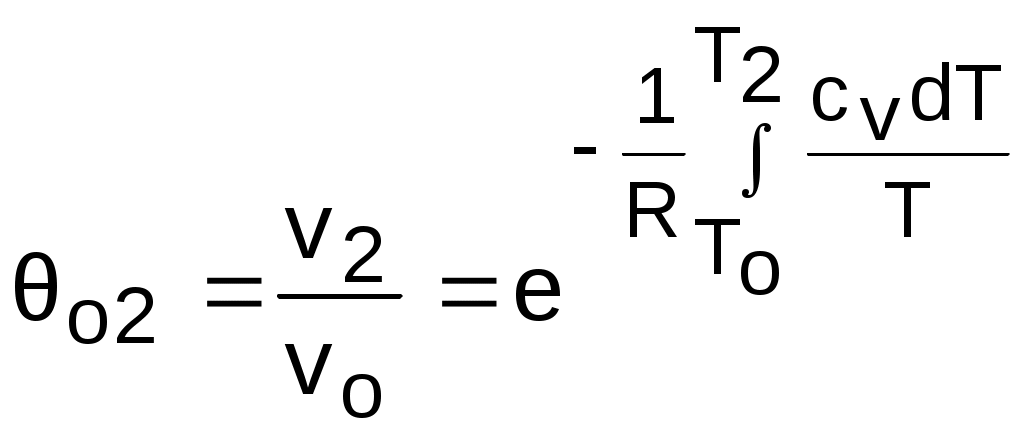 ;
;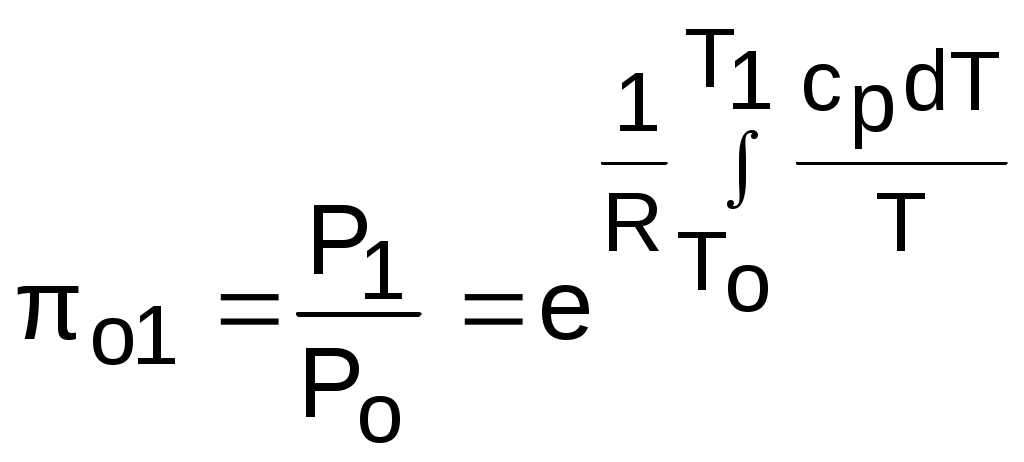
;
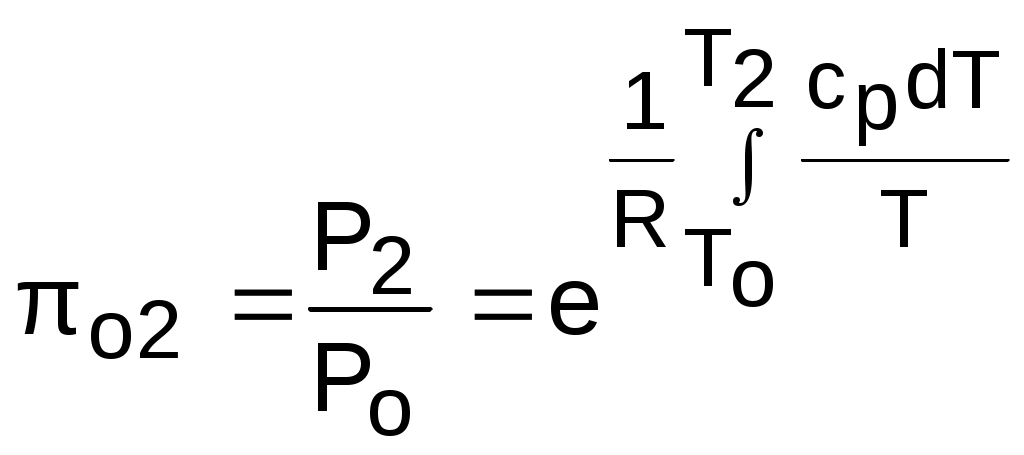 .
.Из этих формул следует, что для адиабатного процесса справедливы соотношения
Величины относительных объемов и давлений есть функции одного параметра – температуры, поскольку То мы приняли в виде постоянной величины, а сp и сv являются функциями температуры. При этом численные значения величин Рo и vо никакой роли не играют, поскольку в расчетах адиабатного процесса нас интересуют относительные давления и объемы, а они зависят только от То и Т.
Для наглядности этого утверждения на рис.4.16 показаны два адиабатных процесса, проходящих в одном и том же интервале температур Т1 – Т2. Приняв для этих адиабат одинаковую температуру То, можно записать следующие соотношения:
,
Из этих соотношений видно, что несоответствие энтропии so1 адиабатного процесса 12 с энтропией soа процесса ав, т.е. различие в численных значениях давлений и объемов в этих процессах при То, не влияет на отношение давлений и объемов в этих процессах, и если они проходят в одинаковых интервалах температур, то и отношения давлений и объемов будут одинаковы.
Это объясняется тем, что все изобары и изохоры идеальных газов в Т,s- диаграмме – эквидистантные кривые. Характер изобары в Т,s- диаграмме определяет теплоемкость сp, а изохоры – сv, и при одинаковых температурах на всех изобарах и изохорах одинаковые теплоемкости.
Таким образом, для адиабатного процесса по o1 и o1 всегда можно определить соответствующую им температуру Т1 и теплоемкости сp1 и сv1. В свою очередь, зная параметры начальной точки этого процесса и степень повышения давления р2/р1 или степень сжатия v1/v2, можно определить параметры конца процесса, найдя 02=01(p2/p1) или 02=01(v2/v1), а по ним определить температуру Т2 и рассчитать весь адиабатный процесс.
В таблицах [12] в качестве То для расчета o и o принято значение температуры абсолютного нуля. В принципе можно брать любое То, а Ро и vо вообще роли не играют (см. приведенный выше анализ).
Для определения внутренней энергии и энтальпии газов принимают начало отсчета внутренней энергии uo=0 при Тo. В качестве То в таблицах [8] принят абсолютный нуль, То=0 К. Расчет u и h ведется по формулам идеальных газов:
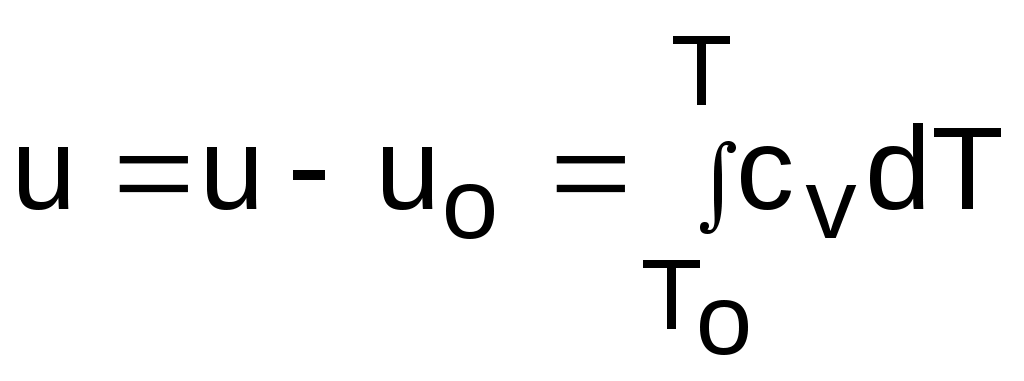 ; (4.42)
; (4.42)При этом в нашем случае начала отсчета внутренней энергии и энтальпии совпадают и равны нулю, т.к. То= 0 К. Энтальпия может быть рассчитана аналогично внутренней энергии интегрированием, при этом используется функциональная зависимость теплоемкости с


