ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.04.2024
Просмотров: 152
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Вириальные коэффициенты этого уравнения не могут быть вычислены теоретическими методами и должны определяться с помощью эксперимента. Эта задача оказывается чрезвычайно сложной, и более целесообразным является получение уравнения в виде аппроксимированной функции взаимосвязи параметров, определенных на основании экспериментальных и расчетных данных.
Следовательно, описание термодинамических свойств веществ может идти различным образом, в зависимости от подчиненности его физических свойств определенной закономерности.
В практике получили широкое распространение таблицы термодинамических свойств веществ и построенные на их базе диаграммы зависимостей параметров состояния. В этих таблицах зависимость термических параметров состояния, как правило, определяется экспериментально. На базе этих зависимостей с использованием дифференциальных уравнений термодинамики рассчитывают значения энергетических величин h, u, s и cp. Многие из этих величин могут быть получены и экспериментально, при этом можно, определив одну, рассчитать другую, например, по сp рассчитать h, s и т.д.
Для координации работы в области определения термодинамических свойств веществ и установления единых расчетных норм осуществляется международное сотрудничество.
Подробно остановимся на термодинамических свойствах воды и водяного пара. Вода и водяной пар широко используются в быту, в теплоэнергетических, теплоиспользующих и других установках. Поэтому исследованию их свойств уделяется особое внимание. Однако вода является рядовым веществом, и принципиально все, что относится к воде во всех ее фазовых состояниях, может быть распространено на другие вещества. Для других веществ отличными от воды являются численные значения их теплофизических величин, и, кроме того, вода имеет некоторые аномальные свойства, на которые будет особо указываться.
6. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ВОДЫ И ВОДЯНОГО ПАРА
6.1. Фазовые состояния и превращения воды
Сначала договоримся, что под термином "вода" будем понимать Н2О в любом из возможных ее фазовых состояний.
В природе вода может быть в трех состояниях: твердой фазе (лед, снег), жидкой фазе (вода), газообразной фазе (пар).
Рассмотрим воду без энергетического взаимодействия с окружающей средой, т.е. в равновесном состоянии.
У поверхности льда или жидкости всегда присутствует пар. Соприкасающиеся фазы находятся в термодинамическом равновесии: быстрые молекулы вылетают из жидкой фазы, преодолевая поверхностные силы, а из паровой фазы медленные молекулы переходят в жидкую фазу.
В состоянии равновесия каждой температуре соответствует определенное давление пара – полное (если над жидкостью присутствует только пар) или парциальное (если присутствует смесь пара с воздухом или другими газами). Пар, находящийся в равновесном состоянии с жидкой фазой, из которой он образовался, называется насыщенным паром, а соответствующая ему температура называется температурой насыщения, а давление – давлением насыщения.
Теперь рассмотрим неравновесные состояния воды:
а) Пусть понижается давление пара над жидкостью ниже давления насыщения. В этом случае нарушается равновесие, происходит некомпенсированный переход вещества из жидкой фазы в газообразную через поверхность раздела фаз за счет наиболее быстрых молекул.
Процесс некомпенсированного перехода вещества из жидкой фазы в газообразную называется испарением.
Процесс некомпенсированного перехода вещества из твердой фазы в газовую называется сублимацией или возгонкой.
Интенсивность испарения или сублимации возрастает при интенсивном отводе образующегося пара. При этом понижается температура жидкой фазы за счет вылета из нее молекул с наибольшей энергией. Этого можно добиться и без понижения давления, просто обдувом потока воздуха.
б) Пусть идет подвод теплоты к жидкости, находящейся в открытом сосуде. При этом температура, а соответственно и давление насыщенного пара над жидкостью растет и может достигнуть полного внешнего давления (Р=Рн). В случае, когда Р=Рн, у поверхности нагрева температура жидкости поднимается выше температуры насыщенного пара при господствующем здесь давлении, т.е. создаются условия образования пара в толще жидкости.
Процесс перехода вещества из жидкой фазы в паровую непосредственно внутри жидкости называется кипением.
Процесс зарождения пузырьков пара в толще жидкости сложен. Для кипения воды необходимо наличие центров парообразования на поверхности подвода теплоты – углубления, выступы, неровности и т.п. У поверхности нагрева, при кипении, разность температур воды и насыщенного пара при господствующем здесь давлении зависит от интенсивности подвода теплоты и может достигать десятков градусов.
Действие сил поверхностного натяжения жидкости обусловливает перегрев жидкости на поверхности раздела фаз при ее кипении на 0,3-1,5 оС по отношению к температуре насыщенного пара над ней.
Любой процесс перехода вещества из жидкой фазы в паровую называется парообразованием.
Процесс, противоположный парообразованию, т.е. некомпенсированный переход вещества из паровой фазы в жидкую, называется конденсацией.
При постоянном давлении пара конденсация происходит (как и кипение) при постоянной температуре и является результатом отвода теплоты от системы.
Процесс, противоположный сублимации, т.е. переход вещества из паровой фазы непосредственно в твердую, называется десублимацией.
Напомним, что введенные ранее понятия насыщенного пара и температуры насыщения, перенесенные на процесс кипения, объясняют равенство температур пара и жидкости при кипении. В этом случае и давление, и температура жидкой и паровой фаз одинаковы.
Жидкая фаза воды при температуре кипения называется насыщенной жидкостью.
Пар при температуре кипения (насыщения) называется сухим насыщенным паром.
Двухфазная смесь "жидкость+пар" в состоянии насыщения называется влажным насыщенным паром.
В термодинамике этот термин распространяется на двухфазные системы, в которых насыщенный пар может находиться над уровнем жидкости или представлять смесь пара с взвешенными в нем капельками жидкости.Для характеристики влажного насыщенного пара используется понятие степени сухости х, представляющее собой отношение массы сухого насыщенного пара,mс.н.п, к общей массе смеси,mсм = mс.н.п+ mж.с.н, его с жидкостью в состоянии насыщения:
Отношение массы жидкой фазы воды в состоянии насыщения к массе смеси называется степенью влажности (1-х):
Подвод теплоты к влажному насыщенному пару при постоянном давлении приводит к переходу жидкой фазы смеси в паровую. При этом температура смеси (насыщения) не может быть повышена до тех пор, пока вся жидкость не будет превращена в пар. Дальнейший подвод теплоты только к паровой фазе в состоянии насыщения приводит к повышению температуры пара.
Пар с температурой выше температуры насыщения при данном давлении называется перегретым паром. Разность температур перегретого пара t и насыщенного пара того же давления tн называется степенью перегрева пара tп = t -tн.
С увеличением степени перегрева пара его объем растет, концентрация молекул уменьшается, по своим свойствам он приближается к газам.
0>
6.2. Фазовые диаграммы Р,t-, Р,v- и T,s для Н2О
Для анализа различных термодинамических процессов изменения состояния H2O широкое применение находят фазовые диаграммы.
Для знакомства с фазовыми диаграммами Р,t- и Р,v представим, что в цилиндре под поршнем, создающим постоянное давление (рис.6.1), находится лед при начальной температуре t1. Через стенки цилиндра подводится теплота Q, процесс нагрева и фазовых переходов H2О показан в t,Q- диаграмме. Лед нагревается до температуры плавления tпл (процесс 1а), после чего лед плавится при постоянной температуре и превращается в воду (аа'), далее вода нагревается до температуры кипения (насыщения) tн (a'в), затем идет процесс испарения и превращения воды в сухой насыщенный пар (вв'), далее идет процесс перегрева пара (в'2) до температуры t2.
Т
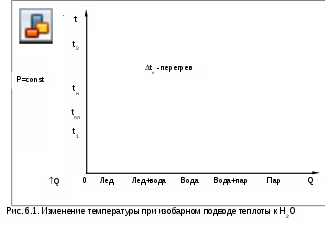
от же процесс (12) получения перегретого пара из льда при постоянном давлении представлен на рис.6.2 в системе координат Р,t. Так как процессы плавления (aa') и парообразования (вв') протекают при постоянной температуре, на рис. 6.2 они концентрируются в точки а и в. В Р,t- диаграмме эти точки характеризуют термодинамическое равновесие двухфазных смесей. Геометрически место этих точек при различных давлениях и соответствующих им температурах представляет собой линии фазовых переходов.
Линия АВ – линия фазового перехода твердой и жидкой фаз. Это аномальная линия, т.к. для большинства веществ с ростом давления растет и температура плавления, для воды наоборот.
Л
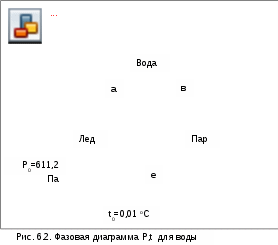
иния АК – линия фазового перехода жидкой и паровой фаз, с повышением давления растет и температура кипения (насыщения) воды и пара.
С понижением давления разность температур плавления и насыщения уменьшается, и в точке А указанные кривые сходятся .Эта точка А называется тройной точкой воды; ее координаты определяют физические условия (Ро и tо), при которых все три фазы вещества находятся в термодинамическом равновесии и могут существовать одновременно. Параметры тройной точки воды:tо=0,01 оС или 273,16 К и Ро=611,2 Па.
Кривая АС, расположенная ниже тройной точки, – линия фазового перехода и равновесия твердой и паровой фаз, т.е. линия сублимации и десублимации. Так, при давлении, соответствующем процессу de, при нагреве твердой фазы (de) в точке с происходит переход твердой фазы в пар – сублимация, при охлаждении (процесс еd) в точке c происходит переход пара в твердую фазу – десублимация. В обоих случаях переход минует жидкую фазу.


