ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.04.2024
Просмотров: 154
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
В отличие от газа и жидкости твердое кристаллическое вещество является анизотропным. Переход кристаллического вещества в жидкость без видимого фазового перехода не удается получить при любых доступных для воспроизведения давлениях. Для некоторых веществ, изоэнтропных, некристаллических в твердом состоянии: стекла, парафина, гудрона и т.п., – допустим переход из твердой фазы в жидкую и наоборот, без видимого скачка свойств. Эти вещества иногда называются твердыми жидкостями. Для них возможно сразу перейти из жидкой фазы в твердую, и наоборот.
Важнейшими термодинамическими характеристиками вещества являются параметрыего критического состояния:Ркр, Tкр, vкр. Они неодинаковы для различных веществ и выражают в обобщенной количественной форме эффект действия молекулярных сил. На критической изотерме, проходящей через точку К, горизонтальный участок имеет нулевую длину, т.е. здесь нет разницы плотностей жидкой и газовой фаз. Превращение жидкости в пар при Р<Ркр требует затраты теплоты парообразования. В критической точке при Ркр теплота парообразования нулевая, ее нет.
Критическая точка для критической изотермы в Р,v- координатах является точкой перегиба, в этой точке касательная к изотерме представляет собой горизонталь, и, следовательно, для критической точки
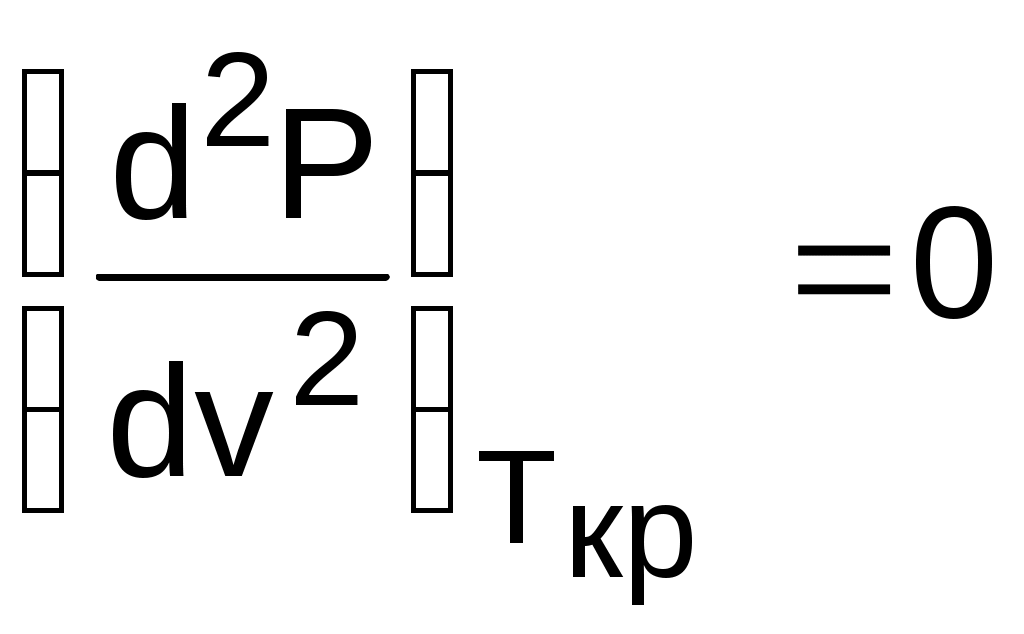 .
.Сверхкритические изотермы (Т>Ткр) в Р,v- диаграмме не имеют горизонтальной касательной, для них всегда (dР/dv)T<0. Для изотерм, близких к критической, характерно наличие перегиба, постепенно исчезающего с повышением температуры.
Для некоторых веществ критические параметры приведены в табл. 5.1.
Таблица 5.1 Критические параметры некоторых веществ
Вещество | tкр, оС | Ркр, МПа | Вещество | tкр, оС | Ркр, МПа |
| Гелий Водород Азот Кислород | -268 -240 -147 -118,4 | 0,225 1,25 3,28 4,87 | Углекислота Вода Натрий Углерод Ртуть | 31 374,12 1837 6027 1490 | 7,38 22,12 35,0 700,0 1510 |
Из табл. 5.1 видно, почему СО2 выбрана Эндрюсом для опытов. Критические параметры СО2 невелики, поэтому их было просто технически получить в то время.
Проведенные Эндрюсом опыты показали непрерывность свойств газообразной и жидкой фаз реальных веществ и их отличие от идеальных газов. Для анализа этих различий наравне с Р,v- диаграммой широко используется Рv,Р- диаграмма. В этой диаграмме изотермы идеальных газов в соответствии с уравнениями Рv=const и Рv=RT представляют собой горизонтальные прямые.
Рассмотрим различие в свойствах реальных веществ и идеальных газов на примере анализа их изотерм в Р,v- и Рv,Р- диаграммах (рис.5.4, 5.5). Свойства веществ в этих диаграммах наглядно иллюстрируются изменением их сжимаемости для изотермических процессов. Сжимаемость при T=const – это -(dv/dР)Т, т.е. изменение удельного объема при изменении давления, взятая с обратным знаком. Эта величина, отличающая свойства идеальных газов от реальных веществ, также характеризует действие сил межмолекулярного взаимодействия. Так как в Р,v- диаграмме сжимаемость представляет собой тангенс угла наклона между касательной к изотерме и обратным направлением оси давлений Р, то для изотермы идеальных газов в точке а она будет равна tg, а для изотермы реальных веществ, проходящей через ту же точку, сжимаемость будет равна tg. С увеличением давления сжимаемость обоих веществ будет уменьшаться. Однако для идеального газа она уменьшается в соответствии с закономерностью уравнения изотермы Рv=const. Сжимаемость реального вещества с ростом Р тоже уменьшается, но на разных участках изотермы (ами мв) отличается от сжимаемости идеального
газа, причем отличие может быть как в сторону увеличения, так и в сторону уменьшения. В точке а tg > tg, т.е. сжимаемость реального вещества больше, чем идеального газа. В точке в, наоборот, сжимаемость идеального газа больше, чем реального вещества. В точке М, где изотерма идеального газа касательна к изотерме реального вещества, их сжимаемости одинаковы.
Оценить изменение сжимаемости реального вещества по отношению к сжимаемости идеального газа, а следовательно, и отличие свойств реальных веществ от свойств идеальных газов позволяет изображение их изотерм в Рv,Р- диаграмме рис. 5.5. В этой диаграмме изотермы идеального газа – прямые горизонтальные линии. Рассмотрев соответствующие изотермы из Р,v- диаграммы ав, аМви идеальную изотерму, проходящую через точку М, видим, что в случае (d(Рv)/dР)T<0 линия аМ – область низких давлений, сжимаемость реальных газов больше, чем у идеальных; при (d(Рv)/dР)T>0 линия Мв – область больших давлений, здесь сжимаемость реальных газов меньше, чем у идеальных. В точке М линия Рv касательна к изотерме реальных газов, т.е. при (d(Рv)/dР)T=0 их сжимаемости одинаковы.
Величина изменения сжимаемости реального вещества по отношению к идеальному газу, обусловленная наличием сил межмолекулярного взаимодействия, характеризуется величиной (d(Рv)/dР)T. Это очень удобное выражение, т.к. оно оценивает подчиненность свойств реальных веществ уравнению состояния идеальных газов. (В разделе "Дросселирование газов и паров" [2] оценка изменения сжимаемости также ведется по (d(Рv)/dР)h). Так при (d(Рv)/dР)T=0 реальный газ не только имеет одинаковую с идеальным сжимаемость, но и может быть описан уравнением Менделеева – Клапейрона. На рис. 5.5 изотермы реального газа, имеющие минимум, соответствующий равенству (d(Рv)/dР)T=0, дают кривую КМВ, называемую кривой Бойля. Здесь К – критическая точка, а В называется точкой Бойля, ТВ – температура Бойля, эта изотерма совпадает своим минимумом с осью давлений. Для многих веществ выполняется равенство
Участок изотермы ТВ=const в области низких давлений близок к горизонтали. При Т=ТВ реальный газ подчиняется законам идеальных газов, то же наблюдается и вблизи точки Бойля.
Изотермы, соответствующие температурам выше Т
В, не имеют минимума в системе координат Рv,Р, для них всегда (d(Рv)/dР)T>0, т.е. реальный газ имеет меньшую сжимаемость, чем идеальный.

Кривая Бойля КМВ совместно с кривой кипящей жидкости КО делят всю площадь диаграммы Рv,Р на две области:
слева от них (d(Рv)/dР)T<0, т.е. сжимаемость реального вещества больше, чем идеального газа,
справа (d(Рv)/dР)T>0, т.е. сжимаемость реального газа меньше, чем идеального.
В области двухфазного состояния OKNО (d(Рv)/dР)T=-, т.е. Рv представляют вертикальные прямые, идущие вверх от линии кипящей жидкости КО до линии КN, где вся жидкая фаза перешла в пар. В этой области, как и в Р,v- диаграмме, изотермы совпадают с изобарами. На изотерме-изобаре в двухфазном состоянии сжимаемость газа и жидкой фазы не изменяется, изменяется только их количество в смеси. Линии ОК соответствует сжимаемость жидкости в состоянии кипения, а линии КN – газа (пара) при той же температуре.
5.2. Уравнения состояния реальных газов.
Энергетические свойства реальных газов
Получение уравнения состояния реального газа, достаточно точно описывающего его термодинамические свойства, очень важная задача. Термические уравнения состояния используются не только для расчета термических параметров и их изменений, но и для определения энергетических (калорических) величин (u, h, s, cp, cv и т.п.) с помощью дифференциальных уравнений термодинамики.
Одним из первых попытку получить уравнение состояния, описывающее свойства вещества в газообразном и жидком видах, предпринял в 1887 году голландский ученый Ван-дер-Ваальс [10]. Основываясь на логических рассуждениях, он составил уравнение
где a и b – постоянные величины, так же как и R, характеризующие индивидуальные свойства вещества.
Уравнение Ван-дер-Ваальса отличается от уравнения Клапейрона тем, что вместо давления Р в нем фигурирует сумма (Р + a/v2), а вместо объема v стоит разность (v - b).
Ван-дер-Ваальс на основании простейших молекулярно-кинетических соображений показал, что силы взаимного притяжения молекул обратно пропорциональны квадрату удельного объема v, следовательно, слагаемым a/v2 учитывается взаимодействие молекул газа. Из физики известно, что силы взаимного притяжения молекул приводят к появлению внутреннего давления в газах и жидкостях, следовательно, величину a/v
2 можно рассматривать как внутреннее давление газа.
Согласно уравнению Клапейрона для изотермического процесса при Р v0. Из уравнения Ван-дер-Ваальса следует, что при давлении Р удельный объем vb, следовательно, величину b можно рассматривать как объем, занимаемый собственно молекулами.
В

еличины a и b могут определяться экспериментально, но можно их и рассчитать. По расчетам получается, что они зависят от параметров критической точки газа, поэтому газ, подчиняющийся уравнению (5.1), называют ван-дер-ваальсовским газом. Изотермы Ван-дер-Ваальса в Р,v- диаграмме изображены на рис. 5.6. Сверхкритические изотермы качественно соответствуют изотермам реального газа. Докритические изотермы вместо горизонтального участка, характеризующего фазовый переход жидкость-пар, имеют волнообразный участок.
Как показывают расчеты, попытки применения этого уравнения для описания областей, где вещество обладает резко выраженными свойствами реального газа (вблизи линии насыщения и околокритическая область), и тем более области жидкости, приводят к большим отклонениям от реальных значений параметров веществ. Поэтому практическое применение уравнение Ван-дер-Ваальса может найти только в ограниченной области состояний реальных газов [1, 2]. Ценность этого уравнения заключается в возможности качественной оценки и наглядной иллюстрации влияния простейших признаков реального газа на его термодинамические свойства.
В целях усовершенствования уравнения Ван-дер-Ваальса в него вводились поправки. В результате учеными был получен ряд новых уравнений состояния реальных газов. Некоторые из них довольно точно описывали экспериментальные данные и были использованы для составления таблиц термодинамических свойств ряда веществ.
Значительный шаг в направлении создания уравнения состояния реального газа был сделан американским физиком Дж. Майером и советским математиком Н.Н.Боголюбовым в 1937–48 гг. [10]. Независимо друг от друга они методом статистической физики показали, что в наиболее общем виде уравнение реального газа выглядит следующим образом:
где bk – вириальные коэффициенты, являющиеся функцией только температуры.


