ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.04.2024
Просмотров: 136
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Для обратимого процесса, используя первый закон термодинамики, изменение энтропии можно записать в виде выражения
Для необратимого термодинамического процесса часть работы расширения за счет трения преобразуется в теплоту трения и усваивается телом. Поскольку в данном процессе будет присутствовать внешний и внутренний (за счет трения) подвод теплоты к телу, то и изменение энтропии (а следовательно, и изменение термодинамического состояния тела) будет определяться как внешней теплотой, так и теплотой трения. Для необратимого термодинамического процесса изменение энтропии тела можно представить в виде выражения
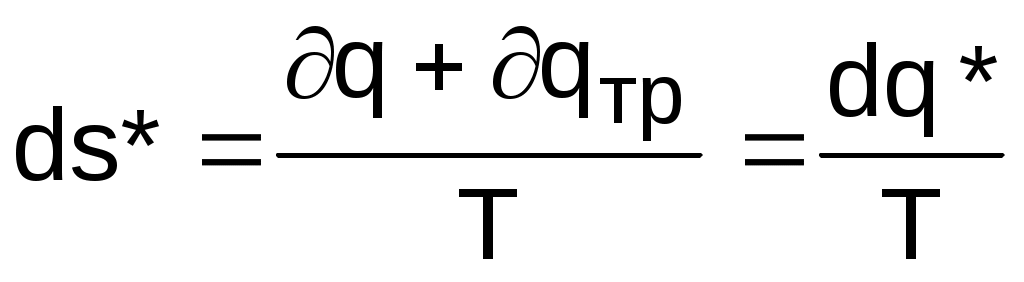 , (8.16)
, (8.16)где q = du + Pdv - lтр = du + Pdv - qтр – количество теплоты, полученное телом извне (внешняя теплота);
qтр = lтр – количество теплоты, полученное телом за счет потерь работы расширения на трение (теплота трения);
q* = q + qтр = du + Pdv – полное количество теплоты, полученное телом (это выражение первого закона термодинамики для необратимого процесса).
Поскольку в реальном необратимом процессе теплота трения всегда величина положительная (qтр>0), то для необратимого процесса справедливо соотношение
Для обратимого процесса теплота трения отсутствует, что приводит к соотношению вида
Выражения (8.17) и (8.18) можно рассматривать как аналитические выражения второго закона термодинамики для термодинамического тела.
И
спользуя эти выражения, можно дать следующую формулировку второго закона термодинамики для тела – необратимость термодинамического процесса для тела приводит к увеличению изменения энтропии необратимого процесса по сравнению с изменением энтропии аналогичного обратимого процесса, при том же количестве подведенной внешней теплоты.
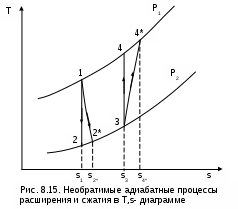
Такое увеличение энтропии тела для необратимого процесса, по сравнению с аналогичным обратимым, наглядно демонстрируется на примере адиабатных процессов (рис. 8.15). Адиабатные процессы широко используются в технике – процессы расширения газа или пара в турбине, сжатия воды в насосе или газа в компрессоре. Для обратимых процессов q=0 и ds=0, т.е. обратимая адиабата является изоэнтропой (процессы 12 и 34). В реальных адиабатных процессах всегда происходит увеличение энтропии, обусловленное наличием трения. Так, для необратимых адиабатных процессов 12* и 34* возрастание энтропии на величину s
2*-s2 и s4*-s3 соответственно, обусловлено только теплотой трения этих процессов.
В связи с тем, что выражение q* = Tds* отражает второй закон термодинамики, объединив его с первым законом термодинамики, можно получить объединенное уравнение первого и второго законов термодинамики в виде выражений
Tds = du + Рdv; (8.19)
Tds = dh - vdР, (8.20)
где ds – изменение энтропии для любого процесса, как обратимого, так и для необратимого (звездочку при энтропии здесь не указывают).
Выражения (8.19) и (8.20) справедливы для любых процессов: обратимых и необратимых. Эти выражения используются для анализа термодинамических процессов и являются исходными для дифференциальных уравнений термодинамики в частных производных.
8.3. Изменение энтропии изолированной системы
Напомним, что изолированная система – это система без энергообмена с окружающей средой. Таким образом, речь пойдет об изменении энтропии системы, состоящей из нескольких тел, в результате энергообмена между ними.
Энтропия системы представляет собой сумму энтропий тел, составляющих эту систему, так как она подчиняется закону сложения (аддитивности) аналогично внутренней энергии и энтальпии.
где Sс и Si – полная энтропия системы и i-го тела, входящего в эту систему, Дж;
si – удельная энтропия i-го тела, Дж/кг;
mi – масса i-го тела, кг.
В свою очередь изменение энтропии системы равняется алгебраической сумме изменений энтропий всех тел, составляющих систему:
Рассмотрим, как изменяется энтропия изолированной термодинамической системы при протекании в ней различных обратимых и необратимых процессов.
8.3.1. Изменение энтропии изолированной системы
при теплообмене
Рассмотрим процесс обратимого теплообмена между двумя телами, имеющими одинаковую постоянную температуру Т1 (рис. 8.16). В обратимом теплообмене отсутствует разница температур между телами. Первое тело (1т) отдает теплоту Q (процесс 12), и его энтропия уменьшается на величину ΔS1 = Q/T1. Второе тело (2т) согласно первому закону термодинамики получает то же количество теплоты (процесс 21), но с обратным знаком (-Q), и его энтропия увеличивается на величину ΔS
2 = - ΔS1 = -Q/T1, так как обратимый процесс получения теплоты идет по траектории 21, совпадающей с процессом отвода теплоты 12. Суммарное изменение энтропии этой системы
Δ

SC = ΔS1 + ΔS2 = 0. (8.23)
Выражение (8.23) справедливо для любого случая обратимого теплообмена. Так, при переменной температуре двух тел в случае обратимого теплообмена между ними (рис.8.17) получаем изменение энтропии в этой системы тоже равное нулю:
ΔSC = ΔS1 + ΔS2 =
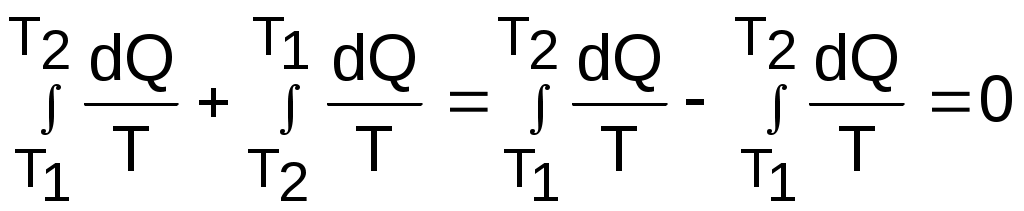 . (8.24)
. (8.24)Таким образом, при обратимом теплообмене энтропия системы не изменяется.
Реальный процесс теплообмена между телами происходит при конечной разности температур и поэтому необратим.
Рассмотрим теплообмен между двумя телами, имеющими постоянные температуры Т1 и Т2 (рис.8.18). Первое тело отдает теплоту Q (процесс 12), а второе (процесс 34) получает теплоту - Q.
Изменение энтропии системы в этом случае будет больше нуля, так как Т1>T2, а Q>0:
ΔSC = ΔS1 + ΔS2 =
А
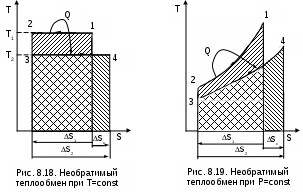
налогичная ситуация будет и при необратимом теплообмене между телами с переменной температурой (рис. 8.19), такой процесс возможен в поверхностном теплообменнике.
Таким образом, при необратимом теплообмене энтропия системы возрастает.
8.3.2. Изменение энтропии изолированной системы
при преобразовании работы в теплоту и теплоты в работу
Преобразование механической работы в теплоту наглядно иллюстрируется необратимым процессом трения. Так, если при механическом взаимодействии двух тел с одинаковой температурой Т1 есть трение, то эта работа трения преобразуется в теплоту трения – Lтр=Qтр>0. Эта теплота будет воспринята каждым из тел (Qтр=Qтр1+Qтр2), следовательно, возрастет энтропия каждого тела, а соответственно и всей системы.
Увеличение энтропии системы в этом случае можно аналитически показать на примере процесса, в котором температура обоих тел из-за трения увеличивается. Приняв теплоемкости обоих тел постоянными
, увеличение энтропии этой системы можно рассчитать как
ΔSс = ΔS1 + ΔS2 =
где m1, m2 – массы первого и второго тела;
с1, с2 – удельные теплоемкости первого и второго тела;
Т2, Т3 – температуры, до которых были нагреты первое и второе тело в результате трения.
Так как T2>T1 и T3>T1, а с1>0 и с2>0, то и ΔSc>0. Иллюстрацией такого примера может служить добывание огня первобытным человеком путем вращения палочки, зажатой в отверстии деревянного предмета. Необходимо отметить, что преобразование работы трения в теплоту не обязательно должно сопровождаться увеличением температуры тел. Так, в случае трения друг о друга двух кусков льда, имеющих температуру 0 ºС, изменения температуры этих кусков льда не будет, а преобразование работы трения в теплоту будет проявляться в виде плавления льда.
Таким образом, необратимое преобразование механической работы в теплоту всегда приводит к увеличению энтропии системы.
Теперь проанализируем обратный предыдущему процесс преобразования теплоты в работу. В отличие от возможности полного преобразования работы в теплоту полностью преобразовать теплоту в работу невозможно, это было доказано в разд. 8.1.1 и 8.1.2.
И
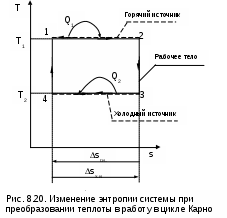
зменение энтропии изолированной системы при обратимом преобразовании теплоты в работу рассмотрим на примере цикла Карно (рис. 8.20). Такая система состоит из горячего (г.и.) и холодного (х.и.) источников теплоты и рабочего тела (р.т.). Изменение энтропии в такой системе соответствует выражению
ΔSc=ΔSг.и+ΔSр.т+ΔSх.и . (8.27)
Поскольку рабочее тело совершает замкнутый процесс (цикл), то изменение его энтропии равно нулю (ΔSр.т=0). Процессы подвода теплоты к рабочему телу 12 и отвода теплоты от рабочего тела 34 обратимые, поэтому изменение энтропии горячего источника (отрезок 21) равно изменению энтропии холодного источника теплоты (отрезок 43), взятому с обратным знаком (ΔSг.и = - ΔSх.и). В результате получили, что изменение энтропии в этой системе
ΔSc=ΔSг.и+ΔSр.т=0 . (8.28)
Этот вывод о неизменности энтропии системы (ΔSc=0) при обратимом преобразовании теплоты в работу справедлив для любого обратимого цикла, поскольку любой обратимый цикл можно представить в виде суммы элементарных обратимых циклов Карно.
П
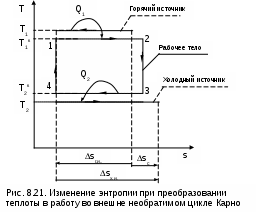
ри необратимом преобразовании теплоты в работу, когда есть разница температур между горячим источником теплоты и рабочим телом на процессе подвода теплоты и между рабочим телом и холодным источником теплоты на процессе отвода теплоты, энтропия системы возрастает (ΔSc>0). Это наглядно иллюстрируется необратимым циклом Карно (рис. 8.21). В этом случае увеличение энтропии системы обусловлено большим по модулю значением изменения энтропии холодного источника по сравнению с изменением энтропии горячего источника теплоты.
В
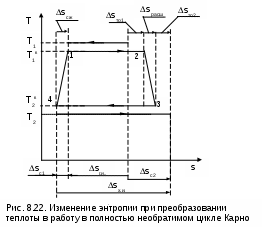
случае, когда кроме внешней необратимости (разности температур между телом, отдающим теплоту, и телом, получающим теплоту) присутствует внутренняя необратимость, вызванная наличием трения в реальных процессах, увеличение энтропии системы будет еще больше по сравнению с циклом, имеющим только внешнюю необратимость. Так, если для цикла Карно с внешней необратимостью (рис.8.21) добавить внутреннюю необратимость, вызванную трением на адиабатных процессах расширения и сжатия рабочего тела, получим полностью необратимый цикл Карно (рис.8.22). У такого цикла увеличение энтропии холодного тела будет еще больше, чем у цикла, изображенного на рис. 8.21, при одинаковых значениях Q1, Т1, Т2, Т1к, Т2к. Расширение процесса отвода теплоты 34 по отношению к процессу подвода теплоты к рабочему телу 12, обусловленное наличием трения в адиабатных процессов 23 и 41, приводит к увеличению энтропии холодного источника теплоты в полностью необратимом цикле Карно по сравнению с внешне необратимым циклом Карно:
ΔSc=ΔSг.и+ΔSх.и=ΔSc1+ΔSс2=ΔSто1+ΔSрасш+ΔSто2+ΔSсж , (8.29)
где ΔSто1 – увеличение энтропии системы за счет необратимости теплообмена между горячим источником теплоты и рабочим телом;
ΔSрасш – увеличение энтропии за счет необратимости процесса адиабатного расширения рабочего тела;
ΔSто2 – увеличение энтропии системы за счет необратимости теплообмена между рабочим телом и холодным источником теплоты;
ΔSсж – увеличение энтропии за счет необратимости процесса адиабатного сжатия рабочего тела.
Принцип возрастания энтропии в изолированной системе относится к любому необратимому циклу теплового двигателя, поскольку, используя понятие среднетермодинамической температуры, любой внутренне обратимый цикл рабочего тела можно представить в виде эквивалентного цикла Карно, а процессы горячего и холодного источников теплоты привести к эквивалентным изотермическим процессам.


