ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.04.2024
Просмотров: 140
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
, т.е. пл.1аа'1'1=l1а=u1-uос. Площадь под изотермой а2 равна теплоте этого процесса, т.е. пл.а22'а'а= lа2 = =qа2=Tос(sос-s1). Полная работа изменения объема газа на процессе 1а2 будет представлена в виде алгебраической суммы этих площадей, т.е. l1а2=пл.1аа'1'1+пл.а22'а'а=u1-uос-Tос(s1-sос). При графическом суммировании этих площадей в диаграмме Р,v необходимо учитывать отрицательный знак работы в процессе сжатия газа а2 (штриховка этой площади выполнена на рис.8.24 в противоположном направлении по отношению к процессу расширения газа 1а).
Д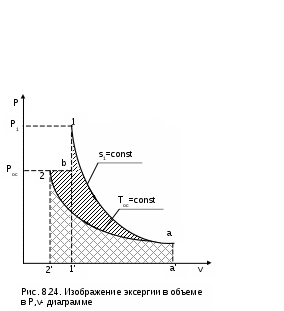
ля получения эксергии необходимо из работы изменения объема газа процесса 1а2 вычесть внешнюю работу e=l1а2-lвн. Расчетное выражение внешней работы газа соответствует величине lвн=Pос(vос-v1). Внешняя работа, взятая с обратным знаком, в диаграмме Р,v соответствует площади под изобарным процессом 2в, т.е. -lвн=Pос(v1-vос)= =пл.2b1'2'2 (работа процесса 2b положительная). В итоге получили, что эксергии газа, имеющего параметры точки 1, в Р,v- диаграмме соответствует работа изменения объема процесса 1а2в и площадь под ним:
пл.1а2b1 = e = (u1 - uос) - Tос(s1 - sос) + Pос(v1 - vос).
В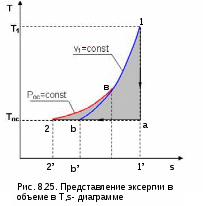
диаграмме Т,s эксергию идеального газа, имеющего параметры точки 1, можно показать в виде площади, перенеся процесс 1а2b из Р,v- диаграммы в диаграмму Т,s (рис.8.25).
Площадь под изохорой v1=const процесса d1 соответствует изменению внутренней энергии идеального газа в интервале темератур Т1 и Тос, т.е. пл.11'd'd1=u1-uос. Площадь под изотермой Тос=const процесса а2 соответствует его теплоте, т.е. пл.а1'2'2а=qа2=Tос(sос-s1). Площадь фигуры 2вbb’2’2 соответствует работе изменения объема изобарного процесса 2в, т.е. пл. 2вbb’2’2=l2d=Рос(v1-vос).
В результате алгебраического сложения площадей под процессом d1a2b в диаграмме Т-s получили пощадь фигуры 1a2b1, которая соответствует величине эксергии, т.е.
пл.1a2b1 = e =(u1 - uос) - Tос (s1 - sос) + Pос (v1 - vос).
Показать эксергию в объеме для газа в виде площади в диаграммах Р,v и Т,s можно, используя и другие обратимые процессы перехода газа из неравновесного состояния в состояние равновесия с окружающей средой. Обязательным условием такого перехода яляется обратимость всех процессов.
8.4.2. Практическое значение эксергии
Ранее была рассмотрена эксергия газового тела при переходе его в состояние равновесия с окружающей средой по обратимым процессам. В этом случае газ сам выступает в роли рабочего тела.
В теплоэнергетике большое значение имеет использование термической неравновесности источника работы (горячее тело) и внешней среды (холодное тело) посредством рабочего тела, совершающего замкнутый процесс изменения состояния – цикл. В этом случае источник работы может иметь любые физические свойства. В теплоэнергетических установках это, как правило, газообразные продукты сгорания топлива, тепловыделяющие элементы или первичный теплоноситель (жидкий или газообразный) атомного реактора. В таких установках рабочее тело совершает цикл, источник работы служит теплоотдатчиком, а внешняя среда – теплоприемником.
В теплоэнергетике термодинамический анализ термической неравновесности источника работы и внешней среды с использованием понятия эксергии может быть практически использован в следующих направлениях:
1) для определения максимально полезной работы – эксергии, которая может быть получена в системе при использовании определенного количества первичного теплоносителя (источника работы);
2) для определения влияния необратимости на полезную работу;
3) для выбора рациональных циклов теплоэнергетических установок.
Последовательно рассмотрим эти направления применительно к наиболее характерным случаям.
8.4.2.1. Определение эксергии источников работы, имеющих
термическую неравновесность
Первоначально рассмотрим источник работы с постоянной температурой (бесконечной теплоемкостью), имеющей большее значение, чем температура внешней среды. Примером такого источника работы являются тепловыделяющие элементы в кипящем ядерном реакторе, вырабатывающем насыщенный водяной пар при постоянном давлении.
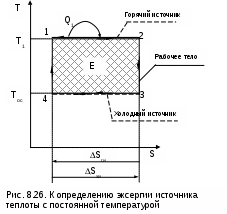
Для определения эксергии этого источника работы (теплоты) необходимо рассмотреть термодинамическую систему, которая должна включать в себя: горячий источник теплоты с постоянной температурой Т1 (источник работы), внешнюю среду с постоянной температурой Тос (холодный источник теплоты) и рабочее тело (рис.8.26).
В рассматриваемой системе, при использовании количества теплоты Q
1, передаваемого от горячего источника теплоты рабочему телу, максимально полезная работа, или эксергия, может быть получена только при неизменной энтропии системы (ΔSc = 0), т.е. при прохождении в ней только обратимых процессов. Выполнение этого условия возможно только при осуществлении в нашей системе обратимого цикла Карно (рис. 8.26) в интервале температур Т1 и Тос. Только в этом случае в нашей системе не будет протекать никаких необратимых процессов, не будет возрастания энтропии системы и не будет потерь возможной работы.
Следовательно, максимально полезная работа – эксергия, получаемая в этом случае, будет соответствовать работе обратимого цикла Карно 1234:

. (8.38)
Множитель (T1-Tос)/T1 в выражении 8.38 представляет термический КПД данного цикла Карно, он называется эксергетической температурой. Всегда целесообразно иметь большее значение эксергетической температуры, поскольку в этом случае эксергия источника работы также будет иметь большее значение.
В случае если источник работы имеет конечную теплоемкость и температуру выше, чем температура окружающей среды, и находится в механическом равновесии с внешней средой (Р=Рос), он может перейти в состояние термического равновесия с внешней средой при его охлаждении по изобаре Р=const.
Н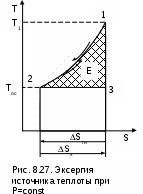 а практике существует множество источников работы такого типа: продукты сгорания органического топлива, горячие газы, пары, жидкости и т.п.
а практике существует множество источников работы такого типа: продукты сгорания органического топлива, горячие газы, пары, жидкости и т.п.
Рассмотрим определение эксергии таких источников работы на примере продуктов сгорания топлива, охлаждающихся от температуры Т1 до температуры окружающей среды Тос при постоянном атмосферном давлении Рос=const (рис.8.27). Для получения работы в этом случае, как и в первом, необходимо, чтобы кроме источника работы система включала внешнюю среду с постоянной температурой Тос и рабочее тело. Получение максимально полезной работы в этой системе также возможно только при протекании в ней обратимых процессов, т.е. при отсутствии увеличения энтропии системы (ΔSc = 0). В соответствии с этим условием рабочее тело должно совершать цикл 1231, поскольку только в этом случае изменение энтропии продуктов сгорания (процесс 12) будет равно изменению энтропии внешней среды (процесс 23) с обратным знаком. Максимально полезная работа, или эксергия, источника работы в этом случае будет равна площади 1231. Любой другой цикл рабочего тела не будет полностью обратимым и даст меньшую работу.
8.4.2.2. Определение влияния необратимости на полезную работу в изолированной системе
Как было установлено ранее, любая необратимость связана с возрастанием энтропии изолированной системы. Рассмотрим, как различные виды необратимости влияют на возможность получения полезной работы в изолированной системе.
Необратимый теплообмен обусловлен наличием разности температур между телами.
Рассмотрим в T,S- диаграмме сначала случай необратимого теплообмена между двумя телами с постоянными температурами Т1 и Т2 (рис. 8.28). Кроме указанных тел система включает в себя окружающую среду с постоянной температурой Тос, которая при оценке эксергии используется в качестве охладителя. Как было установлено ранее, энтропия такой системы возрастет на величину
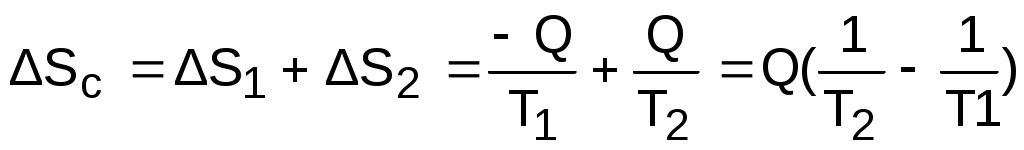 , (8.39)
, (8.39)
где Q – теплота, полученная телом с температурой Т2 от тела с температурой Т1.
Отличие эксергии первого тела от второго (потеря эксергии) в этом случае будет представлено разницей работ обратимых циклов Карно (Е1=пл.16521 и Е2=пл.34753)
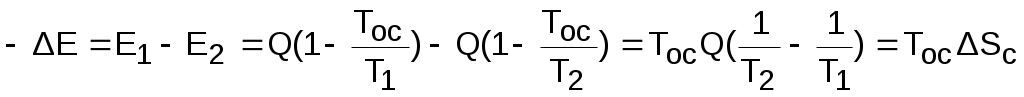 . (8.40)
. (8.40)
Эта потеря эксергии в T,S- диаграмме представляет площадь
-ΔE=TосΔSc=пл.674'1'6.
П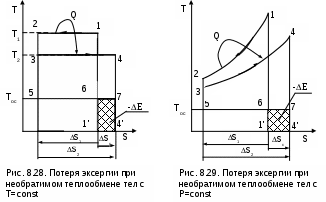
оскольку энтропия системы в нашем примере увеличивается (ΔSc>0), то в результате необратимости теплообмена эксергия тела с меньшей температурой будет меньше, чем эксергия тела с большей температурой. Следовательно, наличие необратимости теплообмена приводит к снижению работоспособности системы, т.е. к потере возможной работы системы (эксергии).
В случае необратимого теплообмена между телами с переменной температурой (рис. 8.29) будет аналогичный результат. Здесь доказательств не требуется, так как любой процесс подвода и отвода теплоты в обратимом цикле в T,S- диаграмме можно представить в виде изотермического процесса со среднетермодинамической температурой. На рис.8.29 эксергии тел и уменьшение эксергии вследствие необратимого теплообмена представляют следующие площади:
Е1=пл.12561, Е2 = пл.34753, -ΔЕ = ТосΔSc = пл.674'1'6.
Полученное выражение применимо ко всем необратимым процессам. Сформулированное положение, что потеря возможной работы системы (эксергиии) представляет собой произведение абсолютной температуры окружающей среды на увеличение энтропии системы, вызванное необратимостями происхдящих в ней процессов, носит название теоремы Гюи – Стодолы в честь ученых, установивших эту закономерность. Аналитическое выражение этой теоремы имеет вид
-ΔE = Tос ΔSc , (8.41)
где -ΔE – потеря максимально возможной работы системы - эксергии;
Тос – абсолютная температура окружающей среды;
ΔSc – возрастание энтропии системы за счет необратимости процессов.
Справедливость теоремы Гюи–Стодолы в дальнейшем будет многократно подтверждена.
Необратимость, обусловленная преобразованием работы
в теплоту путем трения
Р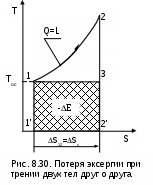 ассмотрим пример преобразования работы в теплоту трения и оценим влияние этой необратимости на получение возможной работы в изолированной системе.
ассмотрим пример преобразования работы в теплоту трения и оценим влияние этой необратимости на получение возможной работы в изолированной системе.
Предположим, что две металлических пластины трутся друг о друга. Перемещение этих пластин вызвано затратой механической работы в изолированной системе. В результате трения пластины нагреваются, т.е. механическая работа преобразуется в теплоту трения. Обозначим механическую работу, которая преобразовалась в теплоту трения, величиной L=Q и рассмотрим эту ситуацию в диаграмме T,S (рис. 8.30). Поскольку пластины восприняли (внутреннюю) теплоту трения, то их энтропия увеличилась, следовательно, увеличилась и энтропия данной изолированной системы – ΔSc=S2-S1>0. Если теплоту трения Q этих пластин использовать даже в обратимом цикле, где охладителем является окружающая среда, то полученная максимально возможная работа в этой системе будет соответствовать эксергии источника теплоты в виде этих нагретых пластин – Е=пл.1231. Эта максимально возможная работа будет меньше теплоты трения на величину площади 132'1'1, которая соответствует произведению TосΔSc. Следовательно, необратимость процесса преобразования работы в теплоту трения привела к потере возможной работы, которая тоже может быть определена по теореме Гюи–Стодолы (-ΔL=L-E=TосΔSc).
Д

ля получения эксергии необходимо из работы изменения объема газа процесса 1а2 вычесть внешнюю работу e=l1а2-lвн. Расчетное выражение внешней работы газа соответствует величине lвн=Pос(vос-v1). Внешняя работа, взятая с обратным знаком, в диаграмме Р,v соответствует площади под изобарным процессом 2в, т.е. -lвн=Pос(v1-vос)= =пл.2b1'2'2 (работа процесса 2b положительная). В итоге получили, что эксергии газа, имеющего параметры точки 1, в Р,v- диаграмме соответствует работа изменения объема процесса 1а2в и площадь под ним:
пл.1а2b1 = e = (u1 - uос) - Tос(s1 - sос) + Pос(v1 - vос).
В

диаграмме Т,s эксергию идеального газа, имеющего параметры точки 1, можно показать в виде площади, перенеся процесс 1а2b из Р,v- диаграммы в диаграмму Т,s (рис.8.25).
Площадь под изохорой v1=const процесса d1 соответствует изменению внутренней энергии идеального газа в интервале темератур Т1 и Тос, т.е. пл.11'd'd1=u1-uос. Площадь под изотермой Тос=const процесса а2 соответствует его теплоте, т.е. пл.а1'2'2а=qа2=Tос(sос-s1). Площадь фигуры 2вbb’2’2 соответствует работе изменения объема изобарного процесса 2в, т.е. пл. 2вbb’2’2=l2d=Рос(v1-vос).
В результате алгебраического сложения площадей под процессом d1a2b в диаграмме Т-s получили пощадь фигуры 1a2b1, которая соответствует величине эксергии, т.е.
пл.1a2b1 = e =(u1 - uос) - Tос (s1 - sос) + Pос (v1 - vос).
Показать эксергию в объеме для газа в виде площади в диаграммах Р,v и Т,s можно, используя и другие обратимые процессы перехода газа из неравновесного состояния в состояние равновесия с окружающей средой. Обязательным условием такого перехода яляется обратимость всех процессов.
8.4.2. Практическое значение эксергии
Ранее была рассмотрена эксергия газового тела при переходе его в состояние равновесия с окружающей средой по обратимым процессам. В этом случае газ сам выступает в роли рабочего тела.
В теплоэнергетике большое значение имеет использование термической неравновесности источника работы (горячее тело) и внешней среды (холодное тело) посредством рабочего тела, совершающего замкнутый процесс изменения состояния – цикл. В этом случае источник работы может иметь любые физические свойства. В теплоэнергетических установках это, как правило, газообразные продукты сгорания топлива, тепловыделяющие элементы или первичный теплоноситель (жидкий или газообразный) атомного реактора. В таких установках рабочее тело совершает цикл, источник работы служит теплоотдатчиком, а внешняя среда – теплоприемником.
В теплоэнергетике термодинамический анализ термической неравновесности источника работы и внешней среды с использованием понятия эксергии может быть практически использован в следующих направлениях:
1) для определения максимально полезной работы – эксергии, которая может быть получена в системе при использовании определенного количества первичного теплоносителя (источника работы);
2) для определения влияния необратимости на полезную работу;
3) для выбора рациональных циклов теплоэнергетических установок.
Последовательно рассмотрим эти направления применительно к наиболее характерным случаям.
8.4.2.1. Определение эксергии источников работы, имеющих
термическую неравновесность
Первоначально рассмотрим источник работы с постоянной температурой (бесконечной теплоемкостью), имеющей большее значение, чем температура внешней среды. Примером такого источника работы являются тепловыделяющие элементы в кипящем ядерном реакторе, вырабатывающем насыщенный водяной пар при постоянном давлении.
Для определения эксергии этого источника работы (теплоты) необходимо рассмотреть термодинамическую систему, которая должна включать в себя: горячий источник теплоты с постоянной температурой Т1 (источник работы), внешнюю среду с постоянной температурой Тос (холодный источник теплоты) и рабочее тело (рис.8.26).
В рассматриваемой системе, при использовании количества теплоты Q
1, передаваемого от горячего источника теплоты рабочему телу, максимально полезная работа, или эксергия, может быть получена только при неизменной энтропии системы (ΔSc = 0), т.е. при прохождении в ней только обратимых процессов. Выполнение этого условия возможно только при осуществлении в нашей системе обратимого цикла Карно (рис. 8.26) в интервале температур Т1 и Тос. Только в этом случае в нашей системе не будет протекать никаких необратимых процессов, не будет возрастания энтропии системы и не будет потерь возможной работы.
Следовательно, максимально полезная работа – эксергия, получаемая в этом случае, будет соответствовать работе обратимого цикла Карно 1234:

. (8.38)
Множитель (T1-Tос)/T1 в выражении 8.38 представляет термический КПД данного цикла Карно, он называется эксергетической температурой. Всегда целесообразно иметь большее значение эксергетической температуры, поскольку в этом случае эксергия источника работы также будет иметь большее значение.
В случае если источник работы имеет конечную теплоемкость и температуру выше, чем температура окружающей среды, и находится в механическом равновесии с внешней средой (Р=Рос), он может перейти в состояние термического равновесия с внешней средой при его охлаждении по изобаре Р=const.
Н
 а практике существует множество источников работы такого типа: продукты сгорания органического топлива, горячие газы, пары, жидкости и т.п.
а практике существует множество источников работы такого типа: продукты сгорания органического топлива, горячие газы, пары, жидкости и т.п.Рассмотрим определение эксергии таких источников работы на примере продуктов сгорания топлива, охлаждающихся от температуры Т1 до температуры окружающей среды Тос при постоянном атмосферном давлении Рос=const (рис.8.27). Для получения работы в этом случае, как и в первом, необходимо, чтобы кроме источника работы система включала внешнюю среду с постоянной температурой Тос и рабочее тело. Получение максимально полезной работы в этой системе также возможно только при протекании в ней обратимых процессов, т.е. при отсутствии увеличения энтропии системы (ΔSc = 0). В соответствии с этим условием рабочее тело должно совершать цикл 1231, поскольку только в этом случае изменение энтропии продуктов сгорания (процесс 12) будет равно изменению энтропии внешней среды (процесс 23) с обратным знаком. Максимально полезная работа, или эксергия, источника работы в этом случае будет равна площади 1231. Любой другой цикл рабочего тела не будет полностью обратимым и даст меньшую работу.
8.4.2.2. Определение влияния необратимости на полезную работу в изолированной системе
Как было установлено ранее, любая необратимость связана с возрастанием энтропии изолированной системы. Рассмотрим, как различные виды необратимости влияют на возможность получения полезной работы в изолированной системе.
Необратимый теплообмен
Необратимый теплообмен обусловлен наличием разности температур между телами.
Рассмотрим в T,S- диаграмме сначала случай необратимого теплообмена между двумя телами с постоянными температурами Т1 и Т2 (рис. 8.28). Кроме указанных тел система включает в себя окружающую среду с постоянной температурой Тос, которая при оценке эксергии используется в качестве охладителя. Как было установлено ранее, энтропия такой системы возрастет на величину
где Q – теплота, полученная телом с температурой Т2 от тела с температурой Т1.
Отличие эксергии первого тела от второго (потеря эксергии) в этом случае будет представлено разницей работ обратимых циклов Карно (Е1=пл.16521 и Е2=пл.34753)
Эта потеря эксергии в T,S- диаграмме представляет площадь
-ΔE=TосΔSc=пл.674'1'6.
П

оскольку энтропия системы в нашем примере увеличивается (ΔSc>0), то в результате необратимости теплообмена эксергия тела с меньшей температурой будет меньше, чем эксергия тела с большей температурой. Следовательно, наличие необратимости теплообмена приводит к снижению работоспособности системы, т.е. к потере возможной работы системы (эксергии).
В случае необратимого теплообмена между телами с переменной температурой (рис. 8.29) будет аналогичный результат. Здесь доказательств не требуется, так как любой процесс подвода и отвода теплоты в обратимом цикле в T,S- диаграмме можно представить в виде изотермического процесса со среднетермодинамической температурой. На рис.8.29 эксергии тел и уменьшение эксергии вследствие необратимого теплообмена представляют следующие площади:
Е1=пл.12561, Е2 = пл.34753, -ΔЕ = ТосΔSc = пл.674'1'6.
Полученное выражение применимо ко всем необратимым процессам. Сформулированное положение, что потеря возможной работы системы (эксергиии) представляет собой произведение абсолютной температуры окружающей среды на увеличение энтропии системы, вызванное необратимостями происхдящих в ней процессов, носит название теоремы Гюи – Стодолы в честь ученых, установивших эту закономерность. Аналитическое выражение этой теоремы имеет вид
-ΔE = Tос ΔSc , (8.41)
где -ΔE – потеря максимально возможной работы системы - эксергии;
Тос – абсолютная температура окружающей среды;
ΔSc – возрастание энтропии системы за счет необратимости процессов.
Справедливость теоремы Гюи–Стодолы в дальнейшем будет многократно подтверждена.
Необратимость, обусловленная преобразованием работы
в теплоту путем трения
Р
 ассмотрим пример преобразования работы в теплоту трения и оценим влияние этой необратимости на получение возможной работы в изолированной системе.
ассмотрим пример преобразования работы в теплоту трения и оценим влияние этой необратимости на получение возможной работы в изолированной системе.Предположим, что две металлических пластины трутся друг о друга. Перемещение этих пластин вызвано затратой механической работы в изолированной системе. В результате трения пластины нагреваются, т.е. механическая работа преобразуется в теплоту трения. Обозначим механическую работу, которая преобразовалась в теплоту трения, величиной L=Q и рассмотрим эту ситуацию в диаграмме T,S (рис. 8.30). Поскольку пластины восприняли (внутреннюю) теплоту трения, то их энтропия увеличилась, следовательно, увеличилась и энтропия данной изолированной системы – ΔSc=S2-S1>0. Если теплоту трения Q этих пластин использовать даже в обратимом цикле, где охладителем является окружающая среда, то полученная максимально возможная работа в этой системе будет соответствовать эксергии источника теплоты в виде этих нагретых пластин – Е=пл.1231. Эта максимально возможная работа будет меньше теплоты трения на величину площади 132'1'1, которая соответствует произведению TосΔSc. Следовательно, необратимость процесса преобразования работы в теплоту трения привела к потере возможной работы, которая тоже может быть определена по теореме Гюи–Стодолы (-ΔL=L-E=TосΔSc).


