ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.04.2024
Просмотров: 153
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
o=0, получим ho=Povo=RTo=0R=0, т.е. в данном случае численные значения начала отсчета внутренней энергии и энтальпии одинаковы и равны нулю. Расчетное выражение абсолютной энтальпии в этом случае будет представлено в виде
h - ho = h - 0 = cp(T-0) или h = cpT . (3.56)
Абсолютные значения энтальпий по выражениям (3.55) и (3.56) при одинаковых температурах будут разные, но разница энтальпий в одинаковом интервале температур будет одинаковой:
h2 - h1 = cp(t2-t1) = cp(T2-T1) . (3.57)
Таким образом, в расчетах абсолютного значения энтальпии основным требованием является необходимость выбора одинаковых параметров для принятия начала отсчета внутренней энергии и энтальпии. Для идеального газа начало отсчета энтальпии и внутренней энергии фиксируется только температурой.
При расчете разности энтальпий выбор параметров начала отсчета энтальпии никакой роли не играет. Поэтому, если сразу рассчитывается разность энтальпий (выражение (3.55), то параметры начала отсчета энтальпии вообще не нужны, если разница энтальпий определяется через их абсолютные значения h2 - h1, то они должны иметь одинаковые (любые) параметры начала их отсчета.
3.1.4. Энтропия идеальных газов
Для получения расчетного выражения изменения энтропии идеальных газов воспользуемся первым законом термодинамики, в котором теплота определяется с использованием изменения энтальпии:
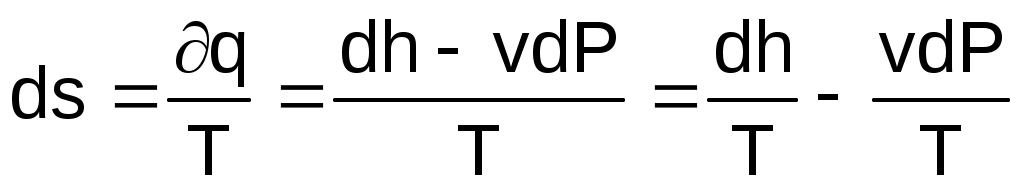 . (3.58)
. (3.58)
Для идеального газа изменение энтальпии определяется как dh=cpdT, а удельный объем v = RT/P. Подставив данные выражения изменения энтальпии и удельного объема в уравнение (3.58), получим уравнение для изменения энтропии идеального газа:
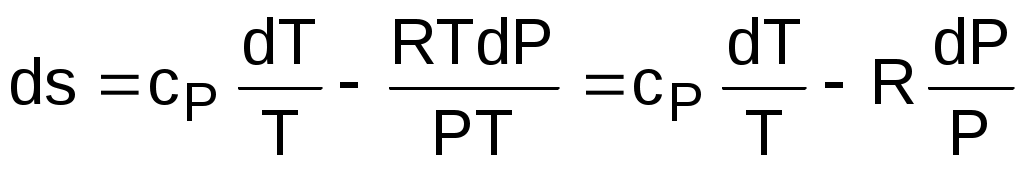 . (3.59)
. (3.59)
Разность энтропий идеального газа в конкретных точках можно получить интегрированием выражения (3.59):
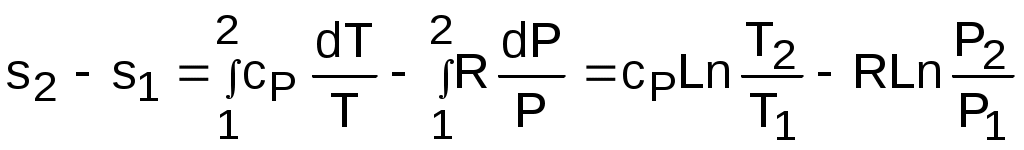 . (3.60)
. (3.60)
Воспользовавшись формулой Майера сp=сv+R и уравнением Менделеева – Клапейрона Pv=RT, выражение (3.60) можно записать и через две другие пары термических параметров состояния:
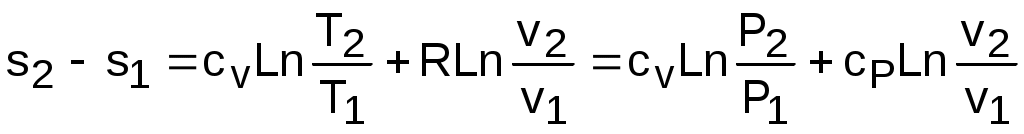 . (3.61)
. (3.61)
Для определения абсолютного значения энтропии идеального газа необходимо зафиксировать начало ее отсчета любой парой термических параметров состояния. Например, приняв s
о=0 при То и Ро, воспользовавшись уравнением (3.60), получим
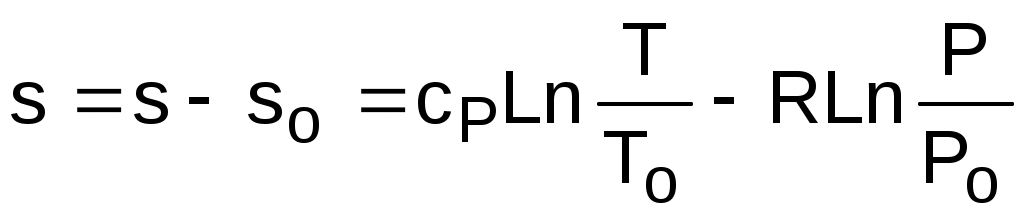 . (3.62)
. (3.62)
Выражение (3.62) свидетельствует о том, что энтропия идеального газа есть параметр состояния, поскольку ее можно определить через любую пару параметров состояния. В свою очередь, поскольку энтропия сама является параметром состояния, используя ее в паре с любым независимым параметом состояния, можно определить любой другой параметр состояния газа.
3.2. Газовые смеси
В практической деятельности чаще всего имеют дело не с однородными газами, а с их смесями (воздух, продукты сгорания топлива, горючие газовые смеси и т.п.). Поэтому в теплотехнике газовые смеси имеют важное значение.
В объеме, занимаемом газовой смесью, каждый газ, входящий в эту смесь, ведет себя так же, как вел бы себя при отсутствии других составляющих смеси: распространяется по всему объему; создает давление (парциальное), определяемое температурой и объемом на единицу его массы; имеет температуру смеси.
Смесь идеальных газов представляет собой идеальный газ, для которого справедливы законы и полученные для идеальных газов зависимости.
Для идеального газа давление определяется выражением (3.1):
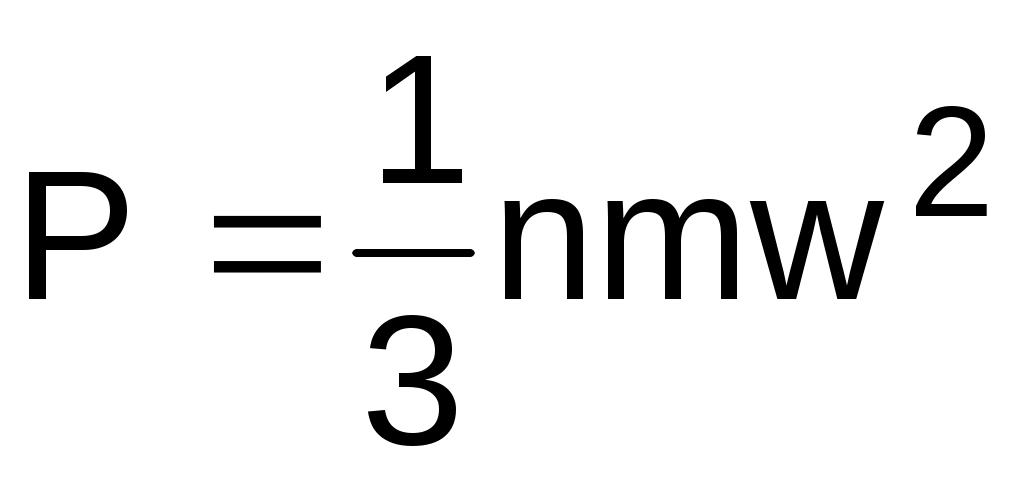 .
.
Количество молекул, входящих в данную смесь газов, равно сумме молекул газов, составляющих смесь:
nсм = n1 + n2 + ··· + nn . (3.63)
Произведение mw2=2T пропорционально абсолютной температуре газа, а поскольку все газы, входящие в смесь, имеют одинаковую температуру, то справедливо равенство
2T = m1w12 = m2 w22 = ··· = mn wn2 . (3.64)
В соответствии с выражениями (3.63) и (3.64) давление для смеси газов можно представить в виде суммы
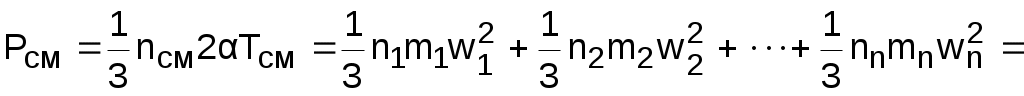

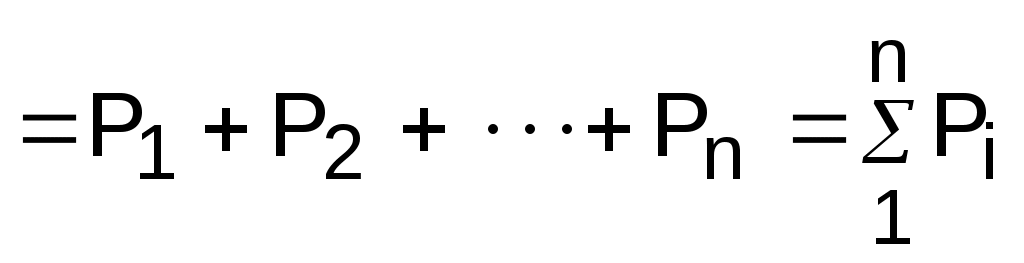 , (3.65)
, (3.65)
где Pi – парциальные давления газов, составляющих смесь.
Уравнение (3.65) представляет математическое выражение закона Дальтона (1807 г.) в соответствии с которым
давление газовой смеси равно сумме парциальных давлений газов, входящих в смесь.
Парциальное давление – это давление, которое создает один из газов, составляющих смесь, при температуре смеси в случае заполнения им всего объема смеси. Парциальное давление – это реально-существующая величина, поскольку каждый отдельный газ в смеси имеет температуру смеси и занимает весь объем смеси. Парциальное давление можно определить из уравнения Менделеева –Клапейрона:
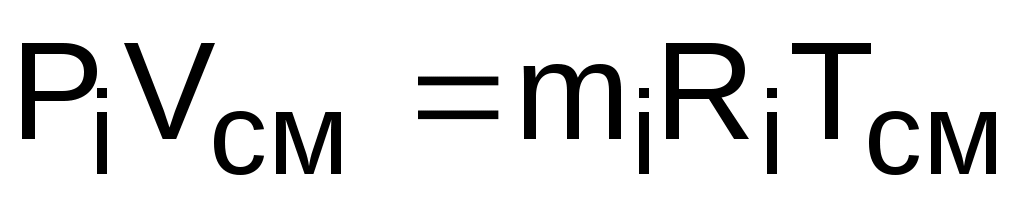 , (3.66)
, (3.66)
где Vсм – объем, занимаемый всей смесью газов;
mi – масса отдельного газа, входящего в смесь;
Ri– газовая постоянная отдельного газа;
Tсм – температура смеси газов.
Основные характеристики смеси газов
Для того чтобы воспользоваться уравнением Менделеева-Клапейрона для смеси газов
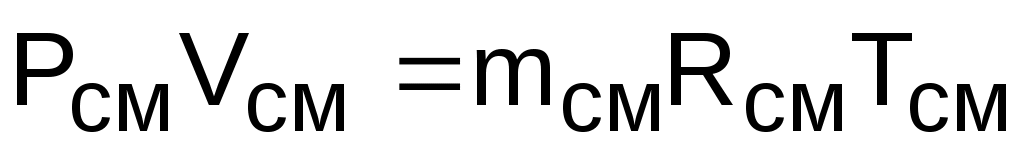 ,
, 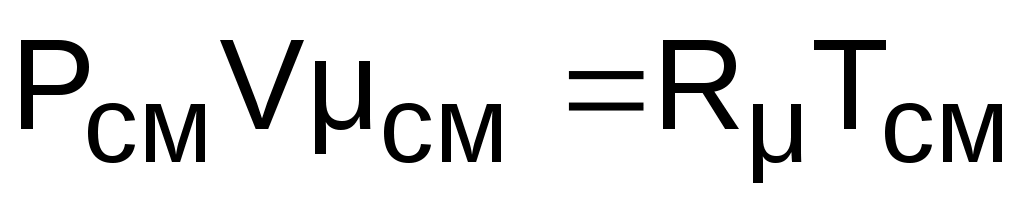 ,
, 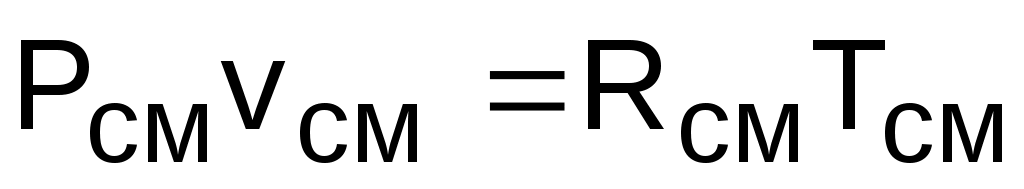 ,
,
необходимо знать газовую постоянную Rсм и молярную массу (условную) смеси µсм. Для смеси, как для любого идеального газа, эти две величины связаны соотношением Rсм=8314/µсм (Дж/(кг·К)). Чтобы рассчитать эти величины, необходимо знать состав смеси газов, т.е. какие газы и в какой пропорции входят в смесь.
Состав смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей gi данного газа называется отношение его массы к массе всей смеси:
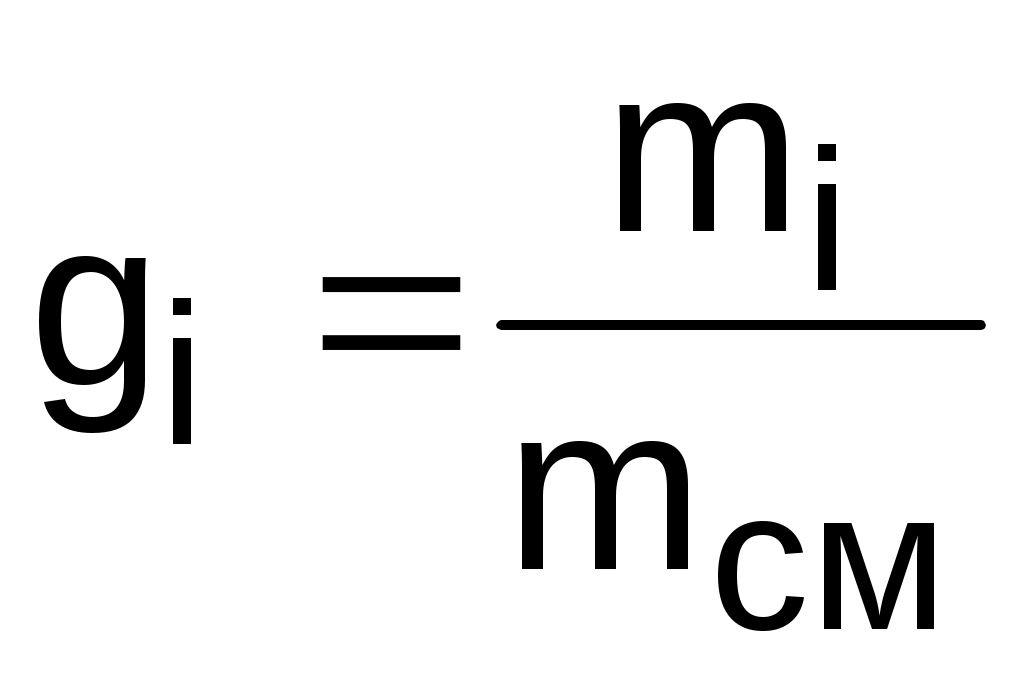 , (3.67)
, (3.67)
где mi – масса отдельного газа, входящего в смесь;
mсм – общая масса смеси.
Очевидно, что сумма массовых долей всех газов смеси равна единице:
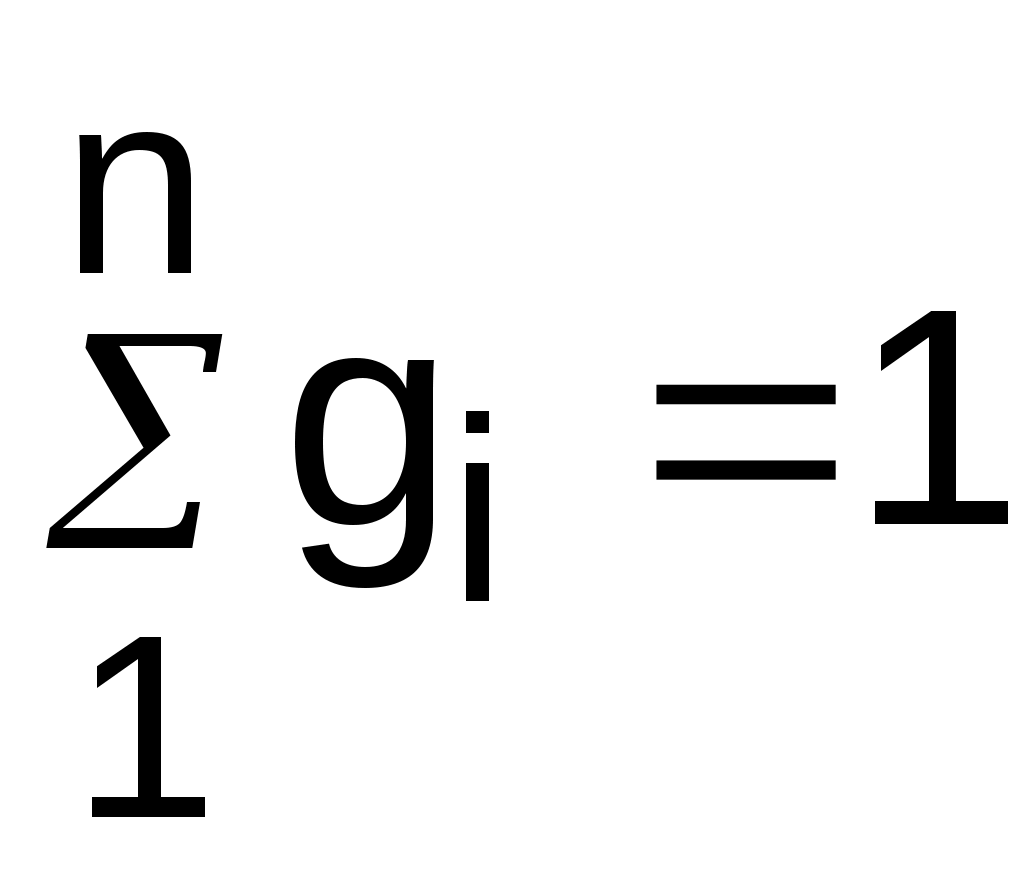 . (3.68)
. (3.68)
Объeмной долей ri данного газа называется отношение объема, который занимал бы данный газ при температуре и давлении смеси, к общему объему смеси:
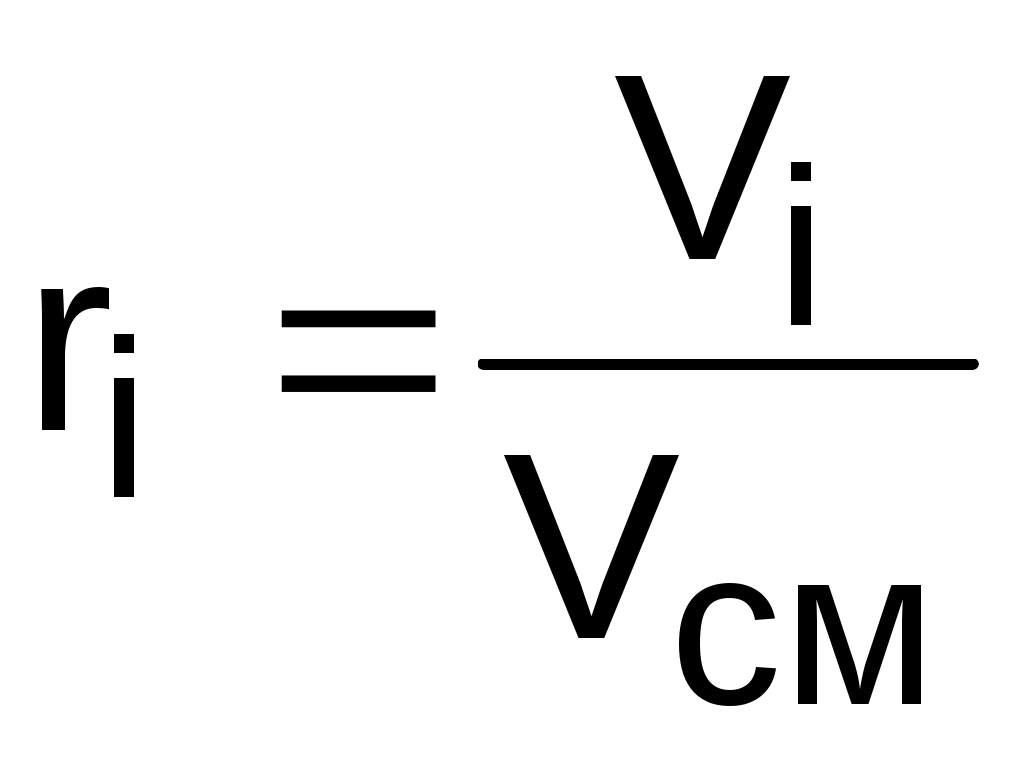 , (3.69)
, (3.69)
где Vi – объем данного газа при Тсм и Рсм, м3.
Объем Vi называют парциальным объемом, это искусственно введенная величина, поскольку каждый газ, входящий в смесь, занимает весь объем смеси. Парциальный объем можно рассчитать по уравнению Менделеева – Клапейрона:
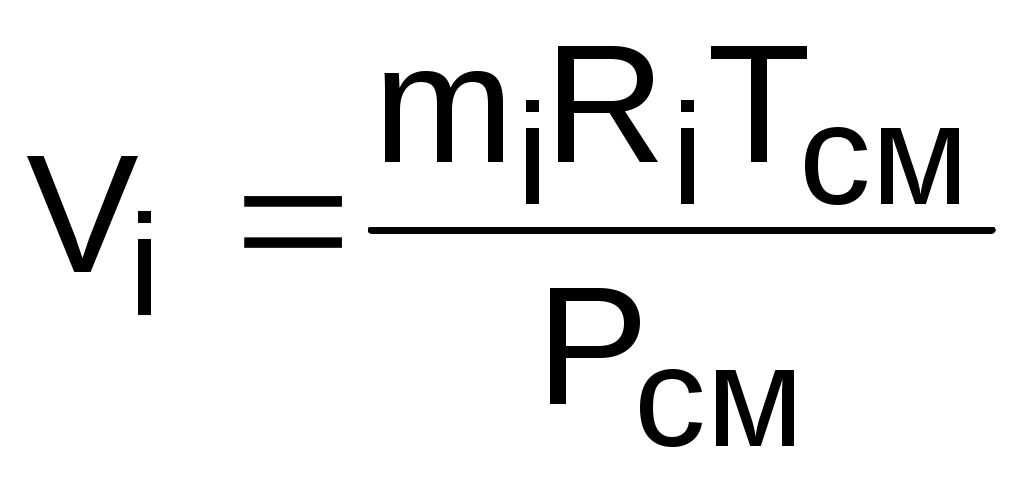 . (3.70)
. (3.70)
Записав уравнение Менделеева – Клапейрона через парциальное давление и через парциальный объем,
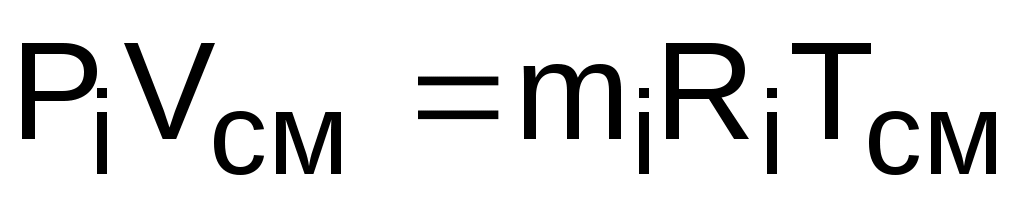 ,
,
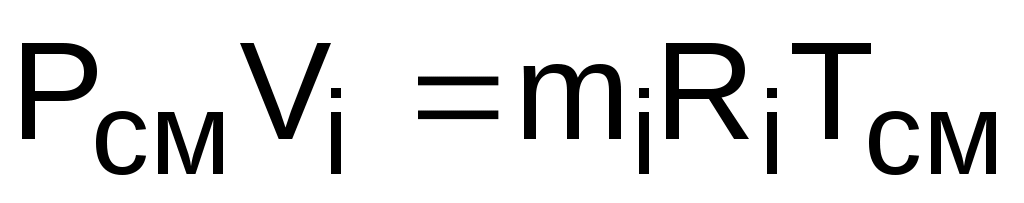 ,
,
можно получить еще одно расчетное выражение для объемной доли, поделив правые и левые части этих уравнений одно на другое:
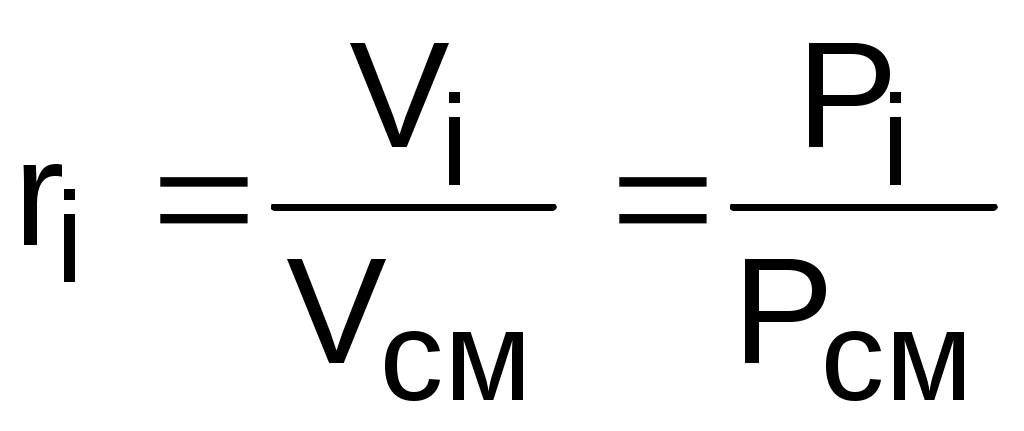 . (3.71)
. (3.71)
Поскольку сумма парциальных давлений равна давлению смеси, то сумма объемных долей всех газов смеси равна единице, а сумма парциальных объемов равна полному объему всей смеси газов:
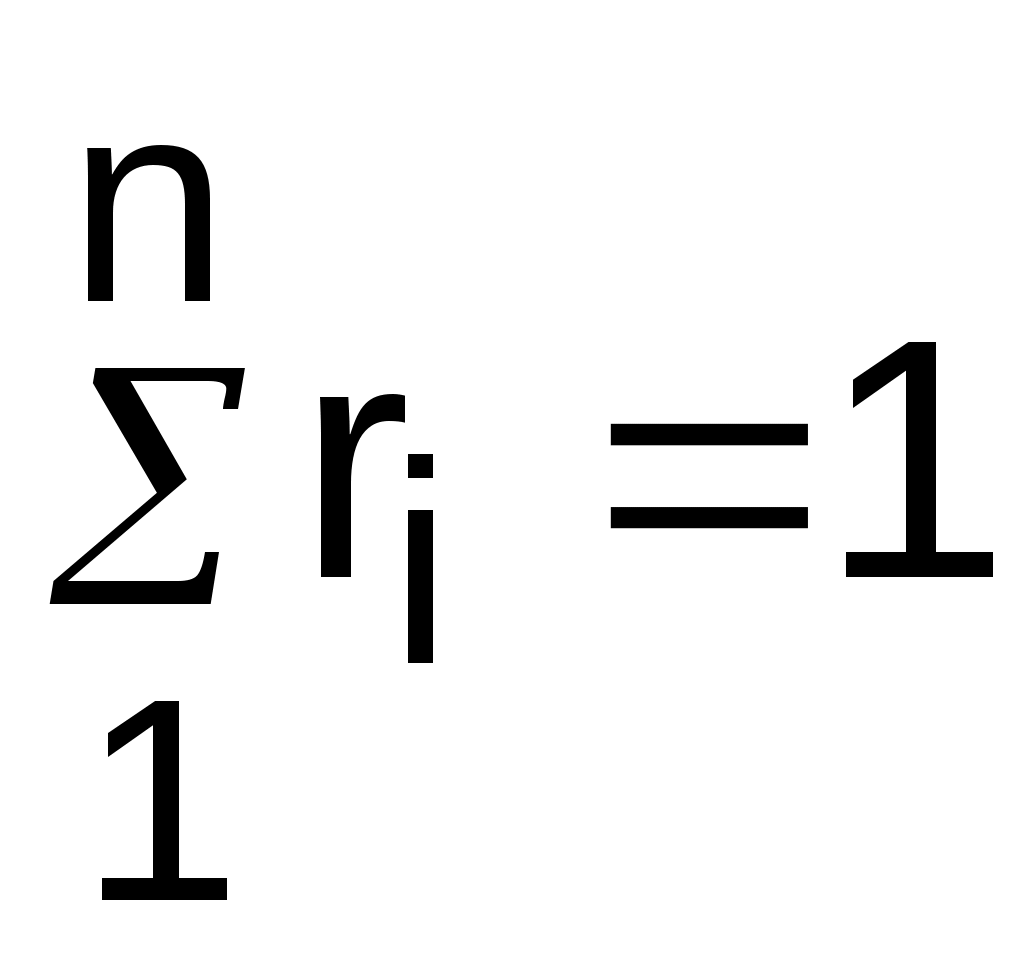 , (3.72)
, (3.72)
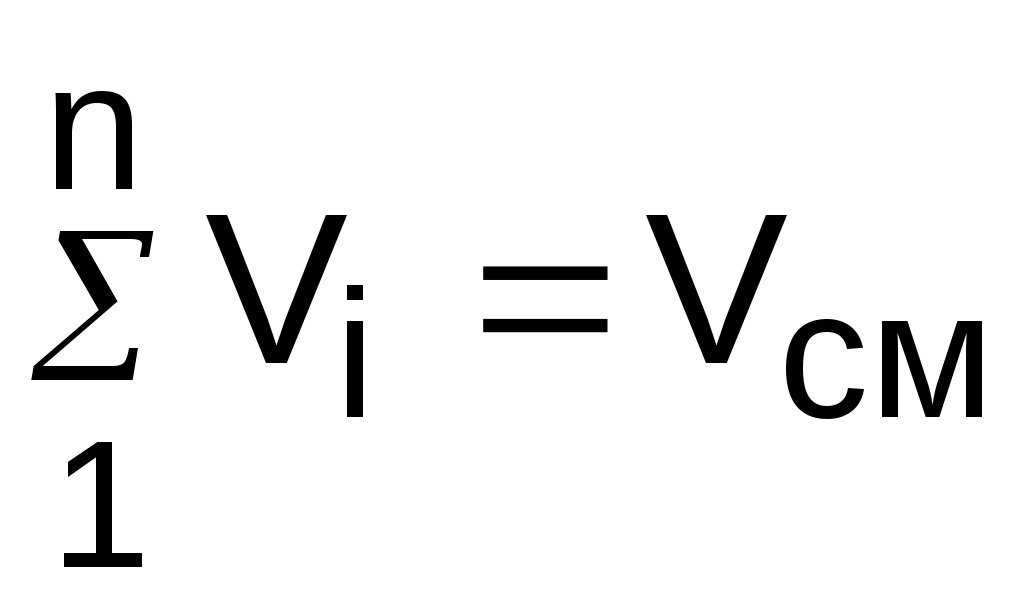 . (3.73)
. (3.73)
Для смеси газов используется понятие мольных долей. Мольной долей называется отношение количества молей данного газа Мi к общему количеству молей всех газов смеси Мсм.
Количество молей определяется делением массы газа на его молярную массу:
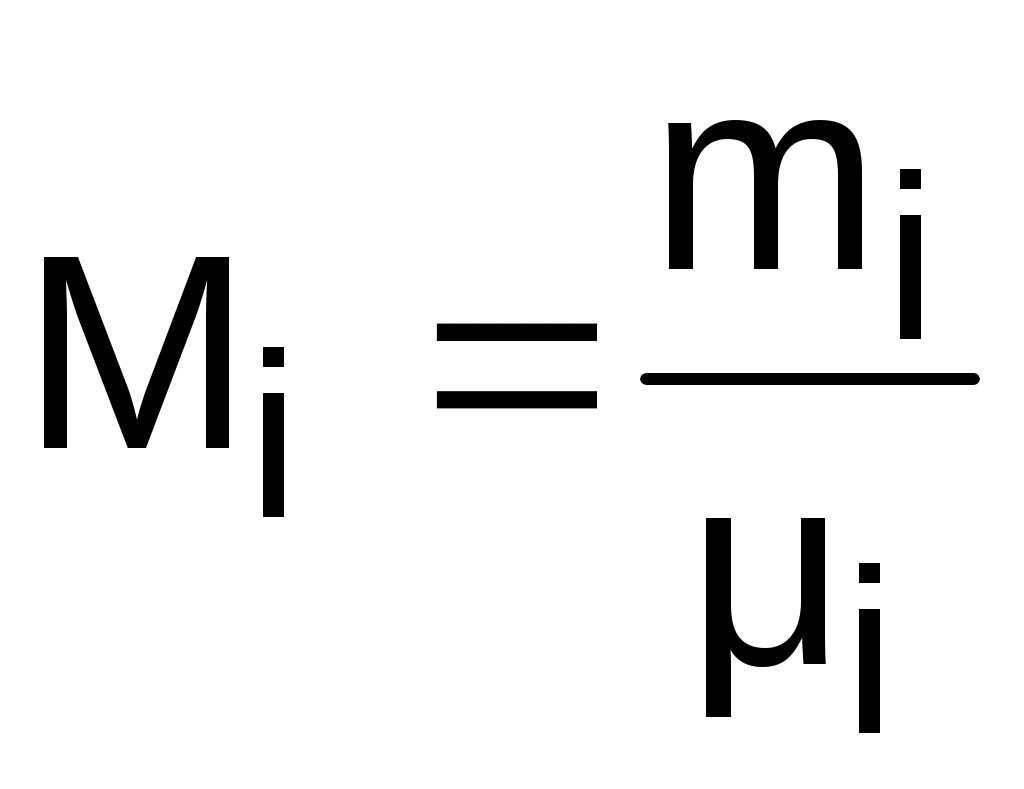 . (3.74)
. (3.74)
Воспользовавшись уравнением Менделеева – Клапейрона для парциального и полного объемов смеси газов и введя в него количество молей
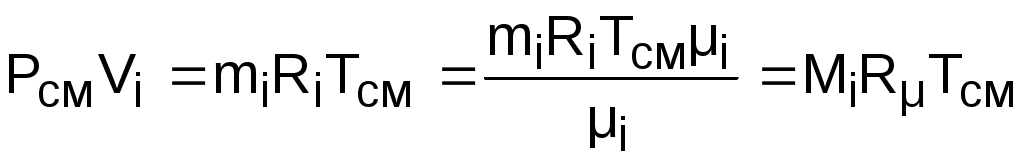 ,
,
 ,
,
получим еще одно расчетное выражение для мольной доли:
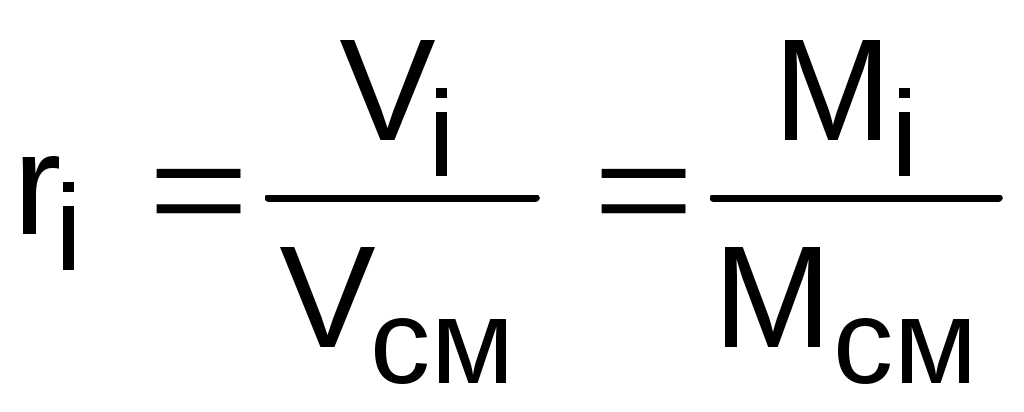 . (3.75)
. (3.75)
Равенство объемных и мольных долей для смеси газов можно получить и из закона Авогадро, в соответствии с которым объемы молей всех идеальных газов при одинаковых параметрах одинаковы, т.е. число молей при одинаковых параметрах идеальных газов прямо пропорционально полным объемам этих газов: Vi=Vi/Мi=Vсм/Мсм=Vсм.
Существует взаимосвязь массовых и объемных долей смеси. Ее несложно получить, выразив массы газов через произведение их объемов на плотности, а отношение плотностей при одинаковых параметрах, в соответствии с законом Авогадро, заменив отношением молекулярных масс:
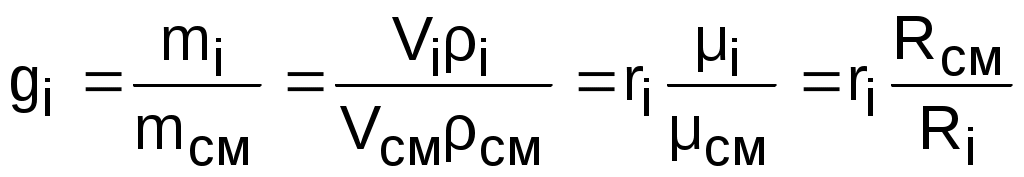 . (3.76)
. (3.76)
Уравнение (3.76) позволяет получить расчетные выражения для молярной массы и газовой постоянной смеси газов на основании равенства единице суммы массовых и объемных долей всех газов данной смеси:
h - ho = h - 0 = cp(T-0) или h = cpT . (3.56)
Абсолютные значения энтальпий по выражениям (3.55) и (3.56) при одинаковых температурах будут разные, но разница энтальпий в одинаковом интервале температур будет одинаковой:
h2 - h1 = cp(t2-t1) = cp(T2-T1) . (3.57)
Таким образом, в расчетах абсолютного значения энтальпии основным требованием является необходимость выбора одинаковых параметров для принятия начала отсчета внутренней энергии и энтальпии. Для идеального газа начало отсчета энтальпии и внутренней энергии фиксируется только температурой.
При расчете разности энтальпий выбор параметров начала отсчета энтальпии никакой роли не играет. Поэтому, если сразу рассчитывается разность энтальпий (выражение (3.55), то параметры начала отсчета энтальпии вообще не нужны, если разница энтальпий определяется через их абсолютные значения h2 - h1, то они должны иметь одинаковые (любые) параметры начала их отсчета.
3.1.4. Энтропия идеальных газов
Для получения расчетного выражения изменения энтропии идеальных газов воспользуемся первым законом термодинамики, в котором теплота определяется с использованием изменения энтальпии:
Для идеального газа изменение энтальпии определяется как dh=cpdT, а удельный объем v = RT/P. Подставив данные выражения изменения энтальпии и удельного объема в уравнение (3.58), получим уравнение для изменения энтропии идеального газа:
Разность энтропий идеального газа в конкретных точках можно получить интегрированием выражения (3.59):
Воспользовавшись формулой Майера сp=сv+R и уравнением Менделеева – Клапейрона Pv=RT, выражение (3.60) можно записать и через две другие пары термических параметров состояния:
Для определения абсолютного значения энтропии идеального газа необходимо зафиксировать начало ее отсчета любой парой термических параметров состояния. Например, приняв s
о=0 при То и Ро, воспользовавшись уравнением (3.60), получим
Выражение (3.62) свидетельствует о том, что энтропия идеального газа есть параметр состояния, поскольку ее можно определить через любую пару параметров состояния. В свою очередь, поскольку энтропия сама является параметром состояния, используя ее в паре с любым независимым параметом состояния, можно определить любой другой параметр состояния газа.
3.2. Газовые смеси
В практической деятельности чаще всего имеют дело не с однородными газами, а с их смесями (воздух, продукты сгорания топлива, горючие газовые смеси и т.п.). Поэтому в теплотехнике газовые смеси имеют важное значение.
В объеме, занимаемом газовой смесью, каждый газ, входящий в эту смесь, ведет себя так же, как вел бы себя при отсутствии других составляющих смеси: распространяется по всему объему; создает давление (парциальное), определяемое температурой и объемом на единицу его массы; имеет температуру смеси.
Смесь идеальных газов представляет собой идеальный газ, для которого справедливы законы и полученные для идеальных газов зависимости.
Для идеального газа давление определяется выражением (3.1):
Количество молекул, входящих в данную смесь газов, равно сумме молекул газов, составляющих смесь:
nсм = n1 + n2 + ··· + nn . (3.63)
Произведение mw2=2T пропорционально абсолютной температуре газа, а поскольку все газы, входящие в смесь, имеют одинаковую температуру, то справедливо равенство
2T = m1w12 = m2 w22 = ··· = mn wn2 . (3.64)
В соответствии с выражениями (3.63) и (3.64) давление для смеси газов можно представить в виде суммы
где Pi – парциальные давления газов, составляющих смесь.
Уравнение (3.65) представляет математическое выражение закона Дальтона (1807 г.) в соответствии с которым
давление газовой смеси равно сумме парциальных давлений газов, входящих в смесь.
Парциальное давление – это давление, которое создает один из газов, составляющих смесь, при температуре смеси в случае заполнения им всего объема смеси. Парциальное давление – это реально-существующая величина, поскольку каждый отдельный газ в смеси имеет температуру смеси и занимает весь объем смеси. Парциальное давление можно определить из уравнения Менделеева –Клапейрона:
где Vсм – объем, занимаемый всей смесью газов;
mi – масса отдельного газа, входящего в смесь;
Ri– газовая постоянная отдельного газа;
Tсм – температура смеси газов.
Основные характеристики смеси газов
Для того чтобы воспользоваться уравнением Менделеева-Клапейрона для смеси газов
необходимо знать газовую постоянную Rсм и молярную массу (условную) смеси µсм. Для смеси, как для любого идеального газа, эти две величины связаны соотношением Rсм=8314/µсм (Дж/(кг·К)). Чтобы рассчитать эти величины, необходимо знать состав смеси газов, т.е. какие газы и в какой пропорции входят в смесь.
Состав смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей gi данного газа называется отношение его массы к массе всей смеси:
где mi – масса отдельного газа, входящего в смесь;
mсм – общая масса смеси.
Очевидно, что сумма массовых долей всех газов смеси равна единице:
Объeмной долей ri данного газа называется отношение объема, который занимал бы данный газ при температуре и давлении смеси, к общему объему смеси:
где Vi – объем данного газа при Тсм и Рсм, м3.
Объем Vi называют парциальным объемом, это искусственно введенная величина, поскольку каждый газ, входящий в смесь, занимает весь объем смеси. Парциальный объем можно рассчитать по уравнению Менделеева – Клапейрона:
Записав уравнение Менделеева – Клапейрона через парциальное давление и через парциальный объем,
можно получить еще одно расчетное выражение для объемной доли, поделив правые и левые части этих уравнений одно на другое:
Поскольку сумма парциальных давлений равна давлению смеси, то сумма объемных долей всех газов смеси равна единице, а сумма парциальных объемов равна полному объему всей смеси газов:
Для смеси газов используется понятие мольных долей. Мольной долей называется отношение количества молей данного газа Мi к общему количеству молей всех газов смеси Мсм.
Количество молей определяется делением массы газа на его молярную массу:
Воспользовавшись уравнением Менделеева – Клапейрона для парциального и полного объемов смеси газов и введя в него количество молей
получим еще одно расчетное выражение для мольной доли:
Равенство объемных и мольных долей для смеси газов можно получить и из закона Авогадро, в соответствии с которым объемы молей всех идеальных газов при одинаковых параметрах одинаковы, т.е. число молей при одинаковых параметрах идеальных газов прямо пропорционально полным объемам этих газов: Vi=Vi/Мi=Vсм/Мсм=Vсм.
Существует взаимосвязь массовых и объемных долей смеси. Ее несложно получить, выразив массы газов через произведение их объемов на плотности, а отношение плотностей при одинаковых параметрах, в соответствии с законом Авогадро, заменив отношением молекулярных масс:
Уравнение (3.76) позволяет получить расчетные выражения для молярной массы и газовой постоянной смеси газов на основании равенства единице суммы массовых и объемных долей всех газов данной смеси:


