Добавлен: 25.04.2024
Просмотров: 298
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
1.1. Характеристика целевого продукта
1.1.2 Химические свойства и применение
1.1.3 Способы получения серной кислоты
1.1.4 Применение серной кислоты
1.2 Характеристика исходного сырья и материалов
1.4 Описание технологического процесса
2. МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ БАЛАНС ПЕЧИ ДЛЯ ОБЖИГА ЖЕЛЕЗНОГО КОЛЧЕДАНА
2.1. Расчет материального баланса печи для обжига КС-450
Федеральное государственное бюджетное образовательное учреждение
«Саратовский государственный технический университет
имени Гагарина Ю.А.»
Физико-технический институт
Кафедра «Химия и химическая технология материалов»
Курсовая работа
на тему: «Синтез и анализ ХТС в производстве серной кислоты»
по дисциплине: «Общая химическая технология»
| | Выполнила: студентка ФТИ гр.б-ХМТН-31 очной формы обучения № зачетной книжки 172511 Ялымова Алина Евгеньевна __________________ (подпись) Проверил: Научный руководитель: доктор химических наук, профессор Ефанова Вера Васильевна ____________________ (подпись) |
172511_б-ХМТН-31_2020_19
Саратов 2020
Федеральное государственное бюджетное образовательное учреждение
«Саратовский государственный технический университет
имени Гагарина Ю.А.»
Физико-технический институт
Кафедра «Химия и химическая технология материалов»
ЗАДАНИЕ
на выполнение курсовой работы
по дисциплине: «Общая химическая технология»
студентки группы б-ХМТН-31 Ялымовой Алины Евгеньевны.
В курсовой работе необходимо:
-
Произвести анализ производства серной кислоты -
Рассчитать материальный и тепловой балансы процесса производства серной кислоты.
Дата выдачи: _____________
Срок выполнения _________
Руководитель: ____________
Студентка: Ялымова А.Е.
АННОТАЦИЯ
Работа состоит из 34 страницы, содержит 6 рисунков и 6 таблиц. Также работа включает в себя 2 главы. В первой содержится 4 параграфа. Первый параграф включает в себя 4 пункта. Во второй главе содержится 2 параграфа.
В первой главе приводится характеристика целевого продукта, его физические и химические свойства, способы получения и применение, представлена подробная характеристика исходного сырья и материалов, описаны технологические схемы производства целевого продукта и технологического процесса получения целевого продукта.
Во второй главе проведены расчеты материального баланса и теплового балансов печи для обжига железного колчедана КС-450.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ 5
1. ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ 8
1.1. Характеристика целевого продукта 8
1.1.1 Физические свойства 8
1.1.2 Химические свойства и применение 9
1.1.3 Способы получения серной кислоты 11
1.1.4 Применение серной кислоты 12
1.2 Характеристика исходного сырья и материалов 15
1.3 Технологическая схема производства целевого продукта 18
1.4 Описание технологического процесса 26
2. МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ БАЛАНС ПЕЧИ ДЛЯ ОБЖИГА ЖЕЛЕЗНОГО КОЛЧЕДАНА 30
2.1. Расчет материального баланса печи для обжига КС-450 30
2.2. Расчет теплового баланс печи обжига КС-450 34
ЗАКЛЮЧЕНИЕ 37
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ 38
ВВЕДЕНИЕ
Серная кислота – важнейший продукт основной химической промышленности. Среди минеральных кислот она по объему производства и потребления занимает первое место, поэтому изучение свойств и методов получения серной кислоты весьма актуально.
Серную кислоту применяют в различных отраслях народного хозяйства, поскольку она обладает комплексом особых свойств, облегчающих ее технологическое использование. Серная кислота не дымит, в концентрированном виде не коррозирует черные металлы, способна образовывать многочисленные устойчивые соли и является дешевым сырьем для различных производств.
Крупнейшим потребителем серной кислоты в настоящее время является промышленность фосфорных и азотных минеральных удобрений, таких как сульфат аммония, аммофос, суперфосфат и др. Простой суперфосфат получают обработкой апатитов и фосфоритов серной кислотой. Применение минеральных удобрений способствует повышению урожайности сельскохозяйственных культур и содержанию в них полезных веществ.
Кроме того, серная кислота применяется для производства некоторых кислот (фосфорной, соляной, уксусной), сульфатов, искусственных волокон, лаков, красок, пластмасс, моющих средств, взрывчатых веществ, лекарственных препаратов, ядохимикатов, а также при производстве цветных и редких металлов, спиртов, эфиров. Она расходуется на очистку нефтепродуктов, в качестве электролита в кислотных аккумуляторах, в машиностроении – на подготовку поверхности металлов при нанесении гальванических покрытий. В металлообрабатывающей промышленности серная кислота и ее соли применяют для травления стальных изделий.
Мировое производство серной кислоты за последние пять лет выросло на 18 % и по итогам 2007 г. должно достигнуть 200 млн. тонн, что в денежном выражении составляет около $9 млрд. При этом основной рост мощностей произошел благодаря увеличению производства серной кислоты из элементарной серы и отходящих газов цветной металлургии.
Россия и другие страны бывшего СССР за последние годы также увеличили выпуск серной кислоты. Это обусловлено как растущим спросом со стороны основных потребителей, так и увеличением мощностей продуцентов. Надо отдельно отметить, что для предприятий цветной металлургии серная кислота является побочным продуктом, и с увеличением выпуска цинка и меди идет увеличение производство кислоты.
Целью данной работы является изучение синтеза серной кислоты.
1. ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ
1.1. Характеристика целевого продукта
1.1.1 Физические свойства
Серная кислота (H2SO4) — сильная двухосновная кислота, отвечающая высшей степени окисления серы (S+6). Бесцветная едкая тяжелая маслообразная жидкость без запаха, плотность 1,84г/см3, смешивается с водой в любых соотношениях. Концентрированная серная кислота очень бурно реагирует с водой. По этой причине следует всегда разбавлять серную кислоту, наливая её в воду, а не наоборот. Неразбавленная серная кислота представляет собой ковалентное соединение. Её молекулы имеют тетраэдрическое строение. Эта кислота гигроскопична, то есть способна поглощать влагу из воздуха. Поэтому её используют для осушения газов, не реагирующих с нею, пропуская их через серную кислоту. Безводная серная кислота растворяет до 70% оксида серы(VI). При обычной температуре она не летуча и не имеет запаха. Температура кипения и температура замерзания серной кислоты зависит от ее состава, т.е. от количества воды. С водой она образует три соединения, которые называются кристаллогидратами. Их можно выделить при охлаждении кислоты соответствующей концентрации. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4 называется олеум. Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и содержит около 95 % H2SO4. Затвердевает она лишь ниже ̶ 20 °С. Температура плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (e = 100 при 25 °С). Стандартная энтальпия образования ∆H=298 кДж/моль. Стандартная энергия Гиббса образования ∆G=298 кДж/моль. Стандартная энтропия образования ∆S=298 Дж/моль·K. Стандартная мольная теплоемкость Cp =298 Дж/моль·K.
1.1.2 Химические свойства и применение
Серная кислота - сильная двухосновная кислота, диссоциация ее протекает по двум ступеням:
первая ступень: H
2SO4 = H+ + HSO4-
вторая ступень: HSO4 =H+ + SO42-
В концентрированных растворах диссоциация серной кислоты по второй ступени незначительна.
Серная кислота ̶ сильнейшее дегидратирующее (водоотнимающее) вещество. Она поглощает влагу из воздуха (гигроскопична), отнимает воду от кристаллогидратов:
-
H2SO4конц. + CuSO4 5H2O = CuSO4 + 5H2O
5H2O = CuSO4 + 5H2O
углеводов: обугливает дерево и бумагу
-
H2SO4конц. + C12H22O = 12C + 11H2O
спиртов:
-
H2SO4конц. + C2H5OH = CH2=CH2 + H2O
Серная кислота проявляет все свойства сильных кислот:
взаимодействует с основными оксидами, например:
-
CuO + H2SO4 = CuSO4 + H2O
с основаниями, например:
-
2NaOH + H2SO4 = Na2 SO4 + 2H2O
вытесняет другие кислоты из их солей, например те, которые слабее нее:
-
CaCO3 + H2SO4 = CaSO4 + CO2 + H2O
или более летучие (обладающие температурами кипения ниже, чем у серной кислоты):
-
NaNO3тв + H2SO4конц = NaHSO4 + HNO3 (при нагревании)
В окислительно-восстановительных реакциях разбавленная серная кислота проявляет свойства обычной кислоты (не окислитель) — при этом восстанавливаются ионы Н+, например:
-
Fe + H2SO4разб= FeSO4 + H2
Разбавленная H2SO4 не взаимодействует с металлами, стоящими в ряду напряжений правее водорода. Концентрированная серная кислота ̶ кислота-окислитель, при этом восстанавливается сера (S+6). Она окисляет металлы, стоящие в ряду напряжений правее водорода:
-
Cu + H2SO4конц = CuSO4 + SO2 + 2H2O
и металлы, стоящие левее водорода, при этом сера восстанавливается до степени окисления +4, 0 и -2:
-
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O -
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O -
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Железо, алюминий, хром концентрированной серной кислотой пассивируются (не реагируют), однако при сильном нагревании реакция начинается, например:
-
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
Концентрированная серная кислота окисляет неметаллы, например:
-
C + 2H2SO4= CO2 + 2SO2 + 2H2O -
S + 2H2SO4= 3SO2 + 2H2O
Концентрированная серная кислота окисляет также сложные вещества, например, HI и HBr:
-
2HBr + H2SO4 = Br2 + SO2 + 2H2O -
8HI + H2SO4 = 4I2 + H2S + 4H2O
а также соли железа:
-
2FeSO4 + 2H2SO4 = Fe2(SO4)3 + 2H2O + SO2.
Серную кислоту выпускают нескольких сортов. Они отличаются концентрацией и количеством примесей. Для производства медицинских препаратов, особо чистых реактивов, для заливки аккумуляторов требуется чистая кислота. При травлении металлов, в производстве суперфосфата можно воспользоваться кислотой, имеющей некоторые загрязнения. Экономически это выгодно, потому что такая кислота более дешевая.
Сернокислотная промышленность выпускает так называемый олеум, используемый при производстве некоторых органических препаратов, взрывчатых веществ. Олеум представляет собой раствор серного ангидрида в серной кислоте. Сорта олеума различаются по концентрации серного ангидрида в серной кислоте. Для некоторых особых целей выпускают олеум, содержащий серного ангидрида до 60%. Так, кислота серная техническая и олеум технический (ГОСТ 2184-77) применяются в производстве различных солей, кислот, всевозможных органических продуктов, красителей, взрывчатых веществ, минеральных удобрений, в качестве водоотнимающего и осушающего средства, в процессах нейтрализации, травления и многих других. Эти продукты не горючи и относятся к веществам 2-го класса токсичности.
1.1.3 Способы получения серной кислоты
Еще в XIII в. серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4, поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса. В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце XIX и начале XX в. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты. В контактном методе получения серной кислоты процесс окисления SO2 в SO3 проводят на твердых катализаторах. Триоксид серы переводят в серную кислоту на последней стадии процесса ̶ абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SO3 + H2O = H2SO4
При проведении процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота. Окисление в жидкой фазе и конечным продуктом является серная кислота:
SO2 + N2O3 + H2O = H2SO4 + 2NO
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
1.1.4 Применение серной кислоты
Серная кислота находит самое широкое применение (рис - 1.1.)
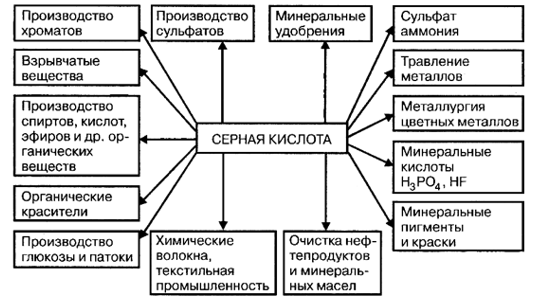
Рисунок - 1.1 Применение серной кислоты
Самый крупный потребитель серной кислоты ̶ производство минеральных удобрений. На 1 т Р2О5 фосфорных удобрений расходуется 2,2 ̶ 3,4 т серной кислоты, а на 1 т (NH4)2SO4 — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Серная кислота также используется для получения соляной, азотной, фосфорной, плавиковой и многих органических кислот методом обмена, органических сульфосоединений, для очистки различных газов, входит в состав нитрующих смесей


