Добавлен: 25.04.2024
Просмотров: 304
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
1.1. Характеристика целевого продукта
1.1.2 Химические свойства и применение
1.1.3 Способы получения серной кислоты
1.1.4 Применение серной кислоты
1.2 Характеристика исходного сырья и материалов
1.4 Описание технологического процесса
2. МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ БАЛАНС ПЕЧИ ДЛЯ ОБЖИГА ЖЕЛЕЗНОГО КОЛЧЕДАНА
2.1. Расчет материального баланса печи для обжига КС-450
, используется в производстве красителей, для зарядки аккумуляторов, в металлургии серную кислоту применяют для обнаружения микротрещин в готовой продукции, на металлообрабатывающих заводах серную кислоту используют в цехах гальванопокрытий.
Как известно, перед нанесением на металлические изделия электрическим методом никеля, хрома, меди их нужно тщательно очистить, протереть, обезжирить и, наконец, выдержать непродолжительное время в ванне с раствором серной кислоты. При этом она растворяет тончайший слой металла и с ним удаляются следы загрязнений. В то же время поверхность металла становится более шершавой: на ней появляются микроскопические углубления и выступы. Электролитические покрытия к такой поверхности лучше пристают и более прочно сцеплены с металлом.
Также серная кислота необходима для переработки различных руд и ископаемых. При переработке руд редких металлов большое значение имеет кислотный способ их расщепления. Обычно для этой цели используют наиболее дешевую нелетучую серную кислоту. Измельченную руду смешивают в определенной пропорции с серной кислотой и нагревают. Полученный раствор и осадок дальше перерабатывают химическим путем, исходя из химических свойств того элемента, который нужно выделить из раствора. На химическую переработку руд редких элементов расходуют тысячи тонн серной кислоты.
Большое количество серной кислоты требуется нефтеперерабатывающей промышленности для очистки нефти и ее различных фракций. В органическом синтезе концентрированная серная кислота ̶ необходимый компонент при получении многих красителей и лекарственных веществ.
Широко применяются соли серной кислоты. Сульфат натрия (глауберова соль Nа2SO4 10Н2О) применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4
10Н2О) применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4 2Н2О) и безводной соли ангидрита (СаSO4). Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600 ̶ 700оС) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а
2Н2О) и безводной соли ангидрита (СаSO4). Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600 ̶ 700оС) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а
также искусственного мрамора, бесшовных настилов полов и др.
Сульфат магния, или горькая соль (МgSO4 7Н2О) применяется в медицине как слабительное. Сульфат железа (II) или железный купорос (FеSO4
7Н2О) применяется в медицине как слабительное. Сульфат железа (II) или железный купорос (FеSO4 7Н2О) применяется для приготовления желтой кровяной соли (К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева. Сульфат меди, или медный купорос (СuSO4
7Н2О) применяется для приготовления желтой кровяной соли (К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева. Сульфат меди, или медный купорос (СuSO4 5Н2О) применяется для борьбы с различными грибками - вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди.
5Н2О) применяется для борьбы с различными грибками - вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди.
Из растворов, содержащих сульфат трехвалентного металла (Fе3+, Аl3+, Сг3+) и сульфат одновалентного металла (К+, NН4+, Rb+), выкристаллизовываются двойные соли типа К2SO4Al2(SO4)3 4H2O или КАl(SO4)3
4H2O или КАl(SO4)3 12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как две самостоятельные соли, то есть как смесь сульфатов одно- и трехвалентных металлов.
12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как две самостоятельные соли, то есть как смесь сульфатов одно- и трехвалентных металлов.
Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В электротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту применяют как компонент реакционной среды в процессах нитрования, в частности, при получении взрывчатых веществ.
Сырьевая база производства серной кислоты — серосодержащие соединения, из которых можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного (серного) колчедана. Сера содержится и в сероводороде, получающемся при коксовании угля или содержащемся в генераторном газе, газах нефтепереработки, попутных нефтяных газах и природном газе, газах нефтепереработки, попутных нефтяных газах и природном газе. Иногда для производства серной кислоты используют отходы некоторых производств, применяющих серную кислоту. Это кислые гудроны, травильные растворы, фосфогипс и др.
Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии. Отходящие газы ̶ наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Около половины серной кислоты получают из серы, треть - из колчедана. Встречается соединение серы с двумя металлами, например, с медью и железом (халькопирит). Серу содержат сульфаты: гипс (сульфат кальция), мирабилит (сульфат натрия), глауберит (сульфат натрия и кальция) и др. Сера есть в угле, нефти, горючих и топочных газах. В разных странах соотношение различных видов сырья, применяемого для производства серной кислоты, неодинаково. Большинство стран в качестве основного сырья использует серный колчедан, в США серную кислоту получают преимущественно из серы. Следует, однако, отметить, что доля колчедана в общем балансе серосодержащего сырья уменьшается из-за все более широкого использования серы. Основные залежи серного колчедана имеются в России (главным образом на Урале), Испании, Японии, Канаде, Индии, Португалии, Италии, Норвегии.
Серный колчедан FeS2 содержит 53,4% S и 46,6% Fe. Существуют следующие сорта колчедана: рядовой, флотационный и пиритный концентрат. Рядовой колчедан добывают в рудниках в виде кусков размером 50 ̶ 400 мм.
Флотационный колчедан получается, как отход при флотационном обогащении руд, содержащихся в качестве примесей к рядовому колчедану. Флотацию проводят во флотационных машинах различного типа. Процесс флотации заключается в смешивании раздробленного колчедана с водой и флотореагентами ̶ пенообразующими веществами (деготь, хвойные масла и др.) и продувании воздуха. Гидрофобные частицы отделяемой примеси колчедана (например, медь) прилипают к воздушным пузырькам и всплывают с ними (это концентрат), а колчедан осаждается на дно (флотационный колчедан, или флотохвосты). Вторичная флотация флотохвостов с применением другого флотореагента дает пиритный концентрат. Пиритный концентрат часто называют тоже флотационным колчеданом. Перед отправкой потребителю флотационный колчедан высушивают до содержания в нем влаги 3,8%.
Серный колчедан может содержать примеси соединений меди, цинка, свинца, мышьяка, никеля, кобальта, селена, висмута, теллура, кадмия, карбонаты и сульфаты кальция и магния, а также золото и серебро. Содержание селена составляет до 220 г/т, золота до 4 г/т, серебра до 40 г/т, мышьяка до 0,4%, фтора до 0,02%. Флотационный колчедан содержит те же примеси, но в меньших концентрациях. Средние данные о химическом составе флотационного колчедана, поступающего на сернокислотные заводы (таблица 1.1):
Таблица 1.1 Химический состав флотационного колчедана
Продолжение таблицы 1.1
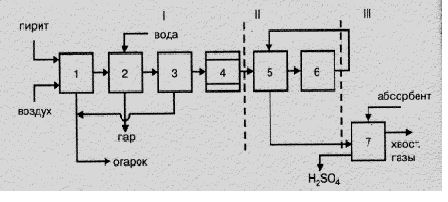
Технологический процесс производства серной кислоты из элементарной серы контактным способом отличается от процесса производства из колчедана рядом особенностей:
-особая конструкция печей для получения печного газа;
-повышенное содержание оксида серы (IV) в печном газе;
-отсутствие стадии предварительной очистки печного газа.
П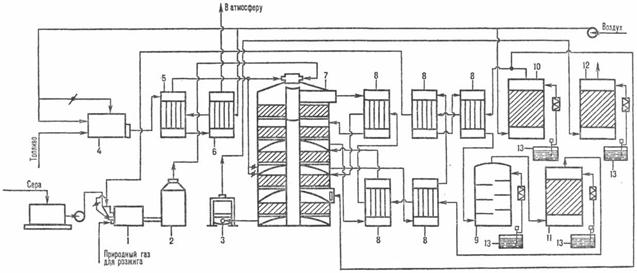
роизводство серной кислоты из серы по методу двойного контактирования и двойной абсорбции (рис. 1.2) состоит из нескольких стадий:
1 — серная печь; 2 — котел-утилизатор; 3 — экономайзер; 4 — пусковая топка; 5, 6 — теплообменники пусковой топки; 7 — контактный аппарат; 8 — теплообменники; 9 — олеумный абсорбер; 10 — сушильная башня; 11, 12 — соотв. первый и второй моногидратные абсорберы; 13 — сборники кислоты.
Рисунок 1.2 - Схема производства серной кислоты из серы по методу ДК-ДА
Воздух после очистки от пыли подается газодувкой в сушильную башню, где он осушается 93-98 %-ной серной кислотой до содержания влаги 0,01% по объему; Осушенный воздух поступает в серную печь после предварительного подогрева в одном из теплообменников контактного узла.
Сжигание (горение) серы представляет собой гомогенную экзотермическую реакцию, которой предшествуют переход твердой серы в жидкое состояние и ее последующее испарение:
Sтв→ Sж → Sпap
Таким образом, процесс горения протекает в газовой фазе в потоке предварительно высушенного воздуха и описывается уравнением:
S + О2 → SO2 + 297,028 кДж;
Для сжигания серы используют печи форсуночного и циклонного типов. В форсуночных печах расплавленная сера распыляется в камере сгорания сжатым воздухом через форсунки, которые не могут обеспечить достаточно полного перемешивания паров серы с воздухом и необходимой скорости горения. В циклонных печах, работающих по принципу центробежных пылеуловителей (циклонов), достигается значительно лучшее смешивание компонентов и обеспечивается более высокая интенсивность горения серы, чем в форсуночных печах. Газ, содержащий 10 ̶ 14 % по объему SO2, охлаждается в котле и после разбавления воздухом до содержания SO2 9 ̶ 10 % по объему при 420°С поступает в контактный аппарат на первую стадию конверсии, которая протекает на трех слоях катализатора
(SO2+V2O2→SO3+96,296 кДж), после чего газ охлаждается в теплообменниках;
Затем газ, содержащий 8,5 ̶ 9,5% SO3, при 200°С поступает на первую стадию абсорбции в абсорбер, орошаемый олеумом и 98%-ной серной кислотой:
SO3 + Н2О → H2SO4 +130,56 кДж;
Далее газ проходит очистку от брызг серной кислоты, нагревается до 420°С и поступает на вторую стадию конверсии, протекающую на двух слоях катализатора. Перед второй стадией абсорбции газ охлаждается в экономайзере и подается в абсорбер второй ступени, орошаемый 98%-ной серной кислотой, и затем после очистки от брызг выбрасывается в атмосферу.
Печной газ при сжигании серы отличается более высоким содержанием оксида серы (IV) и не содержит большого количества пыли. При сжигании самородной серы в нем также полностью отсутствуют соединения мышьяка и селена, являющиеся каталитическими ядами.
Как известно, перед нанесением на металлические изделия электрическим методом никеля, хрома, меди их нужно тщательно очистить, протереть, обезжирить и, наконец, выдержать непродолжительное время в ванне с раствором серной кислоты. При этом она растворяет тончайший слой металла и с ним удаляются следы загрязнений. В то же время поверхность металла становится более шершавой: на ней появляются микроскопические углубления и выступы. Электролитические покрытия к такой поверхности лучше пристают и более прочно сцеплены с металлом.
Также серная кислота необходима для переработки различных руд и ископаемых. При переработке руд редких металлов большое значение имеет кислотный способ их расщепления. Обычно для этой цели используют наиболее дешевую нелетучую серную кислоту. Измельченную руду смешивают в определенной пропорции с серной кислотой и нагревают. Полученный раствор и осадок дальше перерабатывают химическим путем, исходя из химических свойств того элемента, который нужно выделить из раствора. На химическую переработку руд редких элементов расходуют тысячи тонн серной кислоты.
Большое количество серной кислоты требуется нефтеперерабатывающей промышленности для очистки нефти и ее различных фракций. В органическом синтезе концентрированная серная кислота ̶ необходимый компонент при получении многих красителей и лекарственных веществ.
Широко применяются соли серной кислоты. Сульфат натрия (глауберова соль Nа2SO4
 10Н2О) применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4
10Н2О) применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4 2Н2О) и безводной соли ангидрита (СаSO4). Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600 ̶ 700оС) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а
2Н2О) и безводной соли ангидрита (СаSO4). Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600 ̶ 700оС) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а
также искусственного мрамора, бесшовных настилов полов и др.
Сульфат магния, или горькая соль (МgSO4
 7Н2О) применяется в медицине как слабительное. Сульфат железа (II) или железный купорос (FеSO4
7Н2О) применяется в медицине как слабительное. Сульфат железа (II) или железный купорос (FеSO4 7Н2О) применяется для приготовления желтой кровяной соли (К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева. Сульфат меди, или медный купорос (СuSO4
7Н2О) применяется для приготовления желтой кровяной соли (К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева. Сульфат меди, или медный купорос (СuSO4 5Н2О) применяется для борьбы с различными грибками - вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди.
5Н2О) применяется для борьбы с различными грибками - вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди. Из растворов, содержащих сульфат трехвалентного металла (Fе3+, Аl3+, Сг3+) и сульфат одновалентного металла (К+, NН4+, Rb+), выкристаллизовываются двойные соли типа К2SO4Al2(SO4)3
 4H2O или КАl(SO4)3
4H2O или КАl(SO4)3 12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как две самостоятельные соли, то есть как смесь сульфатов одно- и трехвалентных металлов.
12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как две самостоятельные соли, то есть как смесь сульфатов одно- и трехвалентных металлов. Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В электротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту применяют как компонент реакционной среды в процессах нитрования, в частности, при получении взрывчатых веществ.
1.2 Характеристика исходного сырья и материалов
Сырьевая база производства серной кислоты — серосодержащие соединения, из которых можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного (серного) колчедана. Сера содержится и в сероводороде, получающемся при коксовании угля или содержащемся в генераторном газе, газах нефтепереработки, попутных нефтяных газах и природном газе, газах нефтепереработки, попутных нефтяных газах и природном газе. Иногда для производства серной кислоты используют отходы некоторых производств, применяющих серную кислоту. Это кислые гудроны, травильные растворы, фосфогипс и др.
Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии. Отходящие газы ̶ наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Около половины серной кислоты получают из серы, треть - из колчедана. Встречается соединение серы с двумя металлами, например, с медью и железом (халькопирит). Серу содержат сульфаты: гипс (сульфат кальция), мирабилит (сульфат натрия), глауберит (сульфат натрия и кальция) и др. Сера есть в угле, нефти, горючих и топочных газах. В разных странах соотношение различных видов сырья, применяемого для производства серной кислоты, неодинаково. Большинство стран в качестве основного сырья использует серный колчедан, в США серную кислоту получают преимущественно из серы. Следует, однако, отметить, что доля колчедана в общем балансе серосодержащего сырья уменьшается из-за все более широкого использования серы. Основные залежи серного колчедана имеются в России (главным образом на Урале), Испании, Японии, Канаде, Индии, Португалии, Италии, Норвегии.
Серный колчедан FeS2 содержит 53,4% S и 46,6% Fe. Существуют следующие сорта колчедана: рядовой, флотационный и пиритный концентрат. Рядовой колчедан добывают в рудниках в виде кусков размером 50 ̶ 400 мм.
Флотационный колчедан получается, как отход при флотационном обогащении руд, содержащихся в качестве примесей к рядовому колчедану. Флотацию проводят во флотационных машинах различного типа. Процесс флотации заключается в смешивании раздробленного колчедана с водой и флотореагентами ̶ пенообразующими веществами (деготь, хвойные масла и др.) и продувании воздуха. Гидрофобные частицы отделяемой примеси колчедана (например, медь) прилипают к воздушным пузырькам и всплывают с ними (это концентрат), а колчедан осаждается на дно (флотационный колчедан, или флотохвосты). Вторичная флотация флотохвостов с применением другого флотореагента дает пиритный концентрат. Пиритный концентрат часто называют тоже флотационным колчеданом. Перед отправкой потребителю флотационный колчедан высушивают до содержания в нем влаги 3,8%.
Серный колчедан может содержать примеси соединений меди, цинка, свинца, мышьяка, никеля, кобальта, селена, висмута, теллура, кадмия, карбонаты и сульфаты кальция и магния, а также золото и серебро. Содержание селена составляет до 220 г/т, золота до 4 г/т, серебра до 40 г/т, мышьяка до 0,4%, фтора до 0,02%. Флотационный колчедан содержит те же примеси, но в меньших концентрациях. Средние данные о химическом составе флотационного колчедана, поступающего на сернокислотные заводы (таблица 1.1):
Таблица 1.1 Химический состав флотационного колчедана
| Компоненты | Содержание, % | Компоненты | Содержание, г/т |
| Сера | 40-45 | Золото | 1-5 |
| Железо | 35-39 | Серебро | 20-25 |
Продолжение таблицы 1.1
| Медь | 0,3-0,5 | Кадмий | 5,5-8,1 |
| Свинец | 0,01-0,2 | Кобальт | 50-200 |
| Цинк | 0,5-0,6 | Селен | 30-60 |
| Мышьяк | 0,07-0,09 | Теллур | 25-40 |
| SiО2 | 14-18 | - | - |
| Н2О | 3,8 | - | - |
1.3 Технологическая схема производства целевого продукта
Технологический процесс производства серной кислоты из элементарной серы контактным способом отличается от процесса производства из колчедана рядом особенностей:
-особая конструкция печей для получения печного газа;
-повышенное содержание оксида серы (IV) в печном газе;
-отсутствие стадии предварительной очистки печного газа.
П

роизводство серной кислоты из серы по методу двойного контактирования и двойной абсорбции (рис. 1.2) состоит из нескольких стадий:
1 — серная печь; 2 — котел-утилизатор; 3 — экономайзер; 4 — пусковая топка; 5, 6 — теплообменники пусковой топки; 7 — контактный аппарат; 8 — теплообменники; 9 — олеумный абсорбер; 10 — сушильная башня; 11, 12 — соотв. первый и второй моногидратные абсорберы; 13 — сборники кислоты.
Рисунок 1.2 - Схема производства серной кислоты из серы по методу ДК-ДА
Воздух после очистки от пыли подается газодувкой в сушильную башню, где он осушается 93-98 %-ной серной кислотой до содержания влаги 0,01% по объему; Осушенный воздух поступает в серную печь после предварительного подогрева в одном из теплообменников контактного узла.
Сжигание (горение) серы представляет собой гомогенную экзотермическую реакцию, которой предшествуют переход твердой серы в жидкое состояние и ее последующее испарение:
Sтв→ Sж → Sпap
Таким образом, процесс горения протекает в газовой фазе в потоке предварительно высушенного воздуха и описывается уравнением:
S + О2 → SO2 + 297,028 кДж;
Для сжигания серы используют печи форсуночного и циклонного типов. В форсуночных печах расплавленная сера распыляется в камере сгорания сжатым воздухом через форсунки, которые не могут обеспечить достаточно полного перемешивания паров серы с воздухом и необходимой скорости горения. В циклонных печах, работающих по принципу центробежных пылеуловителей (циклонов), достигается значительно лучшее смешивание компонентов и обеспечивается более высокая интенсивность горения серы, чем в форсуночных печах. Газ, содержащий 10 ̶ 14 % по объему SO2, охлаждается в котле и после разбавления воздухом до содержания SO2 9 ̶ 10 % по объему при 420°С поступает в контактный аппарат на первую стадию конверсии, которая протекает на трех слоях катализатора
(SO2+V2O2→SO3+96,296 кДж), после чего газ охлаждается в теплообменниках;
Затем газ, содержащий 8,5 ̶ 9,5% SO3, при 200°С поступает на первую стадию абсорбции в абсорбер, орошаемый олеумом и 98%-ной серной кислотой:
SO3 + Н2О → H2SO4 +130,56 кДж;
Далее газ проходит очистку от брызг серной кислоты, нагревается до 420°С и поступает на вторую стадию конверсии, протекающую на двух слоях катализатора. Перед второй стадией абсорбции газ охлаждается в экономайзере и подается в абсорбер второй ступени, орошаемый 98%-ной серной кислотой, и затем после очистки от брызг выбрасывается в атмосферу.
Печной газ при сжигании серы отличается более высоким содержанием оксида серы (IV) и не содержит большого количества пыли. При сжигании самородной серы в нем также полностью отсутствуют соединения мышьяка и селена, являющиеся каталитическими ядами.



