Файл: Блок i организационнопрововые основы судебномедицинской деятельности в рф. Порядок и проведение судебно медицинских и химикотоксикологических исследований.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 18
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Во втором дистилляте обычно содержатся вещества средней летучести.
Внешний вид дистиллята: бесцветная жидкость с запахом спирта.
Качественный анализ (обнаружение).
1.ГЖХ (основной метод)
Газожидкостная хроматография основана на физико-химическом разделении анализируемых компонентов, находящихся в газовой фазе, при их прохождении вдоль нелетучей жидкости, нанесенной на твердый сорбент.
Методика. 5 мл дистиллята помещают в пенициллиновый флакон, закрывают резиновой пробкой, которую фиксируют с помощью зажима. Флакон нагревают на водяной бане в течении 10 мин для перевода определяемого вещества (этанола) в паро – газовую фазу. 0,5 мл паро – газовой смеси вносят в колонку хроматографа.
Обнаружение этанола проводят по соответствующим параметрам удерживания.
Время удерживания на колонке характерно для каждого из разделяемых веществ, поэтому служит качественной характеристикой вещества. Исправленное время удерживания рассчитывается как разность абсолютного времени удерживания вещества и времени удерживания несорбируемого компонента:
t испр = t абс – t н.к.
Удерживаемый объем также является качественной характеристикой анализируемого вещества. Удерживаемый объем V – это объем газа-носителя, необходимый для вымывания всего количества вещества из колонки, который численно равен произведению скорости газа – носителя U на время удерживания t:
V = U · t
Скорость газа измеряется в мл/мин, время удерживания – в минутах.
Если на хроматограмме появляется пик, параметры удерживания которого (время удерживание, расстояние удерживания, объем удерживания) должны совпасть с параметрами удерживания этанола проводят подтверждающие реакции.
2. Химические реакции (подтверждающие).
2.1. Реакция образования йодоформа.
В качестве реактивов применяют раствор гидроксида натрия, раствор иода и реакцию проводят при нагревании. При наличии этанола ощущается запах иодоформа, а при больших количествах этанола образуется желтый осадок. Предел обнаружения – 0,04 мг/мл.
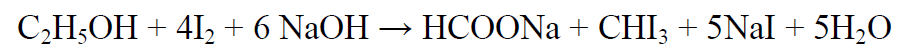
Методика выполнения реакции образования иодоформа: в пробирку вносят 1 мл исследуемого раствора и 2 мл 5%-го раствора гидроксида натрия или карбоната натрия. К этой смеси по каплям прибавляют 1%-й раствор иода в 2%-м растворе иодида калия до слабо-желтой окраски. Затем смесь несколько минут нагревают на водяной бане (50 °С). При наличии этилового спирта ощущается запах йодоформа
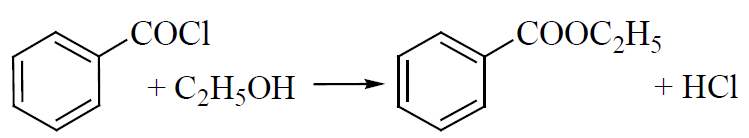
2.2. Реакция этерификации. Для получения этиловых эфиров, имеющих характерный запах, применяют бензоилхлорид и ацетат натрия.
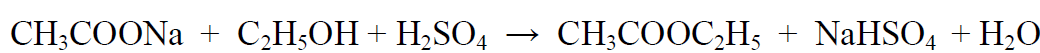
Методика выполнения реакции образования этилацетата: в пробирку вносят 1 мл исследуемого раствора и 0,1 г высушенного ацетата натрия, затем осторожно по каплям прибавляют 2 мл концентрированной серной кислоты. Смесь нагревают на пламени горелки (лучше нагревать пробирку на парафиновой или глицериновой бане) до выделения пузырьков газа. Появление специфического запаха уксусно-этилового эфира указывает на наличие этилового спирта в исследуемом растворе. Предел обнаружения – 20 мг/мл.
Методика выполнения реакции образования этилбензоата: к 1 мл исследуемого раствора прибавляют 1–2 капли бензоилхлорида. При взбалтывании смеси к ней прибавляют по каплям 10%-й раствор гидроксида натрия до исчезновения удушливого запаха бензоилхлорида. Появление запаха этилбензоата указывает на наличие этилового спирта в пробе.
2.3. Реакция образования ацетальдегида.
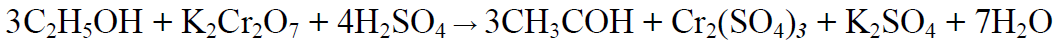
Методика выполнения реакции образования ацетальдегида: к 1 мл исследуемого раствора прибавляют 1 мл 10%-ного раствора серной кислоты до получения кислой среды (по лакмусу). К этой смеси по каплям прибавляют 10%-й раствор дихромата калия до тех пор, пока жидкость не станет оранжево-красной. Смесь оставляют на несколько минут при комнатной температуре. При наличии этилового спирта в исследуемом растворе появляется запах ацетальдегида. Предел обнаружения – 3 мг/мл.
Количественное определение
1.Метод газожидкостной хроматографии (основной). Количество этанола, извлеченного из биологического материала прямо пропорционально высоте или площади пика.
Для расчета количества метанола в исследуемом объекте используют метод внутреннего стандарта, в качестве которого рекомендован пропанол. К каждому из стандартных растворов, предназначенных для построения графика, а также к анализируемой пробе добавляют определенное количество пропанола (внутренний стандарт) и хроматографируют. Рассчитывают отношение площадей S
х или высот hx пиков исследуемого вещества к Sст(hст). Строят калибровочный график зависимости Sx /Sст (hx/hст) от концентрации исследуемого вещества.
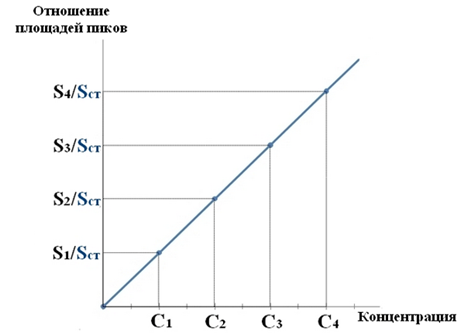
Для расчета концентрации этаноал в исследуемой пробе используют калибровочный коэффициент, который является постоянным для данной пары веществ на колонке и зависит от летучести определяемых веществ в условиях опыта.Калибровочный коэффициент рассчитывают по формуле:
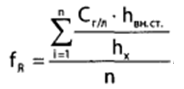
Где Сг/л – концентрация вещества, %; hвн.ст. – высота пика внутреннего стандарта (пропанол); hх – высота пика этанола; n – число измерений (не менее трех).
Калибровочный коэффициент вводят в формулу расчета концентрации вещества в исследуемом образце:
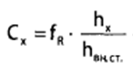
Где Сх – концентрация вещества в пробе %; hх – высота пика; hвн.ст. – высота пика внутреннего стандарта (пропанол).
Метаболизм.
Этанол выделяется из организма с выдыхаемым воздухом, мочой, калом, слюной, молоком, но большая часть этанола в организме метаболизируется.
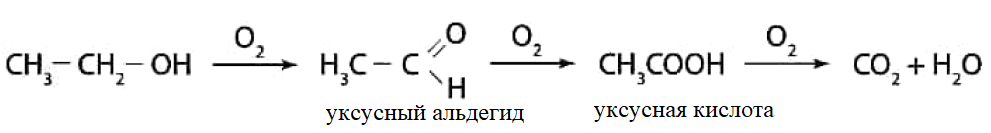
У человека несколько ферментов участвуют в переработке этанола сначала в ацетальдегид, а затем в уксусную кислоту и ацетил-КоА. Как только ацетил-КоА образуется, он становится субстратом для цикла лимонной кислоты, в конечном счете производя клеточную энергию и высвобождая воду и углекислый газ
Токсикологическое значение.
Этиловый спирт широко используется в промышленности как растворитель и исходный продукт для получения многих химических соединений. Этот спирт используется в медицине как дезинфицирующее средство.
В химических лабораториях он применяется как растворитель, входит в состав многих спиртных напитков.
БЛОК IV
ХТА группы токсикологически важных веществ, изолируемых минерализацией («Металлические яды»)
15. Соединения мышьяка, имеющие токсикологическое значение. Изолирование. Дробный метод их обнаружения и определения в минерализате. Оценка результатов химико-токсикологического анализа.
Мышьяк и его соли, являясь высокотоксичными соединениями, широко применяются в народном хозяйстве и медицине. Наибольшее токсикологическое значение имеют:
Мышьяковистый ангидрид (As2O3), арсениты и арсенаты натрия, арсенит и арсенат кальция, парижская или швейнфуртская зелень [Cu(CH3COO)2 · 3Cu(AsO2)2], органические соединения мышьяка (новарсенол, миарсенол, осарсол и др.)
Перечь объектов исследования.
Основные объекты исследования на содержание мышьяка – моча и волосы.
1.пробоподготовкА и метод (схема) изолирования яда
Пробоподготовка, включает изолирование (извлечение) тяжелого металла методом минерализации, отделение мешающих проведению анализа компонентов биопробы.
Минерализация пероксидом водорода и азотной кислотой под давлением с использованием СВЧ. Пробу волос (максимально 2,0 г) помещают в специальный сосуд прибора + смесь концентрированной азотной кислоты и пероксида водорода (окислительный агент). Сосуд герметично закрывают. Переносят в микроволновую систему прибора, где реакционная смесь нагревается в СВЧ поле. При мощности МВ – нагрева 450 Вт в течение 15 минут степень извлечения токсиканта составляет 94%
2.ДЕНИТРАЦИЯ (ОЧИСТКА МИНЕРАЛИЗАТА)
После минерализации биологического материала минерализат содержит окислители, которые мешают дальнейшему проведению исследования
Денитрация с помощью формальдегида
К минерализату + 15 мл дистиллированной воды и смесь нагревают. В нагретую жидкость + формальдегид по каплям. Наблюдается бурное выделение пузырьков газа (NO и N2) и, вследствие окисления NO кислородом воздуха, выделяются бурые пары NO2.

На денитрацию при помощи формальдегида расходуется до 2 мл формальдегид и реакция заканчивается через 1–2 мин. Остатки непрореагировавшего формалина удаляют или нагреванием в течение 10 минут или добавлением в нагретую жидкость 10 капель пергидроля. Окончание денитрации определяют с дифениламином (синее окрашивание)

3.Реакции обнаружения (идентификации) яда
Предварительные
1.Реакция Зангера – Блека.
Реакции обнаружения мышьяка основаны на восстановлении мышьяка до мышьяковистого водорода с дальнейшим обнаружением последнего.
В связи с этим в качестве ориентирующей реакции, имеющей только отрицательное судебно – химическое значение, используют реакцию Зангер – Блека, в основе которой лежат следующие процессы:
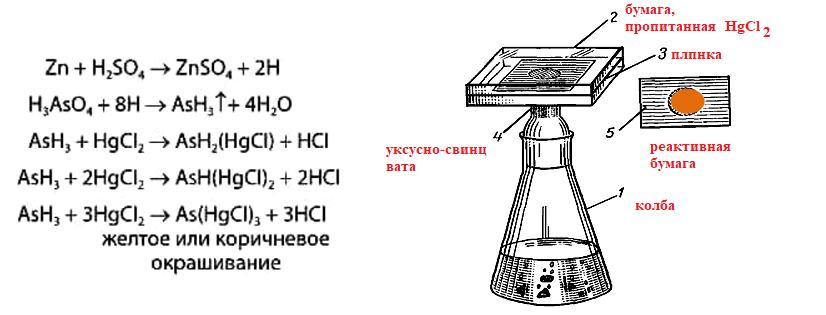
Если в минерализате присутствуют соединения сурьмы в количестве 2 мг и более, они также могут давать окрашенное пятно на бумаге. При бурно текущей реакции между цинком и серной кислотой может образовываться сероводород, способный реагировать с дихлоридом ртути:

Вата, пропитанная ацетатом свинца, служит для исключения влияния сероводорода:
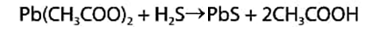
Реакция Зангер – Блека высокочувствительна (предел обнаружения – 0,1 мкг в исследуемом объекте), но не специфична, так как мешают соединения, которые восстанавливаются водородом (например, соединения сурьмы).
При отрицательных результатах этих реакций отпадает необходимость в проведении реакции Марша. При положительном результате обязательным является подтверждение обнаружения мышьяка реакцией Марша.
Подтверждающие
Метод Марша включает в себя ряд испытаний.
К 10 мл минерализата добавляют 20 капель 10% раствора хлорида олова (II) в концентрированной серной кислоте и переносят в воронку аппарата Марша, проверенного на отсутствие воздуха.

Жидкость порциями прибавляют в реакционную колбу Марша, нагревая восстановительную трубку аппарата.
Для определения мышьяка в минерализате проводят ряд испытаний.
1.Отставляют горелку от нагреваемой части трубки, поджигают газ, выходящий из трубки. В присутствии мышьяка пламя окрашивается в синий цвет, ощущается чесночный запах.
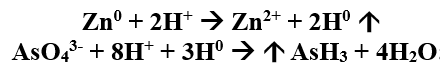
В пламя у конца трубки вносим холодную фарфоровую чашку.

В присутствии мышьяка наблюдаются буровато – серые пятна.
2.Восстановительную трубку поворачивают на 180º и конец её опускают в приёмник с 5% раствором нитрата серебра, подщелоченный гидроксидом аммония:

3.Горелку вновь подставляют под трубку Марша, нагревают в течение часа. В охлажденной части восстановительной трубки может появиться серо – бурое окрашивание.
Внешний вид дистиллята: бесцветная жидкость с запахом спирта.
Качественный анализ (обнаружение).
1.ГЖХ (основной метод)
Газожидкостная хроматография основана на физико-химическом разделении анализируемых компонентов, находящихся в газовой фазе, при их прохождении вдоль нелетучей жидкости, нанесенной на твердый сорбент.
Методика. 5 мл дистиллята помещают в пенициллиновый флакон, закрывают резиновой пробкой, которую фиксируют с помощью зажима. Флакон нагревают на водяной бане в течении 10 мин для перевода определяемого вещества (этанола) в паро – газовую фазу. 0,5 мл паро – газовой смеси вносят в колонку хроматографа.
Обнаружение этанола проводят по соответствующим параметрам удерживания.
Время удерживания на колонке характерно для каждого из разделяемых веществ, поэтому служит качественной характеристикой вещества. Исправленное время удерживания рассчитывается как разность абсолютного времени удерживания вещества и времени удерживания несорбируемого компонента:
t испр = t абс – t н.к.
Удерживаемый объем также является качественной характеристикой анализируемого вещества. Удерживаемый объем V – это объем газа-носителя, необходимый для вымывания всего количества вещества из колонки, который численно равен произведению скорости газа – носителя U на время удерживания t:
V = U · t
Скорость газа измеряется в мл/мин, время удерживания – в минутах.
Если на хроматограмме появляется пик, параметры удерживания которого (время удерживание, расстояние удерживания, объем удерживания) должны совпасть с параметрами удерживания этанола проводят подтверждающие реакции.
2. Химические реакции (подтверждающие).
2.1. Реакция образования йодоформа.
В качестве реактивов применяют раствор гидроксида натрия, раствор иода и реакцию проводят при нагревании. При наличии этанола ощущается запах иодоформа, а при больших количествах этанола образуется желтый осадок. Предел обнаружения – 0,04 мг/мл.
Методика выполнения реакции образования иодоформа: в пробирку вносят 1 мл исследуемого раствора и 2 мл 5%-го раствора гидроксида натрия или карбоната натрия. К этой смеси по каплям прибавляют 1%-й раствор иода в 2%-м растворе иодида калия до слабо-желтой окраски. Затем смесь несколько минут нагревают на водяной бане (50 °С). При наличии этилового спирта ощущается запах йодоформа
2.2. Реакция этерификации. Для получения этиловых эфиров, имеющих характерный запах, применяют бензоилхлорид и ацетат натрия.

Методика выполнения реакции образования этилацетата: в пробирку вносят 1 мл исследуемого раствора и 0,1 г высушенного ацетата натрия, затем осторожно по каплям прибавляют 2 мл концентрированной серной кислоты. Смесь нагревают на пламени горелки (лучше нагревать пробирку на парафиновой или глицериновой бане) до выделения пузырьков газа. Появление специфического запаха уксусно-этилового эфира указывает на наличие этилового спирта в исследуемом растворе. Предел обнаружения – 20 мг/мл.
Методика выполнения реакции образования этилбензоата: к 1 мл исследуемого раствора прибавляют 1–2 капли бензоилхлорида. При взбалтывании смеси к ней прибавляют по каплям 10%-й раствор гидроксида натрия до исчезновения удушливого запаха бензоилхлорида. Появление запаха этилбензоата указывает на наличие этилового спирта в пробе.
2.3. Реакция образования ацетальдегида.
Методика выполнения реакции образования ацетальдегида: к 1 мл исследуемого раствора прибавляют 1 мл 10%-ного раствора серной кислоты до получения кислой среды (по лакмусу). К этой смеси по каплям прибавляют 10%-й раствор дихромата калия до тех пор, пока жидкость не станет оранжево-красной. Смесь оставляют на несколько минут при комнатной температуре. При наличии этилового спирта в исследуемом растворе появляется запах ацетальдегида. Предел обнаружения – 3 мг/мл.
Количественное определение
1.Метод газожидкостной хроматографии (основной). Количество этанола, извлеченного из биологического материала прямо пропорционально высоте или площади пика.
Для расчета количества метанола в исследуемом объекте используют метод внутреннего стандарта, в качестве которого рекомендован пропанол. К каждому из стандартных растворов, предназначенных для построения графика, а также к анализируемой пробе добавляют определенное количество пропанола (внутренний стандарт) и хроматографируют. Рассчитывают отношение площадей S
х или высот hx пиков исследуемого вещества к Sст(hст). Строят калибровочный график зависимости Sx /Sст (hx/hст) от концентрации исследуемого вещества.

Для расчета концентрации этаноал в исследуемой пробе используют калибровочный коэффициент, который является постоянным для данной пары веществ на колонке и зависит от летучести определяемых веществ в условиях опыта.Калибровочный коэффициент рассчитывают по формуле:
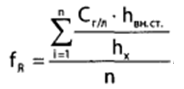
Где Сг/л – концентрация вещества, %; hвн.ст. – высота пика внутреннего стандарта (пропанол); hх – высота пика этанола; n – число измерений (не менее трех).
Калибровочный коэффициент вводят в формулу расчета концентрации вещества в исследуемом образце:
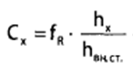
Где Сх – концентрация вещества в пробе %; hх – высота пика; hвн.ст. – высота пика внутреннего стандарта (пропанол).
Метаболизм.
Этанол выделяется из организма с выдыхаемым воздухом, мочой, калом, слюной, молоком, но большая часть этанола в организме метаболизируется.
У человека несколько ферментов участвуют в переработке этанола сначала в ацетальдегид, а затем в уксусную кислоту и ацетил-КоА. Как только ацетил-КоА образуется, он становится субстратом для цикла лимонной кислоты, в конечном счете производя клеточную энергию и высвобождая воду и углекислый газ

Токсикологическое значение.
Этиловый спирт широко используется в промышленности как растворитель и исходный продукт для получения многих химических соединений. Этот спирт используется в медицине как дезинфицирующее средство.
В химических лабораториях он применяется как растворитель, входит в состав многих спиртных напитков.
БЛОК IV
ХТА группы токсикологически важных веществ, изолируемых минерализацией («Металлические яды»)
15. Соединения мышьяка, имеющие токсикологическое значение. Изолирование. Дробный метод их обнаружения и определения в минерализате. Оценка результатов химико-токсикологического анализа.
Мышьяк и его соли, являясь высокотоксичными соединениями, широко применяются в народном хозяйстве и медицине. Наибольшее токсикологическое значение имеют:
Мышьяковистый ангидрид (As2O3), арсениты и арсенаты натрия, арсенит и арсенат кальция, парижская или швейнфуртская зелень [Cu(CH3COO)2 · 3Cu(AsO2)2], органические соединения мышьяка (новарсенол, миарсенол, осарсол и др.)
Перечь объектов исследования.
Основные объекты исследования на содержание мышьяка – моча и волосы.
1.пробоподготовкА и метод (схема) изолирования яда
Пробоподготовка, включает изолирование (извлечение) тяжелого металла методом минерализации, отделение мешающих проведению анализа компонентов биопробы.
Минерализация пероксидом водорода и азотной кислотой под давлением с использованием СВЧ. Пробу волос (максимально 2,0 г) помещают в специальный сосуд прибора + смесь концентрированной азотной кислоты и пероксида водорода (окислительный агент). Сосуд герметично закрывают. Переносят в микроволновую систему прибора, где реакционная смесь нагревается в СВЧ поле. При мощности МВ – нагрева 450 Вт в течение 15 минут степень извлечения токсиканта составляет 94%
2.ДЕНИТРАЦИЯ (ОЧИСТКА МИНЕРАЛИЗАТА)
После минерализации биологического материала минерализат содержит окислители, которые мешают дальнейшему проведению исследования
Денитрация с помощью формальдегида
К минерализату + 15 мл дистиллированной воды и смесь нагревают. В нагретую жидкость + формальдегид по каплям. Наблюдается бурное выделение пузырьков газа (NO и N2) и, вследствие окисления NO кислородом воздуха, выделяются бурые пары NO2.

На денитрацию при помощи формальдегида расходуется до 2 мл формальдегид и реакция заканчивается через 1–2 мин. Остатки непрореагировавшего формалина удаляют или нагреванием в течение 10 минут или добавлением в нагретую жидкость 10 капель пергидроля. Окончание денитрации определяют с дифениламином (синее окрашивание)

3.Реакции обнаружения (идентификации) яда
Предварительные
1.Реакция Зангера – Блека.
Реакции обнаружения мышьяка основаны на восстановлении мышьяка до мышьяковистого водорода с дальнейшим обнаружением последнего.
В связи с этим в качестве ориентирующей реакции, имеющей только отрицательное судебно – химическое значение, используют реакцию Зангер – Блека, в основе которой лежат следующие процессы:

Если в минерализате присутствуют соединения сурьмы в количестве 2 мг и более, они также могут давать окрашенное пятно на бумаге. При бурно текущей реакции между цинком и серной кислотой может образовываться сероводород, способный реагировать с дихлоридом ртути:
Вата, пропитанная ацетатом свинца, служит для исключения влияния сероводорода:
Реакция Зангер – Блека высокочувствительна (предел обнаружения – 0,1 мкг в исследуемом объекте), но не специфична, так как мешают соединения, которые восстанавливаются водородом (например, соединения сурьмы).
При отрицательных результатах этих реакций отпадает необходимость в проведении реакции Марша. При положительном результате обязательным является подтверждение обнаружения мышьяка реакцией Марша.
Подтверждающие
Метод Марша включает в себя ряд испытаний.
К 10 мл минерализата добавляют 20 капель 10% раствора хлорида олова (II) в концентрированной серной кислоте и переносят в воронку аппарата Марша, проверенного на отсутствие воздуха.

Жидкость порциями прибавляют в реакционную колбу Марша, нагревая восстановительную трубку аппарата.
Для определения мышьяка в минерализате проводят ряд испытаний.
1.Отставляют горелку от нагреваемой части трубки, поджигают газ, выходящий из трубки. В присутствии мышьяка пламя окрашивается в синий цвет, ощущается чесночный запах.
В пламя у конца трубки вносим холодную фарфоровую чашку.
В присутствии мышьяка наблюдаются буровато – серые пятна.
2.Восстановительную трубку поворачивают на 180º и конец её опускают в приёмник с 5% раствором нитрата серебра, подщелоченный гидроксидом аммония:
3.Горелку вновь подставляют под трубку Марша, нагревают в течение часа. В охлажденной части восстановительной трубки может появиться серо – бурое окрашивание.


