Файл: Блок i организационнопрововые основы судебномедицинской деятельности в рф. Порядок и проведение судебно медицинских и химикотоксикологических исследований.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 17
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Химико-токсикологическое исследование печени трупа на фенол

Фенол (карболовая кислота) представляет собой тонкие длинные игольчатые кристаллы или бесцветную кристаллическую массу со своеобразным запахом. На воздухе он постепенно розовеет. Фенол обладает кислотными свойствами.
Перечь объектов исследования.
Приказ Минздравсоцразвития РФ от 12.05.2010 № 346н: остатки жидкости в стакане, емкости, флаконах, найденных на месте происшествия; кровь, моча; желудок с содержимым; головной мозг, легкое; печень, селезенка
Изолирование – методом дистилляции.
Процесс. Объект массой 100,0 г тщательно измельчают, смешивают с водой до состояния густой кашицы, помещают в круглодонную колбу таким образом, чтобы она заполнилась не более чем на 1/3 объема, подкисляют щавелевой или виннокаменной кислотой до рН 2 – 3 и подвергают перегонке.
Подкисление объекта слабой органической кислотой проводят с целью перевода веществ кислотного характера (цианиды калия, натрия, феноляты, салицилаты) в свободные кислоты.
Собирают два дистиллята.
Первый в количестве 1 – 3 мл собирают в приемник с 5% раствором гидроксида натрия для улавливания летучей синильной кислоты.
2 – ю порцию дистиллята отгоняют в объеме 25 – 50 мл. Вещества кислотного и нейтрального характера перегоняются из кислых растворов в такой последовательности: синильная кислота, диэтиловый эфир, хлороформ, ацетон, спирты алифатического ряда, нитробензол, муравьиная кислота, хлоралгидрат, формальдегид, сероуглерод, салициловая кислота и другие. Во втором дистилляте обычно содержатся вещества средней летучести.
Для обнаружения фенола используется часть второго дистиллята, который подвергают пробоподготовке, так как проведению реакций на фенол мешают карбоновые кислоты и этанол. Содержащиеся в дистилляте летучие кислоты нейтрализуют гидрокарбонатом натрия (фенол не реагирует с гидрокарбонатом) и экстрагируют фенол эфиром. Эфир выпаривают при комнатной температуре (это повышает концентрацию фенола в остатке, вместе с эфиром улетучиваются одноатомные спирты, которые мешают проведению реакций на фенол).
Внешний вид дистиллята: остаток имеет вид маслянистых капель с резким характерным запахом фенола.
Остаток растворяют в 2 – 3 мл воды и с полученным раствором проводят реакции на фенол.
Химические реакции обнаружения фенола.
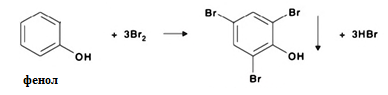
1.Реакция с бромной водой. От прибавления бромной воды выпадает осадок трибромфенола:

Такой же осадок дает и салициловая кислота. Однако при подщелачивании дистиллята гидрокарбонатом натрия салициловая кислота дает соль, которая не экстрагируется эфиром.
Реакция высоко чувствительна, но не специфична. В токсикологической химии этой реакции придается значение при ее отрицательном результате для доказательства отсутствия фенола.
2.Реакция с хлоридом железа (III). Фенол с раствором хлорида железа (III) дает соединение, имеющее сине – фиолетовую окраску:

Реакция менее чувствительна, чем реакция с бромной водой. Это дает ей возможность придать положительное значение, поскольку количество фенола, образующегося в трупном материале за счет гнилостных процессов, не достигает концентрации реакции (1:1000).
3.Индофеноловая реакция. В качестве окислителей используют гипохлорит натрия, хлорную или бромную воду, пероксид водорода и др. Появление грязно-фиолетовой окраски указывает на наличие фенола в пробе.

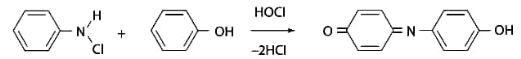
Реакция является подтверждающей.
4.Реакция с реактивом Миллона. Фенол с реактивом Миллона (смесь нитратов одно – и двухвалентной ртути, содержащая азотистую кислоту) дает соединение красного цвета:

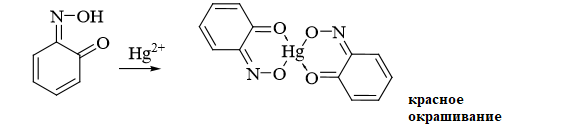
Реакция является подтверждающей.
5.Реакция Либермана. Азотистая кислота, образующаяся при взаимодействии нитрита натрия и серной кислоты, с фенолом образует n – нитрозофенол, который изомеризуется до n – хиноидоксима. n – хиноидоксим с избытком фенола дает индофенол (синяя окраска появляется после добавления гидроксида натрия к охлажденной смеси):
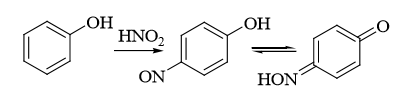
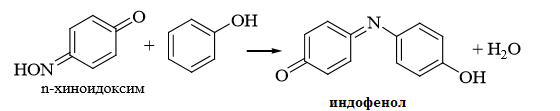
Реакция является подтверждающей.
Количественное определение
1.Броматометрическое титрование после пробоподготовки. Метод используется при определении в дистиллятах малых количеств фенола. После изолирования перегонкой с водяным паром дистиллят подщелачиваем натрия гидрокарбонатом и экстрагируем эфиром. Эфир испаряем, остаток растворяем в воде очищенной и к жидкости добавляем бромид калия, титрованный раствор калия бромата и кислоту хлористоводородную.
Для определения избытка брома добавляем калия йодид и выделившийся йод оттитровываем раствором натрия тиосульфата. В качестве индикатора используем крахмал:
KBrO3 + 5KBr + 3H2SO4 → 3Br2 + 3K2SO4 + 3H2O
Br2 + 2KI → I2 + KB
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Содержание летучих с паром фенолов в пересчете на фенол (Х) в мг/л вычисляем по формуле:
Х = (b – a) · K· 0,784 · 500 · 1000
(V · V1)
где b – объем раствора тиосульфата натрия, израсходованного при втором титровании, мл, a – объем раствора тиосульфата натрия, израсходованного на титрование пробы, мл, К – поправочный коэффициент для приведения концентрации раствора тиосульфата натрия к точно 0,05 н, V – объем дистиллята, взятой для анализа, мл; V1 – объем аликвотной части фильтрата или дистиллята, взятого для бромирования и титрования, мл, 0,784 – количество фенола, эквивалентное 1 мл 0,05 н раствора тиосульфата натрия, мг.
2.Метод газожидкостной хроматографии
Определение проводят на 2 или 4 хроматографических колонках; на хроматограмме появляется пик, время удерживания или объем которого должен совпасть с параметрами удерживания фенола – стандарта.
Время удерживания на колонке характерно для каждого из разделяемых веществ, поэтому служит качественной характеристикой вещества. Исправленное время удерживания рассчитывается как разность абсолютного времени удерживания вещества и времени удерживания несорбируемого компонента:
t испр = t абс – t н.к.
Удерживаемый объем также является качественной характеристикой анализируемого вещества. Удерживаемый объем V – это объем газа-носителя, необходимый для вымывания всего количества вещества из колонки, который численно равен произведению скорости газа – носителя U на время удерживания t:
V = U · t
Скорость газа измеряется в мл/мин, время удерживания – в минутах.
При получении соответствующего пика наличие фенола в исследуемом объекте подтверждают химическими методами.
Количество фенола, извлеченного из биологического материала прямо пропорционально высоте или площади пика. Для расчета количества фенола в исследуемом объекте используют метод внутреннего стандарта, в качестве которого рекомендован н – пропанол. К каждому из стандартных растворов, предназначенных для построения графика, а также к анализируемой пробе добавляют определенное количество н – пропанола (внутренний стандарт) и хроматографируют. Рассчитывают отношение площадей Sх или высот hx пиков исследуемого вещества к Sст(hст). Строят калибровочный график зависимости Sx /Sст (hx/hст) от концентрации исследуемого вещества.
Для расчета концентрации фенола в исследуемой пробе используют калибровочный коэффициент, который является постоянным для данной пары веществ на колонке и зависит от летучести определяемых веществ в условиях опыта.
Калибровочный коэффициент рассчитывают по формуле:
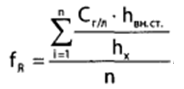
Где Сг/л – концентрация фенола, %; hвн.ст. – высота пика внутреннего стандарта (н – пропанола); hх – высота пика фенола; n – число измерений (не менее трех).
Калибровочный коэффициент вводят в формулу расчета концентрации ацетона в исследуемом образце:
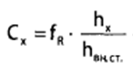
Где Сх – концентрация фенола в пробе %; hх – высота пика фенола; hвн.ст. – высота пика внутреннего стандарта (н – пропанола).
Токсикологическое значение.
Используется в химической промышленности для получения красителей, пластмасс, лекарственных средств. В медицине применяется как дезинфицирующее средство. В организм поступает через слизистые оболочки, кожу. При приеме внутрь 8-15 г фенола наступает смерть. Наибольшее количество фенола обнаруживается в почках, печени, сердце, крови, головном мозгу.
Метаболизм.
I фаза метаболизма. Часть подвергается окислению с образованием хинона, гидрохинона и хингидрона, который окрашивает мочу:

II фаза метаболизма.
Реакции конъюгации.
Конъюгация с серной кислотой:
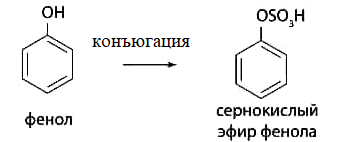
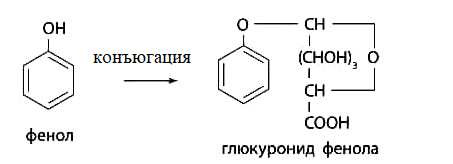
Конъюгация с глюкуроновой кислотой:
Л И Т Е Р А Т У Р А
1.Вергейчик Т.Х. Токсикологическая химия – М .: МЕДпресс-информ, 2016 - 400 с.
2.Плетнева Т.В. Токсикологическая химия: учебник для вузов / под ред. Т.В. Плетеневой. – М.: ГЭОТАР-Медиа, 2013 г – 512с.
3.Федосеева, Л. М. Токсикологическая химия: учеб.-метод. пособие для студ. к практ. занятиям / Л. М. Федосеева, Л. Е. Кудрикова, Н, Н. Кнауб.-Барнаул: АГМУ, 2007.-108с., учебная
4.Береговых Г.В.Химико-токсикологический анализ соединений металлов (Металлические яды)/ Учебно-методическое пособие для студентов 4 курса дневного и 5 курса заочного отделений фармацевтического факультет. Кемерово 2014 г 139 с
5. Лекционный материал
6. Кутяков В.А. Токсикологическая химия: учебное пособие в 2-х частях. Для студентов 4 и 5 курсов, обучающихся по специальности 060108 «Фармация». Ч. 2. – Красноярск, Изд. Изд. КрасГМУ, 2010. – 166 с.


