Файл: Блок i организационнопрововые основы судебномедицинской деятельности в рф. Порядок и проведение судебно медицинских и химикотоксикологических исследований.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 19
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
V = U · t
Скорость газа измеряется в мл/мин, время удерживания – в минутах.
При получении соответствующего пика наличие ацетона в исследуемом объекте подтверждают химическими методами.
Количественное определение.
ВЭЖХ – способы расчета концентрации.
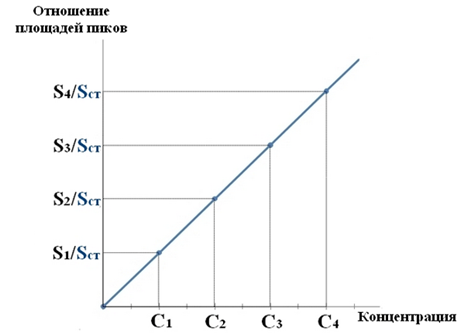
Количество папаверина, извлеченного из биологического материала, прямо пропорцианально высоте или площади пика. Расчет:
Сх = (hx × Сст × 100) / hст или Сх = (Sх × Сст × 100) / Sст
Где Сх – содержание папаверина в 100г органов, Сст – концентрация стандартного раствора, hxи hст ; Sx и S ст – соответственно высота или площади пиков исследуемого вещества и стандарта.
Количество папававерина, извлеченного из биологического материала, прямо пропорционально высоте или площади пика. Расчет по калибровочному графику, используя внутренний стандарт (метод относительной калибровки).
Токсикологическое значение.
Применяется в медицине в качестве ЛС, входит в состав комбинированных спазмолитических препаратов.
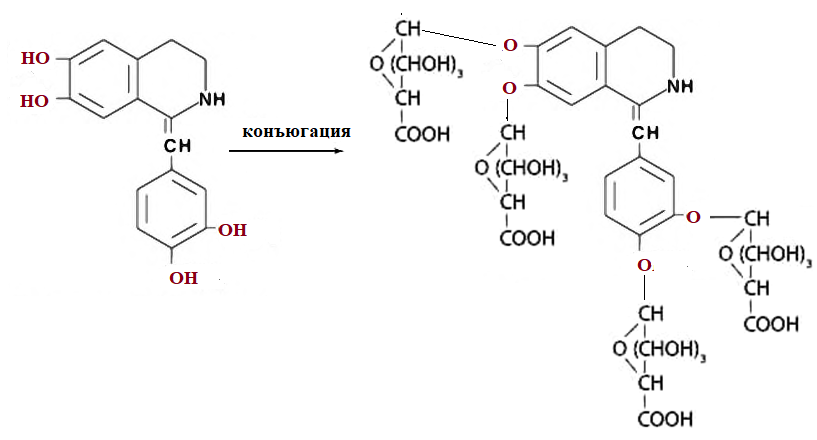
Метаболизм.
Метаболизм папаверинапроисходит главным образом путем дезалкилирования. При этом образуются фенольные соединения, которые выделяются с мочой в виде глюкуронидов.
I стадия метаболизма.
Окислительное О – дезалкилирование.

II стадия метаболизма.
Конъюгация с глюкуроновой кислотой.
БЛОК VI
Газохроматографическое определение «Летучих ядов»
Задачи.
9. На хроматограмме, полученной в результате газохроматографического анализа крови на содержание этанола, высота пика этилнитрита составила 4,3 см, высота пика изопропилнитрита 5,4 см. Пользуясь методом внутреннего стандарта, определить количественное содержание этанола в крови, если котангенс угла наклона калибровочной кривой на калибровочном графике составил 2,12.
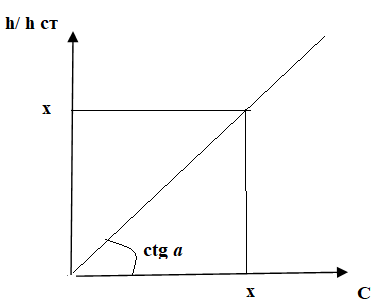
Расчет ведем по формуле:
С = h / hst ∙ ctg a = 4,3 / 5,4
∙ 1.54 = 1,23
При определении этилового спирта в крови найденную по калибровочному графику концентрацию этого спирта умножают на 0,95:
1,23 × 0,95 = 1,17%0
Заключение. Концентрация спирта в крови 1,17 %0, что соответствует легкой степени опьянения (0,5 – 1,5).
Тема: «Металлические яды»
20. При минерализации 100 г печени получен минерализат объемом 200 мл. Качественный анализ минерализата дробным методом показал наличие катионов свинца. Рассчитать количественное содержание катионов свинца (г) в биологическом объекте (100 г), если к 50 мл минерализата прибавили 5 мл 0,01 M трилона Б и оттитровали его избыток 0,01 М раствором цинка хлорида. На титрование затрачено 4,40 мл 0,01 М раствора цинка хлорида (индикатор - эриохром черный Т). Т Pb2+/ ZnCl2 = 0,002072 г/мл.
Комплексонометрия (трилонометрия). Вариант обратного титрования.
Индикатор– эриохром черный, титруют до фиолетового окрашивания
Среда – щелочная, создаваемая аммиачным буферным раствором.
Определение основано на растворении определяемых веществ в избытке титрованного раствора трилона Б, остаток которого оттитровывают вторым титрантом – цинка хлоридом
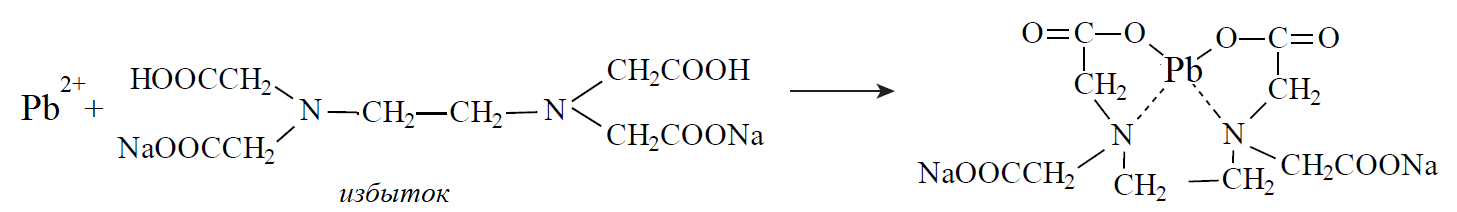
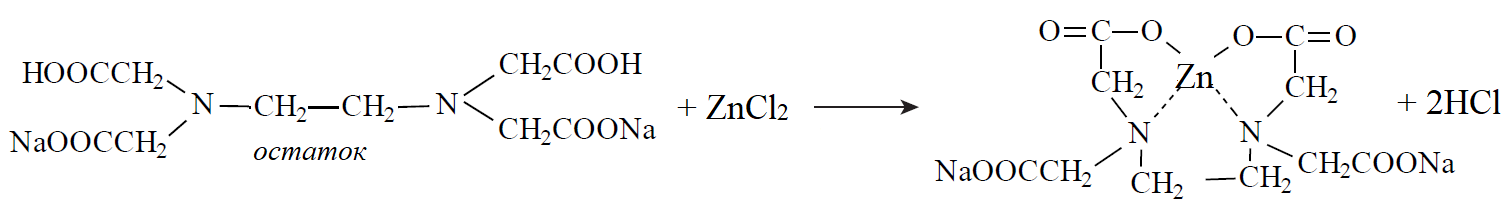
Принцип индикации при обратном титровании: титруют от окраски свободного индикатора до окраски комплексного соединения индикатора с металлом титранта [ZnCl2]. Определяемый ион металла не участвует в индикации, т.к. он прочно связан трилоном Б.
Кстех = 1:1 = 1
Т = 0,002072 г/мл
Расчет количественного содержания находят по формуле:
Хг = Т × (V1 – V2) × Vмк × Р
а × Vаликв
Хг = 0,002072 × (5,0 – 4,40) × 200 × 100,0 = 0,004973 г = 4,973 мг
100,0 × 50 мл
Заключение. Обнаружены ионы свинца в концентрации 4,973 мг/100 г.
Тема: «Лекарственные яды»
25. При экстракции 10 мл плазмы крови хлороформом при рН 10-11 получено извлечение объемом 5 мл. Качественный анализ показал наличие кокаина. 2 мл хлороформного извлечения упарили до сухого остатка и растворили в 5 мл 0,1 М кислоты хлористоводородной. Оптическая плотность полученного раствора при аналитической длине волны 233 нм составила 0,131. Оптическая плотность стандартного раствора вещества с концентрацией 0,001% составила 0,430. Рассчитайте концентрацию кокаина в плазме крови (мкг/мл).
РЕШЕНИЕ.
Стандартный раствор 10 мл 0,001% (0,0001 г в 10 мл)
Расчет ведут по стандартному раствору:
Хг = 0,131× 0,0001 × 5 мл × 5 мл
= 0,000076 г/ 10 мл = 76 мкг/10 мл
0,430 × 10 мл
Заключение. Обнаружен кокаин в количестве 76мкг/10 мл
БЛОК VII
ХТА группы токсикологически важных веществ, изолируемых неполярными растворителями («Пестициды»)
8. Пестициды из группы галогенпроизводных (группа ДДТ): общая характеристика, токсичность, методы обнаружения и количественного определения.
Группа ДДТ (инсектициды)
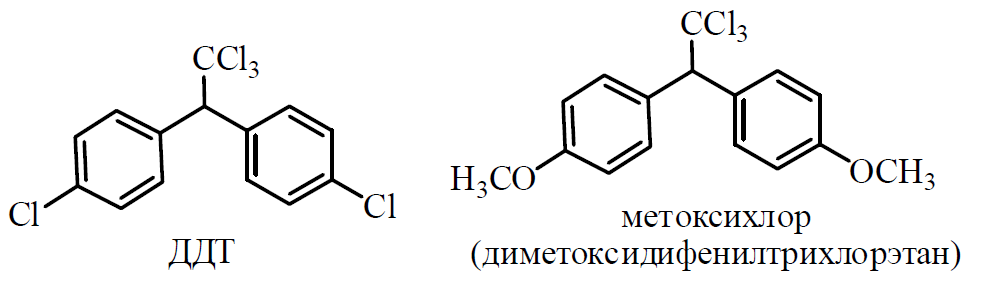
Поражающее действие ХОС связано с параличом нервной системы. Высоколипофильные ХОС нарушают структуру мембран нервных клеток и препятствуют прохождению нервных импульсов. В настоящее время использование ХОС как инсектицидов в сельском хозяйстве запрещено практически во всех странах.
Класс средней токсичности (300 – 500 мг/кг).
ДДТ обладает сильным инсектицидным действием и незначительной токсичностью по отношению к теплокровным животным. Однако применение этих веществ в большинстве стран было запрещено в связи с их способностью накапливаться в жировых тканях человека и животных, давать высокую остаточную токсичность и медленно разрушаться в окружающей среде.
Методы обнаружения.
1. Реакция Витали – Морена – фиолетовое окрашивание.
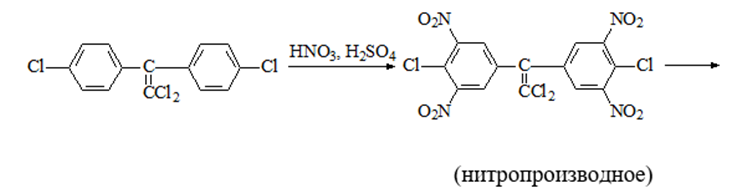
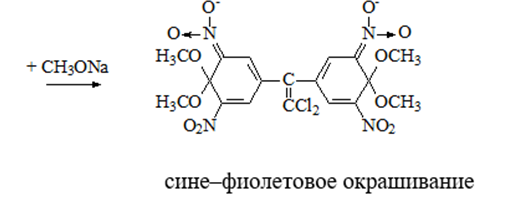
2. Дехлорирование, с последующим определением продуктов реакции
На исследуемое вещество действуют спиртовым раствором щелочи, либо раствором алкоголята натрия. В зависимости от характера реагента от молекулы отщепляется различное количество атомов хлора:

I – 2,2–бис(n–хлорфенил)1,1 – дихлорэтилен
II – дигидроксидифенилуксусная кислота.
После дехлорирования проводят реакции на хлорид–ион и ароматические соединения. Обнаружение иона хлора – образуется осадок белого цвета:
Cl- + Ag+ AgCl
Количественное определение.
1.Ранее применялось аргентометрическое титрование по хлорид – иону поле отщепления. Объем титранта и эквивалент вещества связаны с количеством отщепленного атомов хлора, которое зависит от способа дегалогенирования.
1.Метод Фольгарда – обратное титрование
Титрование проводят в азотнокислой среде (pH<2). Метод заключается в осаждении галогенидов избытком раствора серебра нитрата, избыток последнего определяют титрованием раствором аммония роданида (тиоцианата) в присутствии индикатора железоаммонийных квасцов до появления красной окраски, свойственной железа (III) роданиду.
2Cl- + 2AgNO3 → 2AgCl ↓ + 2NO3-
AgNO3 + NH4SCN → AgSCN↓ + NH4NO3
Fe (NH4)(SO4)2 + 3NH4CNS → Fe(CNS)3 + 2(NH4)2SO4
Э = М.м.
2.СФМ в видимой области проводится по окрашенному продукту, полученное в результате реакции Витали – Морена.
Проводят сравнение оптических плотностей стандартного и анализируемого окрашенных растворов. Из частей анализируемого и стандартного растворов приготавливают окрашенные растворы и измеряют величину их оптической плотности при одной и той же толщине слоя (в тех же кюветах).
C1 = А1 × C2
А2
где А1 — оптическая плотность окрашенного анализируемого раствора; А2 — оптическая плотность окрашенного стандартного раствора; С2— концентрация стандартного раствора.
3.Тонксослойная хроматография (ТСХ).
Количественное определение осуществляют сравнением площадей
пятен пробы и стандартных растворов. Между количеством препарата в
пробе, не превышающим 20 мкг, и площадью его пятна существует прямая
пропорциональная зависимость. При большом содержании препарата следует
использовать пропорциональную часть исследуемого экстракта.
Количество препарата в пробе (Х, мг/кг или мг/л) вычисляют по формуле:
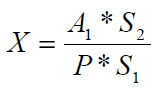
где A1 – содержание препарата в стандартном растворе, (мкг); S1 – площадь пятна стандартного раствора, (мм2); S2 – площадь пятна пробы, (мм2); Р – масса или объем исследуемой пробы, (г или мл).
БЛОК VIII
Ситуационные задания по судебно-химическому и
химико-токсикологическому анализу веществ,
имеющих токсикологическое значение
1. Гражданин Д., рабочий химического завода, в состоянии опьянения на работе выпил неизвестную жидкость. Сразу почувствовал резкую боль в желудке, началась рвота белыми хлопьевидными массами. При доставке в больницу скончался. На основании клинических данных и характерных признаков (моча оливкового цвета, запах фенола изо рта) поставлен диагноз – острое отравление фенолом на фоне алкогольного опьянения. Обосновать выбор биологического объекта, привести ход химико-токсикологического анализа.


