ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 291
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
[6].
В фармацевтической промышленности
Из водорослей получают: студне- и слизеобразующие вещества — агар-агар (анфельция, гелидиум), агароиды (филлофора, грацилярия), карраген (хондрус, гигартина, фурцелярия), альгинаты (ламинариевые и фукусовые), кормовую муку, содержащую микроэлементы и йод.
Водоросли участвуют в образовании некоторых типов лечебных грязей.
Химическая промышленность
Человек использует морские водоросли в химической промышленности. Из них получают йод, альгиновую кислоту, агар-агар, калийные соли, целлюлозу, спирт, уксусную кислоту.
Биотопливо
Из-за высокой скорости размножения водоросли применяются для получения биомассы на топливо. Разработано множество различных экспериментальных процессов получения биотоплива (англ.)русск., например, использующих высокие температуры и давления[7].
В науке
Водоросли широко применяют в экспериментальных исследованиях для решения проблем фотосинтеза и выяснения роли ядра и других компонентов клетки.
Существует определенная методика сбора и хранения водорослей.
Исходя из задач, поставленных перед исследователем, определяются места отбора проб, их количество, выбор оборудования, необходимость проведения сбора в конкретное время года и количество выездов.
В качестве оборудования для сбора проб водорослей необходимо подготовить емкости с широким горлом и плотно закрывающимися крышками, нож, лопатку-скребок, полиэтиленовые пакеты, формалин, маркер, этикетки, полевой дневник, карандаш.
Учитывая постоянную динамику состава водорослей в зависимости от динамики параметров среды, постоянного изменения численности различных групп, сбор водорослей проводится в течение всего вегетационного сезона, начиная с ранней весны и заканчивая поздней осенью.
Сбор водорослей в водоемах производится с берега или с помощью лодки. Для сбора используют различные приспособления, позволяющие зачерпнуть пробы на разной глубине. В периоды массового развития водорослей самым простым приспособлением, применяемым для сбора проб, является планктонная сеть (рис. 7) [Топачевский, Масюк]. Для изготовления планктонных сетей используются полиамидные сита, имеющие большую прочность и определенный размер отверстий. Размер ячеек полиамидных сит варьирует от 0,064 до 1,364 мм. При работе с сетью ее протягивают через толщу воды, в результате чего на ткани остаются относительно крупные водоросли (мелкие формы просачиваются через ткань). Сеть имеет форму сачка, на
металлическом кольце размещается капроновый мешок, на дне которого располагается металлический или пластиковый стаканчик, в котором оседают водоросли. Сеть применяется при поверхностном сборе водорослей. Ее используют как непосредственно для забора проб, протягивая через толщу воды, так и для фильтрации воды и сгущения проб водорослей. Далее сконцентрированные пробы водорослей из стаканчика переносят в чистый сосуд или герметично закрывающийся полиэтиленовый пакет, который маркируется, а информация о пробе заносится в полевой дневник. Собранные пробы можно изучать в живом состоянии или зафиксировать для дальнейших исследований.
Вертикальный сбор проб фитопланктона производится с использованием различных емкостей и сетей, погружаемых на определенную глубину [Киселев]. Для сбора водорослей из определенных горизонтов толщи воды используют бутыли с крышкой или батометры.
Батометры или бутыли Майера — это приборы различной конструкции, используемые для взятия проб воды на разной глубине. Эти приборы оборудованы специальными клапанами и кранами для закрывания и открывания под водой (рис. 8).

Рис. 7. Планктонная сеть Апштейна:
1 — обод; 2 — полоса плотной материи для прикрепления фильтрационного конуса к ободу; 3 — стропа, соединяющая обод и стаканчик; 4 — фильтрационный конус; 5 — стаканчик; 6 — силиконовая трубка; 7 — шаровой кран

Рис. 8. Батометры и бутыли разных конструкций для сбора проб водо-рослей на разной глубине водоемов [по: Ask..]
Сбор фитобентоса на мелководье производится с использованием обыкновенных сосудов или сифонов, засасывающих поверхностный слой донного ила. На глубине часто используют грабельки, «кошки», илососы, дночерпатели или драги (рис. 9).
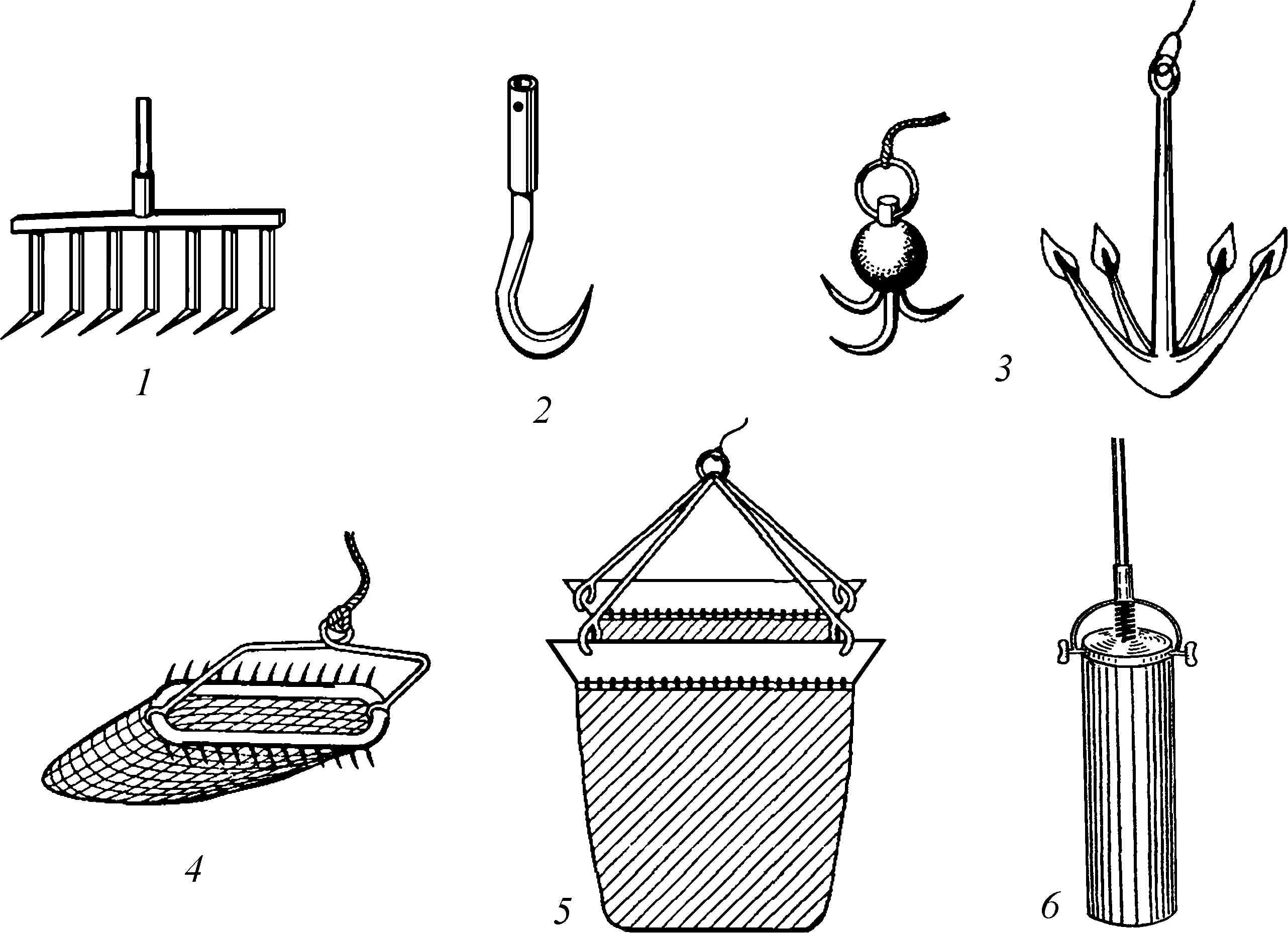
Рис. 9. Приспособления для сбора бентосных водорослей:
1 — грабельки; 2 — серпообразный нож; 3 — якорьки-«кошки»; 4 — драга Раменского
(ширина 35 см); 5 — гидробиологическая драга; 6 — трубчатый дночерпатель [по:
Садчиков и др., с. 39, с изм.]
Сбор прикрепленных водорослей проводится при помощи ножа или лопатки-скребка, соскабливающего слой водорослей с поверхности камней, растений, раковин моллюсков и различных подводных конструкций. Собранный материал переносят в сосуды или пакеты и маркируют. Для лучшей сохранности объектов рекомендуется собирать небольшие кусочки субстрата с прикрепленными к ним особями. Собранные образцы помещают в пакеты или стеклянные емкости и фиксируют 4 %-ным раствором формальдегида.
Сбор крупных водорослей проводят в емкости, наполненные водой. Каждая емкость маркируется пронумерованными этикетками, подробная информация о которых заносится в полевой дневник.
Для количественной оценки содержания водорослей в пробе собранные пробы фильтруют через планктонную сеть. Объем воды, проходящий через фильтр, можно приблизительно рассчитать по формуле v = izt^d, где v — объем воды, фильтруемой через сеть; г— радиус сети; d — расстояние, на которое была протянута сеть.
Пробы водорослей, собранные различными способами, необходимо в дальнейшем сконцентрировать. Существует три основных метода извлечение водорослей:
1) центрифугирование;
2) фильтрация через бумажные (№ 42), мембранные или бактериальные фильтры;
3) отстаивание.
Центрифугирование проводят с использованием электрической центрифуги, в которую помещают образцы (5-20 мл) на 10-20 мин, при скорости 1500-2000 об/мин. В пробы добавляется несколько капель 1 % алюмокалиевых квасцов, формалин или раствор Люголя. Метод применяется для концентрирования как живого, так и фиксированного материала.
Сгущение проб для концентрирования живого и фиксированного материала также проводится методами прямой и обратной фильтрации. Прямая фильтрация используется для проб с низким содержанием фитопланктона и незначительным количеством примесей органического и неорганического происхождения. При этом используется вакуумный источник, создающий разряжение 0,2-0,3 атм. Пробы пропускаются через фильтры с разным диаметром пор. Выбор фильтров зависит от задач и объектов исследования. Обычно используются «предварительные» (диаметр отверстия 2-5 мкм) и мелкопористые мембранные фильтры (диаметр — от 1 до 0,3 мкм). Для мелких водорослей могут применяться бактериальные фильтры.
Метод обратной фильтрации, при котором пробы прогоняются через фильтр снизу вверх, является наиболее щадящим, хорошо сохраняющим клетки и пригодным для всех групп фитопланктона.
Собранные пробы можно поместить в стеклянные трубчатые сосуды и оставить отстаиваться на 15-20 дней в темном месте. В дальнейшем воду из верхней части сосуда аккуратно отсасывают с помощью трубки с фильтром на конце, а полученную концентрированную пробу исследуют. Также сгущение можно провести с использованием бактериальных фильтров [Лемеза].
Важным этапом работы является фиксирование собранного материала. Можно сохранить собранные водоросли в живом состоянии несколько часов, если поместить их в холодильник, после чего пробы необходимо незамедлительно исследовать. Исследования живых образцов позволит избежать ошибок, связанных с изменением формы тела водорослей, окраски хлоропластов, потерей жгутиков, вплоть до полного разрушения клеток.
Для длительного сохранения проб водорослей используют различные фиксаторы (табл. 2). Однако на сегодняшний день не существует универсального фиксатора, позволяющего сохранять пробы различных групп водорослей. Одними из самых распространенных консервирующих растворов являются 4 %-ный раствор формальдегида и раствор Люголя (хотя содержащийся в аптечном Люголе глицерин способствует образованию в пробах шариков) [Лемеза].
Водоросли, собранные вместе с субстратом, и фильтры с водорослями помещают в 4 %-ный раствор формальдегида. Раствор кислого формалина подходит для сохранения панцирных форм водорослей (динофлагелляты и диатомовые водоросли). Хорошо зарекомендовал себя также раствор формальдегида и хромовых квасцов (5 мл 4 %-ного формальдегида и 10rK2SO4- Cr2(S04)3-24 H20 в 500 мл воды). Зафиксированные пробы могут длительное время храниться в темном прохладном месте. Раствор кислого формалина может быть нейтрализован добавлением карбоната кальция.
Раствор Люголя, состоящий из 10 г йода и 20 г йодида калия, растворенных в 200 мл дистиллированной воды с добавлением 20 г ледяной уксусной кислоты, подходит для фиксации одноклеточных жгутиковых и реснитчатых форм планктона, так как хорошо сохраняет жгутики и реснички. Раствор можно хранить в темной склянке до нескольких месяцев. При проведении анализов его добавляют в соотношении 1 : 5.
Альгологи часто применяют раствор, разработанный в Институте озероведения РАН: 3 части кристаллического йода (I), 10 частей йодида калия (KI), 5 частей CH3COONa, кристаллик тимола на 100 частей воды. Раствор добавляют в сгущенную пробу до получения чайного цвета.
Таблица 2
Фиксаторы и красители, используемые при исследованиях водорослей
Продолжение табл. 2
Окончание табл. 2
В фармацевтической промышленности
Из водорослей получают: студне- и слизеобразующие вещества — агар-агар (анфельция, гелидиум), агароиды (филлофора, грацилярия), карраген (хондрус, гигартина, фурцелярия), альгинаты (ламинариевые и фукусовые), кормовую муку, содержащую микроэлементы и йод.
Водоросли участвуют в образовании некоторых типов лечебных грязей.
Химическая промышленность
Человек использует морские водоросли в химической промышленности. Из них получают йод, альгиновую кислоту, агар-агар, калийные соли, целлюлозу, спирт, уксусную кислоту.
Биотопливо
Из-за высокой скорости размножения водоросли применяются для получения биомассы на топливо. Разработано множество различных экспериментальных процессов получения биотоплива (англ.)русск., например, использующих высокие температуры и давления[7].
В науке
Водоросли широко применяют в экспериментальных исследованиях для решения проблем фотосинтеза и выяснения роли ядра и других компонентов клетки.
Существует определенная методика сбора и хранения водорослей.
Исходя из задач, поставленных перед исследователем, определяются места отбора проб, их количество, выбор оборудования, необходимость проведения сбора в конкретное время года и количество выездов.
В качестве оборудования для сбора проб водорослей необходимо подготовить емкости с широким горлом и плотно закрывающимися крышками, нож, лопатку-скребок, полиэтиленовые пакеты, формалин, маркер, этикетки, полевой дневник, карандаш.
Учитывая постоянную динамику состава водорослей в зависимости от динамики параметров среды, постоянного изменения численности различных групп, сбор водорослей проводится в течение всего вегетационного сезона, начиная с ранней весны и заканчивая поздней осенью.
Сбор водорослей в водоемах производится с берега или с помощью лодки. Для сбора используют различные приспособления, позволяющие зачерпнуть пробы на разной глубине. В периоды массового развития водорослей самым простым приспособлением, применяемым для сбора проб, является планктонная сеть (рис. 7) [Топачевский, Масюк]. Для изготовления планктонных сетей используются полиамидные сита, имеющие большую прочность и определенный размер отверстий. Размер ячеек полиамидных сит варьирует от 0,064 до 1,364 мм. При работе с сетью ее протягивают через толщу воды, в результате чего на ткани остаются относительно крупные водоросли (мелкие формы просачиваются через ткань). Сеть имеет форму сачка, на
металлическом кольце размещается капроновый мешок, на дне которого располагается металлический или пластиковый стаканчик, в котором оседают водоросли. Сеть применяется при поверхностном сборе водорослей. Ее используют как непосредственно для забора проб, протягивая через толщу воды, так и для фильтрации воды и сгущения проб водорослей. Далее сконцентрированные пробы водорослей из стаканчика переносят в чистый сосуд или герметично закрывающийся полиэтиленовый пакет, который маркируется, а информация о пробе заносится в полевой дневник. Собранные пробы можно изучать в живом состоянии или зафиксировать для дальнейших исследований.
Вертикальный сбор проб фитопланктона производится с использованием различных емкостей и сетей, погружаемых на определенную глубину [Киселев]. Для сбора водорослей из определенных горизонтов толщи воды используют бутыли с крышкой или батометры.
Батометры или бутыли Майера — это приборы различной конструкции, используемые для взятия проб воды на разной глубине. Эти приборы оборудованы специальными клапанами и кранами для закрывания и открывания под водой (рис. 8).

Рис. 7. Планктонная сеть Апштейна:
1 — обод; 2 — полоса плотной материи для прикрепления фильтрационного конуса к ободу; 3 — стропа, соединяющая обод и стаканчик; 4 — фильтрационный конус; 5 — стаканчик; 6 — силиконовая трубка; 7 — шаровой кран

Рис. 8. Батометры и бутыли разных конструкций для сбора проб водо-рослей на разной глубине водоемов [по: Ask..]
Сбор фитобентоса на мелководье производится с использованием обыкновенных сосудов или сифонов, засасывающих поверхностный слой донного ила. На глубине часто используют грабельки, «кошки», илососы, дночерпатели или драги (рис. 9).

Рис. 9. Приспособления для сбора бентосных водорослей:
1 — грабельки; 2 — серпообразный нож; 3 — якорьки-«кошки»; 4 — драга Раменского
(ширина 35 см); 5 — гидробиологическая драга; 6 — трубчатый дночерпатель [по:
Садчиков и др., с. 39, с изм.]
Сбор прикрепленных водорослей проводится при помощи ножа или лопатки-скребка, соскабливающего слой водорослей с поверхности камней, растений, раковин моллюсков и различных подводных конструкций. Собранный материал переносят в сосуды или пакеты и маркируют. Для лучшей сохранности объектов рекомендуется собирать небольшие кусочки субстрата с прикрепленными к ним особями. Собранные образцы помещают в пакеты или стеклянные емкости и фиксируют 4 %-ным раствором формальдегида.
Сбор крупных водорослей проводят в емкости, наполненные водой. Каждая емкость маркируется пронумерованными этикетками, подробная информация о которых заносится в полевой дневник.
Для количественной оценки содержания водорослей в пробе собранные пробы фильтруют через планктонную сеть. Объем воды, проходящий через фильтр, можно приблизительно рассчитать по формуле v = izt^d, где v — объем воды, фильтруемой через сеть; г— радиус сети; d — расстояние, на которое была протянута сеть.
Пробы водорослей, собранные различными способами, необходимо в дальнейшем сконцентрировать. Существует три основных метода извлечение водорослей:
1) центрифугирование;
2) фильтрация через бумажные (№ 42), мембранные или бактериальные фильтры;
3) отстаивание.
Центрифугирование проводят с использованием электрической центрифуги, в которую помещают образцы (5-20 мл) на 10-20 мин, при скорости 1500-2000 об/мин. В пробы добавляется несколько капель 1 % алюмокалиевых квасцов, формалин или раствор Люголя. Метод применяется для концентрирования как живого, так и фиксированного материала.
Сгущение проб для концентрирования живого и фиксированного материала также проводится методами прямой и обратной фильтрации. Прямая фильтрация используется для проб с низким содержанием фитопланктона и незначительным количеством примесей органического и неорганического происхождения. При этом используется вакуумный источник, создающий разряжение 0,2-0,3 атм. Пробы пропускаются через фильтры с разным диаметром пор. Выбор фильтров зависит от задач и объектов исследования. Обычно используются «предварительные» (диаметр отверстия 2-5 мкм) и мелкопористые мембранные фильтры (диаметр — от 1 до 0,3 мкм). Для мелких водорослей могут применяться бактериальные фильтры.
Метод обратной фильтрации, при котором пробы прогоняются через фильтр снизу вверх, является наиболее щадящим, хорошо сохраняющим клетки и пригодным для всех групп фитопланктона.
Собранные пробы можно поместить в стеклянные трубчатые сосуды и оставить отстаиваться на 15-20 дней в темном месте. В дальнейшем воду из верхней части сосуда аккуратно отсасывают с помощью трубки с фильтром на конце, а полученную концентрированную пробу исследуют. Также сгущение можно провести с использованием бактериальных фильтров [Лемеза].
Важным этапом работы является фиксирование собранного материала. Можно сохранить собранные водоросли в живом состоянии несколько часов, если поместить их в холодильник, после чего пробы необходимо незамедлительно исследовать. Исследования живых образцов позволит избежать ошибок, связанных с изменением формы тела водорослей, окраски хлоропластов, потерей жгутиков, вплоть до полного разрушения клеток.
Для длительного сохранения проб водорослей используют различные фиксаторы (табл. 2). Однако на сегодняшний день не существует универсального фиксатора, позволяющего сохранять пробы различных групп водорослей. Одними из самых распространенных консервирующих растворов являются 4 %-ный раствор формальдегида и раствор Люголя (хотя содержащийся в аптечном Люголе глицерин способствует образованию в пробах шариков) [Лемеза].
Водоросли, собранные вместе с субстратом, и фильтры с водорослями помещают в 4 %-ный раствор формальдегида. Раствор кислого формалина подходит для сохранения панцирных форм водорослей (динофлагелляты и диатомовые водоросли). Хорошо зарекомендовал себя также раствор формальдегида и хромовых квасцов (5 мл 4 %-ного формальдегида и 10rK2SO4- Cr2(S04)3-24 H20 в 500 мл воды). Зафиксированные пробы могут длительное время храниться в темном прохладном месте. Раствор кислого формалина может быть нейтрализован добавлением карбоната кальция.
Раствор Люголя, состоящий из 10 г йода и 20 г йодида калия, растворенных в 200 мл дистиллированной воды с добавлением 20 г ледяной уксусной кислоты, подходит для фиксации одноклеточных жгутиковых и реснитчатых форм планктона, так как хорошо сохраняет жгутики и реснички. Раствор можно хранить в темной склянке до нескольких месяцев. При проведении анализов его добавляют в соотношении 1 : 5.
Альгологи часто применяют раствор, разработанный в Институте озероведения РАН: 3 части кристаллического йода (I), 10 частей йодида калия (KI), 5 частей CH3COONa, кристаллик тимола на 100 частей воды. Раствор добавляют в сгущенную пробу до получения чайного цвета.
Таблица 2
Фиксаторы и красители, используемые при исследованиях водорослей
| Клетки водорослей и органоиды | Реактив | Особенности приготовления и использования фиксаторов и красителей |
| Водные пробы фитопланктона | Раствор формальдегида | 4 %-ный раствор формальдегида (формалина), фиксатор |
| | Раствор формальдегида и хромовых квасцов | 5 мл 4 %-ного формальдегида и 10 г K2S04 • Cr2(S04)3 • 24 H20 в 500 мл воды; фиксатор |
| | Раствор Люголя | 1 г кристаллического йода (I) и 1 г йодида калия (KI) в 100 мл воды; окрашивает крахмал в синий цвет, используется как фиксатор |
| | Люгольтимоловый фиксатор | 3 части кристаллического йода (I), 10 частей йодида калия (KI), 5 частей СН3COONa, кристаллик тимола на 100 частей воды. Раствор добавляют в сгущенную пробу до получения чайного цвета; фиксатор |
| Одноклеточные жгутиковые и реснитчатые формы фитопланктона | Раствор Люголя | 10 г йода (I) и 20 г йодида калия (KI), растворенные в 200 мл дистиллированной воды с добавлением 20 г ледяной уксусной кислоты, добавляют в соотношении 1: 5; фиксатор, краситель |
| Панцирные формы водорослей | Раствор кислого формалина | Используется как фиксатор |
| Водоросли без клеточной оболочки | Раствор метанола | Используется как фиксатор |
| Цитология и ультраструктура клеток водорослей | Оксид осмия | 2 %-ный раствор, не подлежит длительному хранению; используется как фиксатор |
| Клетки водорослей | Оксид осмия | 2 %-ный раствор, не подлежит длительному хранению; краситель |
| Вакуоли с клеточным соком | Нейтральный красный | Слабый раствор; краситель |
Продолжение табл. 2
| Клетки водорослей и органоиды | Реактив | Особенности приготовления и использования фиксаторов и красителей |
| Митохондрии | Зелень Януса | 0,1 %-ный раствор в присутствии кислорода; краситель |
| Аппарат Гольджи (АГ) | Оксид осмия | 2 %-ный раствор, не подлежит длительному хранению; темное окрашивание |
| | Трипановый голубой | 0,5 %-ный водный раствор, окрашивает содержимое клетки в голубой цвет; АГ не меняет цвет |
| Ядра | Спиртово-уксус-ный фиксатор Кларка | 96 %-ный этиловый спирт и ледяную уксусную кислоту смешивают в пропорции 6:1. Водоросли выдерживают в растворе 3 ч, промывают 96 %-ным спиртом (2 мин), далее — водой (10 мин) |
| | Жидкость Карнуа | 96 %-ный этиловый спирт, хлороформ и ледяную уксусную кислоту смешивают в пропорции 6:3:1. Водоросли вьщерживают в растворе 3 ч, промывают 96 %-ным спиртом (2 мин), далее — водой (10 мин) |
| Жгутики | Окрашивание по Лефлеру | 1. Фиксация оксидом осмия; 2. Промывание абсолютным спиртом, высушивание; 3. Окрашивание несколькими каплями красителя (100 мл 20 %-ного водного раствора танина, 50 мл насыщенного водного раствора FeS04, 10 мл насыщенного спиртового раствора фуксина); 4. Нагревание на пламени горелки; 5. Промывание дистиллированной водой (10 мин); 6. Окрашивание карболфуксином (100 мл 5 %-ного водного раствора свежеперегнанного фенола и 10 мл насыщенного спиртового раствора фуксина; отстоять, профильтровать, хранить длительное время); 7. Промывание дистиллированной водой; 8. Сушка; 9. Обработка канадским бальзамом |
Окончание табл. 2
