ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 285
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Рис. 3.1. Упрощенная схема масс-спектрометра
60
Источник ионов. Перевод некоторой части исследуемого вещества в ионизированное состояние в масс-спектрометрах производится с помощью ионных источников (за исключением случаев, когда вещество уже находится в ионизированном состоянии). В ионных источниках применяются различные способы ионизации образца, такие как электронный или ионный удары, фотоионизация, вакуумный искровой разряд, тлеющий импульсный разряд и др. В настоящее время наиболее распространены матрично-активированная лазерная десорбция/ионизация (МАЛДИ) и ионизация электрораспылением (ИЭР). Эти методы ионизации были специально разработаны для анализа нелетучих полярных соединений — пептидов/белков, поли- и олигосахаридов, а также многих других.
Масс-анализатор. Метод масс-спектрометрического анализа основан на разделении ионов исследуемого вещества по величинам отношения m/z (m — масса иона, z — его заряд) и измерении этих величин. Устройства для разделения пучков ионов называют анализаторами. В масс-спектрометрах оно осуществляется различными методами. Статический метод основывается на раздельном или совмещенном в пространстве воздействии на пучок ионов статических электрического и магнитного полей и реализуется в магнитно-секторных приборах. В таких приборах ионы, имеющие разные массу и заряд, при своем движении в зависимости от отношения m/zотклоняются на разный угол. В настоящее время эти приборы морально устарели. Динамический метод основан на том, что ионы, имеющие различные массы и заряды, двигаются в создаваемом четырьмя электродами переменном электрическом поле по спиральным траекториям разного радиуса, что реализуется в приборах с «квадруполь-ным» анализатором. В этих приборах ионы с определенным (заданным) отношением m/zсходятся к оси движения, в то время как траектории других ионов удаляются от нее. Еще один вариант динамического метода основывается на том, что ионы, обладающие одинаковой кинетической энергией, но разной массой, имеют разные скорости и поэтому проходят равные расстояния за разное время. Этот вариант реализуется в приборах с времяпролетным (TOF) анализатором (от англ. time-of-flight), которые получили наибольшее распространение и используются совместно с источниками ионов МАЛДИ и реже ИЭР.
Детектор. Определение концентраций веществ или изотопов в образце производится путем измерения ионных токов разделенных ионов. При этом в качестве детектора используются вторично-электронные умножители или микроканальные пластины. Результаты измерений представляются обычно в виде масс-спектра и/или в форме таблицы данных.
61
Современные методы масс-спектрометрии, применяемые для изучения олиго- и полисахаридов
Масс-спектрометрия с ионизацией электрораспылением (ИЭР МС) начала стремительно развиваться с конца восьмидесятых годов прошлого столетия. Вместе с методом матрично-активированной лазерной десорбции/ионизации (МАЛДИ МС), этот метод открыл новые возможности для изучения высокомолекулярных соединений всех типов, включая белки, нуклеотиды, природные и синтетические полимеры.
Масс-спектрометрия с ионизацией электрораспылением (ИЭРМС)
Процесс, позволяющий перевести ионы из раствора в газовую фазу, в которой они могут быть легко подвергнуты масс-спектрометрическому анализу, имеет огромное значение, потому что практически половина химических и биохимических реакций протекают с участием ионов, находящихся в растворах. Таким процессом является электрораспыление.
Три особенности метода ИЭР отличают его от других методов ионизации: 1 — продуцирование большого количества многократно заряженных ионов соединений с большой молекулярной массой, которые можно регистрировать с помощью практически любых типов масс-анализаторов, поскольку, как уже было отмечено, масс-спектрометр измеряет отношение массы к заряду; 2 — исследуемые соединения должны вводиться в прибор в растворенном виде, что позволяет естественным образом сочетать ИЭР МС с хроматографическими приборами; 3 — «мягкость» процесса ионизации электрораспылением, что позволяет получить ионы лабильных и полярных соединений, сохранить в газовой фазе не-ковалентно связанные комплексы, существующие в растворе, и изучать третичные молекулярные конформации биополимеров.
Масс-спектрометрия с ионизацией электрораспылением была впервые представлена общественности Джоном Фенном в 1984 году (Yamashita, Fenn, 1984). Однако, группой под руководством Л.Н. Галль (Институт аналитического приборостроения РАН) примерно в это же время была предложена альтернативная разработка метода экстракции ионов при атмосферном давлении (ЭРИАД) (Aleksandrov et al., 1984). Развитие метода ИЭР МС с 1984 года позволило показать его возможности как имеющего огромное значение в развитии новых биохимических приложений. В 2002 году Джону Фенну и Кончи Танаке была присуждена Нобелевская премия за развитие масс-спектрометрии в области белковой химии.
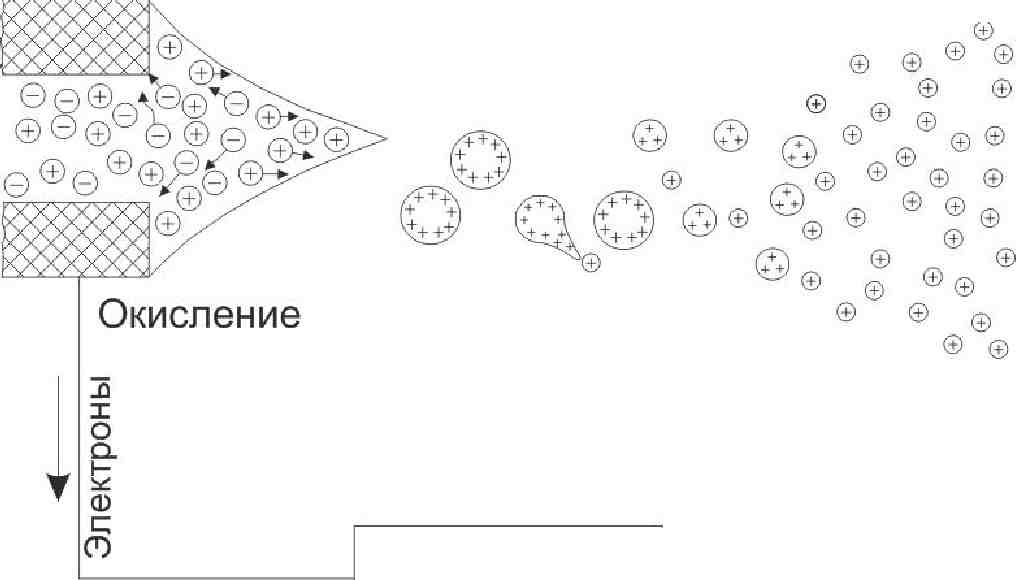
Схематическое представление процесса формирования заряженных капель представлено на рис. 3.2. Напряжение в 2—4 кВ прилагается к металлическому капилляру с внешним диаметром 0.2 мм и внутрен-
62
ним — 0.1 мм, расположенному на расстоянии 1—3 см от противо-электрода. Противоэлектрод в ИЭР МС может быть пластиной с отверстием, ведущим в систему ввода образца масс-спектрометра. При включении источника высокого напряжения, электрическое поле на кончике электрода пронзает раствор и положительные, а также отрицательные ионы электролита в растворе начинают движение под действием поля до тех пор, пока распределение заряда не создаст противодействие наведенным полем.
Восстановление
К масс-анализатору
© —►
Источник
Высокого
Напряжения
Электроны
Рис. 3.2. Схематическое представление процесса формирования заряженных капель в источнике ИЭР
В итоге результирующее поле внутри жидкости будет равно нулю. Когда на капилляре присутствует положительное напряжение - катионы начнут движение в растворе вдоль поля, в сторону мениска жидкости, а анионы — в обратном направлении от мениска. Взаимное отталкивание положительных ионов на поверхности превосходит силу поверхностного натяжения жидкости, и поверхность начинает расширяться, позволяя положительным ионам и растворителю двигаться вдоль поля. Формируется конус, так называемый конус Тэйлора (Taylor, 1964), и, если приложенное поле достаточно сильное, тонкая струя срывается с кончика конуса и разбивается на множество заряженных капель. Они оказываются положительно заряженными благодаря избытку положительных ионов электролита на поверхности конуса и в струе. Таким образом, если, например, электролитом, присутствующим в растворе, является NaCl, то избыточными положительными ионами будут ионы Na+.
63
Масс-спектрометрия с матрично-активированной лазерной десорбцией/ионизацией (МАЛДИ МС)
Масс-спектрометрия МАЛДИ (от англ. MALDI, Matrix Assisted Laser Desorption/Ionization) — десорбционный метод «мягкой» ионизации, обусловленной воздействием импульсов лазерного излучения на матрицу с анализируемым веществом (рис. 3.3). Матрица представляет собой химическое соединение, свойства которого позволяют снижать деструктивные свойства лазерного излучения и обеспечить ионизацию анализируемого вещества. МАЛДИ масс-спектрометрия находит широкое применение для анализа нелетучих высокомолекулярных соединений (пептиды, белки, углеводы, олигонуклеотиды, высокомолекулярные неорганические соединения, и другие синтетические и природные биополимеры).
Лазер__ Молекулы Впервые возможность
исследуемого применения матрицы для ^- вещества подавления фрагментации
/ при анализе нелетучих ор-
атрица yfганических соединений на
^ примере белков и пептидов
Щбыла продемонстрирована в
1988 году Карасом и Хиллен-
4Щ кампом (Hillenkamp, Karas,
———--—— . 1990, Karas, Hillenkamp,
Подложка 1ГЮоЛ
1988). Ключевым моментом
Рис. 3.3. Схематическое представление процесса метола является ИСПОЛЬЗО-МАЛДИ в ионном источнике масс-спектрометра вание матрицы, С ПОМОЩЬЮ
которой и происходит десорбция/ионизация. К достоинствам метода можно отнести низкое влияние избыточных количеств солей, буфера, детергентов и др. в образце на процесс образование ионов (Chen et al., 1998, Knochenmuss, 2002), a также формирование в основном однозарядных квазимолекулярных ионов исследуемых соединений. Последнее свойство метода дает возможность анализировать сложные смеси.
Метод МАЛДИ МС считается более чувствительным по сравнению с масс-спектрометрическими методами с другими способами ионизации. Благодаря тому, что число молекул матрицы значительно превосходит число молекул анализируемого вещества молекулы образца оказываются изолированными друг от друга, что препятствует кластеризации, снижающей вероятность формирования молекулярного иона образца. Матрица также минимизирует разрушение образца лазерными импульсами путем сорбирования большей части энергии и увеличивает эф-
64
фективность переноса энергии лазера к молекулам образца. С помощью времяпролетного МАЛДИ масс-спектрометра возможно детектирование фемтомольных количеств белков с молекулярными массами 300 и более кДа (Spengler, Cotter, 1990, Talrose et al, 1999).
Метод МАЛДИ МС был применен для анализа углеводов практически сразу же после первых сообщений его разработчиков об успешном анализе пептидов и белков с использованием Nd-YAG лазера (266 нм) и никотиновой кислоты в качестве матрицы (Karas et al., 1987). Стоит отметить, что эффективность ионизации нейтральных олигосахаридов методом МАЛДИ МС остается постоянной с увеличением размеров молекулы, в отличие от ИЭР МС, где эффективность ионизации уменьшается с увеличением молекулярной массы (Harvey, 1993). Однако, фосфорилированные, сульфатированные или содержащие сиаловую кислоту поли- и олигосахариды успешно анализируются методом ИЭР МС в режиме регистрации отрицательных ионов.
Необходимо отметить, что первые работы по применению масс-спектрометрии ИЭР (ЭРИАД, см. выше) для исследования реакционных смесей, содержащих олигосахариды (Александров и др., 1986), а также по изучению реакций, катализируемых карбогидразами (Безукладников и др., 1989), были проведены в ТИБОХ ДВО РАН, совместно с Институтом аналитического приборостроения РАН.
Тандемная масс-спектрометрия (МС/МС)
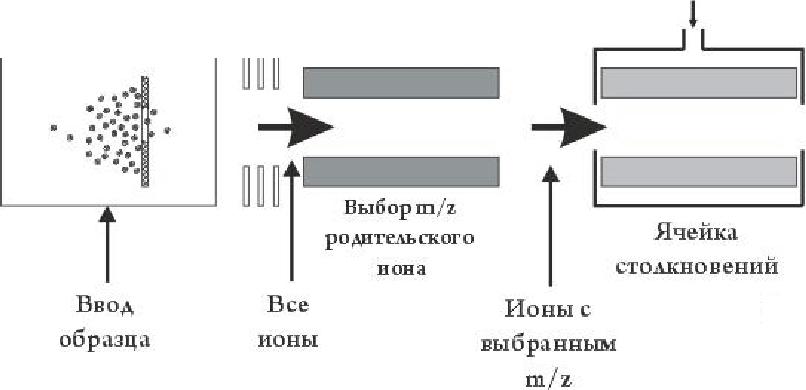
Тандемная масс-спектрометрия (сокращенно МС/МС) — любой масс-спектрометрический метод, использующий как минимум два этапа масс-анализа в совокупности как с процессами диссоциации, так и с химическими реакциями, вызывающими изменения в массе или заряде иона (Безукладников и др. 1988, Cooks et al., 1973, McLafferty, 1983).
Источник ионов
Первый масс- анализ атор
Инертный газ
Фрагментные ионы
Второй масс - анализ атор
Выбор фрагментных
ИОНОВ
Детектор
Д ете ктир ов ание
и запись m/z
фрагментных
ионов
Рис. 3.4. Схема тандемного масс-спектрометра с ионизацией электрораспылением
В самом общем случае, при проведении тандемного масс-анализа первый анализатор (рис. 3.4) используется для выделения иона-пред-
65
шественника («родительского» иона), который затем подвергается декомпозиции (спонтанно или путем активации, например, при соударении с нейтральными молекулами инертного газа) на фрагментные ионы и нейтральные фрагменты: m+ ->m+f + тп
Второй масс-анализатор регистрирует образовавшиеся ионы-продукты. Существует возможность увеличения числа МС-шагов: выбрать первый ион, затем выбрать второй ион из полученных фрагментов, и, наконец, анализировать фрагменты последнего выбранного иона. Такая последовательность шагов называется МС/МС/МС или МС3. Число шагов может быть увеличено до получения МСп-эксперимента, где п соответствует номеру поколения анализируемых ионов. Развитие тандемных масс-анализаторов для анализа биологических макромолекул дало возможность выбирать индивидуальный «родительский» ион и получать требуемую фрагментацию, устраняя тем самым необходимость выделения индивидуальных компонентов смеси в гомогенном состоянии. Развитие методов МАЛДИ МС и особенно ИЭР МС существенно расширило возможности тандемной масс-спектрометрии олиго- и полисахаридов.
Масс-спектрометрическая фрагментация как метод установления структурных особенностей исследуемых соединений
