ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 45
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Хімічні властивості.
Структурні формули нітратної кислоти та їх пояснення див.
У HNO3 валентність нітрогену дорівнює 4, ступінь окиснення +5, координаційне число нітрогену 3.
Розведена нітратна кислота має всі властивості кислот. Вона належить до сильних кислот. У водних розчинах дисоціює:
HNO3 ⇆ Н+ +NO3-.
Під дією теплоти і світла частково розкладається:
4HNO3 = 4NO2 + 2Н2О + O2.
Тому зберігають її в прохолодному і темному місці. Найважливіша хімічна властивість нітратної кислоти полягає в тому, що вона є сильним окисником і взаємодіє майже з усіма металами.
27.
Фосфор в природі. Отримання та властивості, біологічна роль. Сполуки фосфору: оксиди, кислоти, солі.
Фосфор — аналог нітрогену, оскільки електронна конфігурація його валентних електронів, як і у нітрогену, s2p3. Однак порівняно з атомом нітрогену атом фосфору має меншу енергію іонізації і більший радіус (див. п. З та п. 6, табл. 10.1). Це означає, що неметалічні ознаки у фосфору виражені слабкіше, ніж у нітрогену. Тому для фосфору рідше буває ступінь окиснення —З і частіше +5. Мало характерні й інші ступені окиснення
Поширення у природі. Загальний вміст фосфору в земній корі становить 0,08 %. У природі фосфор трапляється лише у вигляді сполук; найважливіша з них — фосфат кальцію — мінерал апатит. Відомо багато різновидів апатиту, з яких найбільш поширений фторапатит ЗСа3(РO4)2 ∙ CaF2. З різновидів апатиту складаються осадові гірські породи — фосфорити. Фосфор входить також до складу білкових речовин у вигляді різних сполук. Вміст фосфору у тканинах мозку становить 0,38 %, у м’язах — 0,27 %.
Найбагатші у світі поклади апатитів розташовані поблизу м. Кіровська на Кольському півострові. Фосфорити дуже поширені на Уралі, в Поволжі, в Сибіру, Казахстані, Естонії, Білорусії та ін. Великі родовища фосфоритів є у Північній Африці, Сирії та США.
Фосфор необхідний для життя рослин. Тому у ґрунті завжди має бути достатня кількість сполук фосфору.
Фізичні властивості. Зменшення неметалічності елемента фосфору порівняно з нітрогеном позначається на властивостях його простих речовин. Так, фосфор на відміну від азоту має кілька алотропічних модифікацій: білий, червоний, чорний тощо.
Білий фосфор — безбарвна і дуже отруйна речовина. Добувають конденсацією пари фосфору. Не розчиняється у воді, але добре розчиняється у сірковуглеці. За тривалого слабкого нагрівання білий фосфор переходить у червоний.
Червоний фосфор — порошок червоно-бурого кольору, не отруйний. Не розчиняється у воді й сірковуглеці. Встановлено, що червоний фосфор являє собою суміш кількох алотропічних модифікацій, які відрізняються одна від одної за кольором (від червоного до фіолетового) та деякими іншими властивостями. Властивості червоного фосфору багато в чому залежать від умов його добування.
Чорний фосфор за зовнішнім виглядом схожий на графіт, масний на дотик, має властивості напівпровідників. Добувають тривалим нагріванням білого фосфору під великим тиском (200 °С і 1 200 МПа).
Червоний і чорний фосфор при сильному нагріванні сублімуються.
Природний фосфор складається з одного стабільного ізотопу 3115 Р. Широко застосовується штучний радіоактивний ізотоп 3215Р (період напіврозпаду 14,3 доби).
Властивості алотропічних модифікацій - фосфору пояснюються їх будовою. Детальніше вивчено будову білого фосфору. Він має молекулярну кристалічну решітку.
Кожний атом фосфору розташований в одній з вершин піраміди і зв’язаний трьома о-зв’язками з іншими трьома атомами. Як усі речовини з молекулярною решіткою, білий фосфор легко плавиться і леткий. Він добре розчиняється в органічних розчинниках.
На відміну від білого фосфору червоний і чорний фосфори мають атомну кристалічну решітку. Тому вони нерозчинні майже у всіх розчинниках, але леткі і, як уже зазначалося, не отруйні.
Хімічні властивості. У хімічному відношенні білий фосфор дуже відрізняється від червоного. Так, білий фосфор легко окиснюється і самозаймається на повітрі, тому його зберігають під водою. Червоний фосфор не загоряється на повітрі, але загоряється при нагріванні понад 240 °С. При окисненні білий фосфор світиться в темряві — відбувається безпосереднє перетворення хімічної енергії на світлову.
У рідкому і розчиненому стані, а також у парі при температурі нижчій за 800 °С фосфор складається з молекул Р4. При нагріванні понад 800 °С молекули дисоціюють: Р4 ⇆ 2Р2. Останні при температурі понад 2 000°С розкладаються на атоми: Р
2 ⇆ 2Р. Атоми фосфору можуть об’єднуватися в молекули Р2, Р4і в полімерні речовини. Очевидно, молекула Р4, де атоми сполучені між собою трьома σ-зв’язками, міцніша за молекулу Р2, в якій атоми сполучені одним σ- і двома п- зв’язками. Вже за звичайної температури молекула Р2 нестійка
Фосфор сполучається з багатьма простими речовинами — киснем, галогенами, сіркою та деякими металами, виявляючи окисні та відновні властивості. Наприклад:
2Р + 3S = P2S3; 2Р + ЗСа = С3Р2;

Реакції з білим фосфором відбуваються легше, ніж з червоним.
Сполуки фосфору з металами називаються фосфідами. Вони легко розкладаються водою з утворенням фосфіну РН3
— дуже отруйного газу із запахом часнику:
Са3Р2 + 6Н2О = ЗСа(ОН)2 + 2РН3 ↑.
За аналогією з NH3 фосфін здатний до реакції приєднання:
РН3 + Нl = РН4l.
Добування і застосування. Фосфор добувають з апатитів або фосфоритів. Останні змішують з вугіллям (коксом) та піском і прожарюють в електричній печі при 1 500 °С:
+5 0 0 +2
2Са3(РO4)2 + 10С + 6SiO2 = бСаSіО3 + Р4 + 10СО;
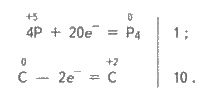
Під час реакції пару фосфору згущують і вловлюють у приймачі з водою.
Червоний фосфор застосовують у виробництві сірників. З червоного фосфору, сульфіду стибію(ІІІ), залізного сурику (природного оксиду феруму(ІІІ) з домішкою кварцу) та клею виготовляють суміш, яку наносять на бічні поверхні сірникової коробки. Головки сірників складаються головним чином з бертолетової солі, молотого скла, сульфуру та клею. Під час тертя головки по намазці сірникової коробки червоний фосфор займається, підпалює склад головки, а від нього загоряється дерево.
Білий фосфор широкого застосування не має. Звичайно його використовують для утворення димових завіс. Чорний фосфор застосовується дуже рідко.
Оксиди фосфору і фосфатні кислоти
Оксиди фосфору. Фосфор утворює декілька оксидів. Найважливішими з них є Р4О6 та Р4О10. Часто їх формули пишуть у спрощеному вигляді як Р2О3 та Р2О5 (індекси попередніх поділено на 2).
Оксид фосфору(ІІІ) Р4О6 — воскоподібна кристалічна маса, яка плавиться при 22,5 °С. Добувають спалюванням фосфору при недостатній кількості кисню. Сильний відновник. Дуже отруйний.
Оксид фосфору(V) Р4О10 — білий гігроскопічний порошок. Утворюється під час згоряння фосфору у надлишку повітря або кисню. Він дуже енергійно сполучається з водою, а також віднімає воду від інших сполук. Використовують як осушувач газів і рідин.
Оксиди і всі кисневі сполуки фосфору набагато міцніші за аналогічні сполуки нітрогену, що слід пояснити ослабленням неметалічних властивостей у фосфору порівняно з нітрогеном.
Фосфатні кислоти. Оксид фосфору (V) Р4О10, взаємодіючи з водою, утворює триметафосфатну кислоту Н3(РО3)3 (спрощено її формулу часто пишуть НРО3); остання під час кип'ятіння з надлишком води утворює ортофосфатну, або фосфатну, кислоту Н3РО4; при нагріванні Н3РО4 утворюється дифосфатна кислота Н4Р2О7:
3P4O16 + 6H2O = 4H3(PO3)3;
Н3(РО3)3 + ЗН2О = ЗН3РО4;
2Н3РО
4 = Н4Р2О7 + Н2O.
Найбільше практичне значення має фосфатна кислота, оскільки її солі використовуються як добрива.
Фосфатна кислота — біла тверда речовина. З водою змішується в будь-яких співвідношеннях. На відміну від нітратної кислоти не є окисником і не розкладається при нагріванні, що пояснюється найбільшою стійкістю ступеня окиснення +5 з усіх можливих для фосфору. У промисловості фосфатну кислоту добувають двома способами: екстракційним і термічним.
За першим способом подрібнений фосфат кальцію обробляють сульфатною кислотою:
Са3 (РO4)2 + 3H2SO4 = 2Н3РО4 + 3CaSO4 ↓.
CaSO4 випадає у вигляді осаду, а кислота залишається в розчині. Разом з кислотою в розчин переходить багато домішок — сульфати феруму, алюмінію та ін. Така кислота використовується при виробництві добрив.
Другим способом спочатку добувають фосфор (відновленням природного фосфору в електропечі). Далі його окиснюють до оксиду Р4О10, а останній сполучають з водою і дістають чисту кислоту (концентрація до 80 %).
Солі фосфатної кислоти. У молекулі фосфатної кислоти атоми гідрогену сполучені з атомами оксигену
У водному розчині фосфатна кислота дисоціює ступінчасто. Як триосновна кислота, вона утворює солі — фосфати — трьох видів:
1) фосфати — заміщено всі атоми гідрогену у фосфатній кислоті, наприклад К3РО4 — фосфат калію, (NH4)3PO4 — фосфат амонію;
2) гідрофосфати — заміщено два атоми гідрогену кислоти, наприклад К2НРО4 — гідрофосфат калію, (NH4)2HPO4 — гідрофосфат амонію;
3) дигідрофосфати — заміщений один атом гідрогену кислоти, наприклад КН2РО4 — дигідрофосфат калію, NH4H2PO4 — дигідрофосфат амонію.
Усі фосфати лужних металів і амонію розчиняються у воді. З кальцієвих солей фосфатної кислоти розчиняється у воді лише дигідрофосфат кальцію Са (Н


