ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 51
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
4 = 12С + nH2SO4 ∙ 11Н2O.
Вугілля, що утворилося, частково вступає у взаємодію з кислотою:
С + 2H2SO4 = СО2 + 2SO2 + 2Н2O.
Тому кислота, що надходить у продаж, має бурий колір від пилу й органічних речовин, які випадково потрапили в розчин і обвуглилися.
На поглинанні (відбиранні) води сульфатною кислотою базується осушування газів.
Як сильна нелетка кислота, H2SO4 витісняє інші кислоти із сухих солей. Наприклад:
NaNO3 + H2SO4 = NaHSO4 + HNO3.
Однак, якщо H2SO4 додають до розчинів солей, то витіснення кислот не відбувається.
Дуже важлива хімічна властивість сульфатної кислоти — взаємодія її з металами. Розведена і концентрована сульфатна кислота реагує з ними по-різному.
Розведені розчини сульфатної кислоти розчиняють метали, розташовані в ряду стандартних електродних потенціалів до водню. Однак на поверхні свинцю утворюється плівка PbSO4, яка захищає його від подальшої взаємодії з кислотою. Метали, розташовані в ряду стандартних електродних потенціалів після водню, з розведеними розчинами H2SO4 не взаємодіють.
Концентрована сульфатна кислота за звичайної температури з багатьма металами не реагує. Тому безводну сульфатну кислоту можна зберігати у залізній тарі й перевозити у стальних цистернах1. Однак при нагріванні концентрована H2SO4 взаємодіє майже з усіма металами (крім Pt, Au та деяких інших). При цьому вона виступає як окисник, сама відновлюється звичайно до SO2. Водень у цьому випадку не виділяється, а утворюється вода. Наприклад:
Cu
+ 2H2SO4 = CuSO4 + SO2 + 2Н2O.
Сульфатна кислота має всі властивості кислот.
Значення сульфатної кислоти. Сульфатна кислота є важливим продуктом основної хімічної промисловості, що виробляє неорганічні кислоти, луги, солі, мінеральні добрива і хлор.
За різноманітністю застосування сульфатна кислота посідає перше місце серед кислот. Найбільша кількість її витрачається для добування фосфорних та азотних добрив. Як нелетка кислота, сульфатна кислота використовується для добування інших кислот — хлоридної, плавикової, ортофосфатної, ацетатної тощо. Багато її йде для очищення нафтопродуктів — бензину, гасу, мастил — від шкідливих домішок. У машинобудуванні сульфатною кислотою очищають поверхню металів від оксидів перед покриттям (нікелюванням, хромуванням тощо). Сульфатна кйслота застосовується у виробництві вибухових речовин, штучного волокна, барвників, пластмас та ін. її використовують для заливання акумуляторів. У сільському господарстві вона застосовується для боротьби з бур’янами (гербіцид).
24.
Підгрупа Нітрогену, загальна характеристика, отримання та властивості азоту, біологічне значення.
Загальна характеристика підгрупи нітрогену
Підгрупу нітрогену складають п'ять елементів: нітроген, фосфор, стибій, арсен і бісмут. Це р-елементи V групи періодичної системи Д. І. Менделєєва. На зовнішньому енергетичному рівні їх атоми мають по п’ять електронів — ns2 nр3 (п. 2, табл. 10.1). Тому найвищий ступінь окиснення цих елементів дорівнює +5, найнижчий —3, характерний також +3.
На прикладі нітрогену і фосфору розглянемо валентні стани елементів. Електронна будова зовнішніх енергетичних рівнів їх атомів така:
У атома нітрогену є три неспарених електрони. Тому валентність нітрогену дорівнює трьом.
N2O3 — кислотний оксид; Р4О6 — слабкокислотний оксид; AS2O3 — амфотерний оксид з переважанням кислотних властивостей; SbО3 — амфотерний оксид з переважанням основних властивостей; Вl2О3 — основний оксид. Отже, кислотні властивості оксидів складу R2O3 та R2O5зменшуються зі зростанням порядкового номера елемента .
Азот у природі трапляється переважно у вільному стані. У повітрі об’ємна частка його становить 78,09 %, а масова частка — 75,6 %. Сполуки нітрогену в невеликих кількостях є у ґрунті. Нітроген входить до складу білкових речовин і багатьох природних органічних сполук. Загальний вміст азоту у земній корі становить 0,01 %.
Добування.
У техніці азот добувають з рідкого повітря. Як відомо, повітря — це суміш газів, переважно азоту і кисню. Сухе повітря біля поверхні Землі містить (в об’ємних частках): азоту 78,09 %, кисню 20,95 %, благородних газів 0,93 %, оксиду карбону (IV) 0,03 %, а також випадкові домішки — пил, мікроорганізми, сірководень, оксид сульфуру (IV) та ін. Для добування азоту повітря переводять у рідкий стан, потім випаровуванням відокремлюють азот від менш леткого кисню (т. кип. азоту — 195,8, кисню — 183 °С). Добутий в такий спосіб азот містить домішки благородних газів (переважно аргону). Чистий азот можна добути у лабораторних умовах, розкладаючи під час нагрівання нітрит амонію:
NH4NO2 = N2 ↑ + 2Н2О.
Фізичні властивості.
Азот — газ без кольору, запаху і смаку, легший за
повітря. Розчиняється у воді гірше, ніж кисень: при 20 °С в 1 л води розчиняється 15,4 мл азоту (кисню — 31 мл). Тому в повітрі, розчиненому у воді, вміст кисню відносно азоту більший, ніж в атмосферному. Мала розчинність азоту у воді, а також його дуже низька температура кипіння пояснюються досить слабкими міжмолекулярними взаємодіями як між молекулами азоту і води, так і між молекулами азоту.
Природний азот складається з двох стабільних ізотопів з масовими числами 14 (99,64 %) і 15 (0,36 %).
Хімічні властивості.
Молекула азоту складається з двох атомів. Довжина зв’язку між ними дуже мала — 0,109 нм. Потрійний зв’язок та його мала довжина роблять молекулу дуже міцною (енергія зв’язку 946 кДж/моль). Цим пояснюється мала реакційна здатність азоту при звичайній температурі (порівняти зO2 і Сl2).
При кімнатній температурі азот безпосередньо сполучається тільки з літієм:
6Li + N2 = 2Li3N.
Нітрид літію
З іншими металами він реагує лише при високій температурі, утворюючи нітриди. Наприклад:
ЗСа + N2 = Са3N2; 2Аl + N2 = 2AlN.
Нітрид кальцію Нітрид алюмінію
З воднем азот сполучається за наявності каталізатора, за високих тиску і температури:
N2 + ЗН2 ⇆ 2NH3.
При температурі електричної дуги (3 000—4 000 °С) азот сполучається з киснем:
N2 + O2 ⇆2NO.
Оскільки на зовнішньому енергетичному рівні атома нітрогену розташовано 5 електронів, нітроген виявляє ступені окиснення —3 і +5, а також +4, +3, +2, +1, —1 і —2.
Застосування.
У великих кількостях азот застосовується для добування аміаку. Широко використовується для створення інертного середовища — наповнення електричних ламп розжарювання і вільного простору у ртутних термометрах, при перекачуванні горючих рідин. Ним азотують поверхню стальних виробів, тобто насичують їх поверхню азотом за високої температури. У результаті в поверхневому шарі утворюються нітриди феруму, які надають сталі більшої твердості. Така сталь витримує нагрівання до 500°С без втрати своєї твердості.
Велике значення азот має для життя рослин і тварин, оскільки він входить до складу білкових речовин. Сполуки нітрогену застосовуються у виробництві мінеральних добрив, вибухових речовин і в багатьох інших галузях промисловості.
25.
Аміак, добування та властивості. Солі амонію. отримання, якісні реакції на іон-амонію.
Будова молекули.
Нітроген утворює з гідрогеном кілька сполук, з яких найважливішою є аміак. Електронна формула молекули аміаку така:
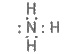
Видно, що з чотирьох електронних пар у нітрогену — три спільні (зв’язуючі) і одна неподілена (незв’язуюча).
Будову молекули NH3 розглянуто раніше. Вона має форму піраміди. Хімічний зв’язокN—Н полярний: позитивний заряд зосереджений на атомах гідрогену, негативний — на атомі нітрогену. Внаслідок цього між молекулами аміаку утворюється водневий зв"язок,що можна зобразити так:
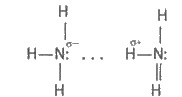
Внаслідок водневих зв"язків аміак має порівняно високі температури плавлення і кипіння, а також значну теплоту випаровування
Вугілля, що утворилося, частково вступає у взаємодію з кислотою:
С + 2H2SO4 = СО2 + 2SO2 + 2Н2O.
Тому кислота, що надходить у продаж, має бурий колір від пилу й органічних речовин, які випадково потрапили в розчин і обвуглилися.
На поглинанні (відбиранні) води сульфатною кислотою базується осушування газів.
Як сильна нелетка кислота, H2SO4 витісняє інші кислоти із сухих солей. Наприклад:
NaNO3 + H2SO4 = NaHSO4 + HNO3.
Однак, якщо H2SO4 додають до розчинів солей, то витіснення кислот не відбувається.
Дуже важлива хімічна властивість сульфатної кислоти — взаємодія її з металами. Розведена і концентрована сульфатна кислота реагує з ними по-різному.
Розведені розчини сульфатної кислоти розчиняють метали, розташовані в ряду стандартних електродних потенціалів до водню. Однак на поверхні свинцю утворюється плівка PbSO4, яка захищає його від подальшої взаємодії з кислотою. Метали, розташовані в ряду стандартних електродних потенціалів після водню, з розведеними розчинами H2SO4 не взаємодіють.
Концентрована сульфатна кислота за звичайної температури з багатьма металами не реагує. Тому безводну сульфатну кислоту можна зберігати у залізній тарі й перевозити у стальних цистернах1. Однак при нагріванні концентрована H2SO4 взаємодіє майже з усіма металами (крім Pt, Au та деяких інших). При цьому вона виступає як окисник, сама відновлюється звичайно до SO2. Водень у цьому випадку не виділяється, а утворюється вода. Наприклад:
Cu
+ 2H2SO4 = CuSO4 + SO2 + 2Н2O.
Сульфатна кислота має всі властивості кислот.
Значення сульфатної кислоти. Сульфатна кислота є важливим продуктом основної хімічної промисловості, що виробляє неорганічні кислоти, луги, солі, мінеральні добрива і хлор.
За різноманітністю застосування сульфатна кислота посідає перше місце серед кислот. Найбільша кількість її витрачається для добування фосфорних та азотних добрив. Як нелетка кислота, сульфатна кислота використовується для добування інших кислот — хлоридної, плавикової, ортофосфатної, ацетатної тощо. Багато її йде для очищення нафтопродуктів — бензину, гасу, мастил — від шкідливих домішок. У машинобудуванні сульфатною кислотою очищають поверхню металів від оксидів перед покриттям (нікелюванням, хромуванням тощо). Сульфатна кйслота застосовується у виробництві вибухових речовин, штучного волокна, барвників, пластмас та ін. її використовують для заливання акумуляторів. У сільському господарстві вона застосовується для боротьби з бур’янами (гербіцид).
24.
Підгрупа Нітрогену, загальна характеристика, отримання та властивості азоту, біологічне значення.
Загальна характеристика підгрупи нітрогену
Підгрупу нітрогену складають п'ять елементів: нітроген, фосфор, стибій, арсен і бісмут. Це р-елементи V групи періодичної системи Д. І. Менделєєва. На зовнішньому енергетичному рівні їх атоми мають по п’ять електронів — ns2 nр3 (п. 2, табл. 10.1). Тому найвищий ступінь окиснення цих елементів дорівнює +5, найнижчий —3, характерний також +3.
| Властивості | N | Р | As | Sb | Ві |
| 1. Порядковий номер | 7 | 15 | 33 | 51 | 83 |
| 2. Валентні електрони | 2s22p3 | 3s23p3 | 4s24p3 | 5s25p3 | 6s26p3 |
| 3. Енергія іонізації атома, еВ | 14,5 | 10,5 | 9,8 | 8,6 | 7,3 |
| 4. Відносна електро негативність | 3,07 | 2,1 | 2,2 | 1,82 | 1,67 |
| 5. Ступінь окиснення у сполуках | +5,+4, +3,+2, +1,-3, -2,-1 | +5,+4, +3,+ 1, -3,-2 | +5,+3, -3 | +5,+3, -3 | +5,+3, -3 |
| 6. Радіус атома, нм | 0,071 | 0,13 | 0,15 | 0,16 | 0,18 |
На прикладі нітрогену і фосфору розглянемо валентні стани елементів. Електронна будова зовнішніх енергетичних рівнів їх атомів така:
У атома нітрогену є три неспарених електрони. Тому валентність нітрогену дорівнює трьом.
N2O3 — кислотний оксид; Р4О6 — слабкокислотний оксид; AS2O3 — амфотерний оксид з переважанням кислотних властивостей; SbО3 — амфотерний оксид з переважанням основних властивостей; Вl2О3 — основний оксид. Отже, кислотні властивості оксидів складу R2O3 та R2O5зменшуються зі зростанням порядкового номера елемента .
Азот у природі трапляється переважно у вільному стані. У повітрі об’ємна частка його становить 78,09 %, а масова частка — 75,6 %. Сполуки нітрогену в невеликих кількостях є у ґрунті. Нітроген входить до складу білкових речовин і багатьох природних органічних сполук. Загальний вміст азоту у земній корі становить 0,01 %.
Добування.
У техніці азот добувають з рідкого повітря. Як відомо, повітря — це суміш газів, переважно азоту і кисню. Сухе повітря біля поверхні Землі містить (в об’ємних частках): азоту 78,09 %, кисню 20,95 %, благородних газів 0,93 %, оксиду карбону (IV) 0,03 %, а також випадкові домішки — пил, мікроорганізми, сірководень, оксид сульфуру (IV) та ін. Для добування азоту повітря переводять у рідкий стан, потім випаровуванням відокремлюють азот від менш леткого кисню (т. кип. азоту — 195,8, кисню — 183 °С). Добутий в такий спосіб азот містить домішки благородних газів (переважно аргону). Чистий азот можна добути у лабораторних умовах, розкладаючи під час нагрівання нітрит амонію:
NH4NO2 = N2 ↑ + 2Н2О.
Фізичні властивості.
Азот — газ без кольору, запаху і смаку, легший за
повітря. Розчиняється у воді гірше, ніж кисень: при 20 °С в 1 л води розчиняється 15,4 мл азоту (кисню — 31 мл). Тому в повітрі, розчиненому у воді, вміст кисню відносно азоту більший, ніж в атмосферному. Мала розчинність азоту у воді, а також його дуже низька температура кипіння пояснюються досить слабкими міжмолекулярними взаємодіями як між молекулами азоту і води, так і між молекулами азоту.
Природний азот складається з двох стабільних ізотопів з масовими числами 14 (99,64 %) і 15 (0,36 %).
Хімічні властивості.
Молекула азоту складається з двох атомів. Довжина зв’язку між ними дуже мала — 0,109 нм. Потрійний зв’язок та його мала довжина роблять молекулу дуже міцною (енергія зв’язку 946 кДж/моль). Цим пояснюється мала реакційна здатність азоту при звичайній температурі (порівняти зO2 і Сl2).
При кімнатній температурі азот безпосередньо сполучається тільки з літієм:
6Li + N2 = 2Li3N.
Нітрид літію
З іншими металами він реагує лише при високій температурі, утворюючи нітриди. Наприклад:
ЗСа + N2 = Са3N2; 2Аl + N2 = 2AlN.
Нітрид кальцію Нітрид алюмінію
З воднем азот сполучається за наявності каталізатора, за високих тиску і температури:
N2 + ЗН2 ⇆ 2NH3.
При температурі електричної дуги (3 000—4 000 °С) азот сполучається з киснем:
N2 + O2 ⇆2NO.
Оскільки на зовнішньому енергетичному рівні атома нітрогену розташовано 5 електронів, нітроген виявляє ступені окиснення —3 і +5, а також +4, +3, +2, +1, —1 і —2.
Застосування.
У великих кількостях азот застосовується для добування аміаку. Широко використовується для створення інертного середовища — наповнення електричних ламп розжарювання і вільного простору у ртутних термометрах, при перекачуванні горючих рідин. Ним азотують поверхню стальних виробів, тобто насичують їх поверхню азотом за високої температури. У результаті в поверхневому шарі утворюються нітриди феруму, які надають сталі більшої твердості. Така сталь витримує нагрівання до 500°С без втрати своєї твердості.
Велике значення азот має для життя рослин і тварин, оскільки він входить до складу білкових речовин. Сполуки нітрогену застосовуються у виробництві мінеральних добрив, вибухових речовин і в багатьох інших галузях промисловості.
25.
Аміак, добування та властивості. Солі амонію. отримання, якісні реакції на іон-амонію.
Будова молекули.
Нітроген утворює з гідрогеном кілька сполук, з яких найважливішою є аміак. Електронна формула молекули аміаку така:

Видно, що з чотирьох електронних пар у нітрогену — три спільні (зв’язуючі) і одна неподілена (незв’язуюча).
Будову молекули NH3 розглянуто раніше. Вона має форму піраміди. Хімічний зв’язокN—Н полярний: позитивний заряд зосереджений на атомах гідрогену, негативний — на атомі нітрогену. Внаслідок цього між молекулами аміаку утворюється водневий зв"язок,що можна зобразити так:

Внаслідок водневих зв"язків аміак має порівняно високі температури плавлення і кипіння, а також значну теплоту випаровування


