ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 44
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
розчину порівняно з відповідними температурами для чистого розчинника (див. рис. З.6.). Згідно з другим законом Рауля(висновок з першого закону): підвищення температури кипіння та зниження температури замерзання розчину відносно чистого розчинника пропорційні молярній концентрації розчиненої речовини:
де Сm — моляльність розчину; Е і К— ебуліоскопічната кріоскопічна сталі,які залежать лише від властивостей розчинника — його температури кипіння (замерзання) Тк(3), молярної маси М і теплоти випаровування (плавлення) ΔНвип(пл), але не залежать від властивостей розчиненої речовини. Наприклад, для води ебуліоскопічна стала
Аналогічно визначають і кріоскопічну сталу.
Ебуліоскопічна та кріоскопічна сталі вказують на підвищення температури кипіння або зниження температури замерзання розчину з концентрацією Ст= 1 моль/кг. Оскільки для таких концентрованих розчинів рівняння не придатні, то сталі Е і К є екстраполяційними, тобто їх визначають експериментально для розведених розчинів із перерахунком на один моль розчиненої речовини.
На зміні температур кипіння та замерзання розчинів базуються ебуліоскопічнийі кріоскопічний методи визначення молекулярних масречовин
де т1і т2 — маси розчиненої речовини та розчинника; М— молярна маса розчиненої речовини. Пунктиром показані залежності тисків компонентів від складу для ідеальних розчинів.
КОНЦЕНТРАЦІЯ РОЗЧИНІВ—це величина, яку вимірюють масою або об’ємом розчиненої речовини, що міститься у певній масі або об’ємі розчину або розчинника. Найчастіше використовують такі способи вираження концентрації: масова частка, молярна, моляльна концентрація, молярна концентрація еквівалента, молярна частка, об’ємна частка та титр. Масову частку речовини Х w(Х) розраховують за формулою:
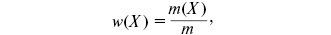
де m(X) — маса розчиненої речовини Х (в кг, г); m – маса розчину (в кг, г). Її виражають у частках одиниці або в %. В останньому випадку розрахунок здійснюють за формулою:

13.
Теорія електролітичної дисоціації, основні положення.
ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
Властивості електролітів узагальнені основоположником теорії електролітичної дисоціації Арреніусом (1887) і розвинуті у працях Кістяківського та Каблукова на основі хімічної теорії розчинів Менделєєва.
В основу теорії електролітичної дисоціаціїпокладено такі положення:
розчинення електроліту супроводжується розпадом його молекул на іони;
електролітична дисоціація є оборотним процесом;
електропровідність розчинів електролітів пропорційна загальній концентрації іонів у розчині.
Арреніус вважав, що молекули електролітів розпадаються на іони не під дією електричного струму, а в процесі розчинення, хоч його теорія не враховувала всієї складності явищ у розчинах. Зокрема, іони вважалися вільними частинками, що не залежали від молекул розчинника. Згідно зі сучасним поглядом, розпад полярних молекул (іонізація)або іонних кристалів(дисоціація)розчиненої речовини на іони відбувається під впливом полярних молекул розчинника, внаслідок чого утворюються хімічні сполуки — сольвати, а коли розчинником є вода — гідрати. Процес гідратації (сольватації) екзотермічний і відбувається спонтанно зі зменшенням ентальпії. Одночасно з дисоціацією відбувається й зворотний процес — асоціація.
Великі за розміром гідратні (сольватні) оболонки іонів заважають останнім при їх зіткненні у розведених розчинах знову утворювати молекули (кристали) вихідних речовин. Взаємодія між
протилежно зарядженими іонами у розчині послаблюється також під впливом розчинників. Мірою такого впливу єдіелектрична проникністьрозчинника. Чимбільше значення діелектричної проникності середовища, тим краще дисоціює електроліт (правило Нернста, 1894):
де F—сила взаємодії між іонами; zК і zа — заряди катіона та аніона; e — заряд електрона; NA — число Авогадро; έ — діелектрична проникність середовища; r- віддаль між центрами іонів.
Енергія електростатичної взаємодії у воді у 81 раз менша, ніж у вакуумі, тому у воді електроліти дисоціюють значно ліпше, ніж у розчинниках з малими значеннями є. У бензолі та інших подібних розчинниках електроліти майже не дисоціюють. Проте правило Нернста має винятки.
Кількісною характеристикою повноти перебігу електролітичної дисоціації є ступінь дисоціації α— відношення числа частинок електроліту, що розпалися на іони, до загального числа його частинок у розчині:
Ступінь дисоціації залежить від природи електроліту та розчинника, від концентрації електроліту й температури розчину. Залежно від значення α електроліти умовно поділяють на сильні, слабкіта середні.До сильних електролітівналежать майже всі солі, гідроксиди лужних і лужноземельних металів, багато кислот (НС1, НNОз, НСlO4, Н2SО4 тощо), до слабких— більшість основ, амфотерні гідроксиди, деякі кислоти (Н2S, Н3ВО3, Н2СО3, НСN, Н2SiO3, НNO2). Поділ електролітів на сильні та слабкі є умовним, оскільки сила електроліту значно залежить від природи розчинника, його діелектричної проникності. Насправді електролітом є не сама розчинена речовина, а речовина разом з розчинником (електролітичний розчин).Наприклад, водний розчин хлороводню є сильним електролітом, але бензольний розчин хлороводню практично не проводить електричний струм.
Ступінь дисоціації визначають експериментально за значенням ізотонічного коефіцієнта або вимірюванням електропровідності розчинів різних концентрацій.
14.
Ступінь дисоціації , сильні та слабкі електроліти.
Сильні та слабкі електроліти
Усі електроліти поділяють на сильні та слабкі. Сильні електроліти в розчинах дисоціюють повністю, а слабкі — частково, тобто частина молекул залишається в недисоційованому стані. До сильних електролітів відносять усі солі (за незначним винятком), луги (гідроксиди лужних металів, а також Барію, Стронцію й Кальцію) та деякі кислоти (НСl, НВr, НІ, HNO3, H2SO4(розб)). Інші електроліти відносять до слабких.
Силу електролітів можна пояснити ступенем іонності зв’язку, що підлягає розриву при дисоціації. Оскільки в солях між іонами металів та кислотних залишків зв’язок іонний, то майже всі солі належать до сильних електролітів. Аналогічний підхід справедливий також і для кислот та основ. Але якщо в основ полярність зв’язку між атомом металу й гідроксильною групою визначається тільки електронегативністю атома металу, то для кислот полярність зв’язку між атомами Оксигену та Гідрогену залежить від якісного й кількісного складу кислотного залишку.
У кислот, до складу яких атоми Оксигену не входять НЕ, сила кислот залежить від розміру атома Е. Чим більший радіус атома, тим більша довжина зв’язку Н-Е, а отже, тим простіше його розірвати й тим більшою є сила кислоти. Таким чином, у ряді галогеноводневих кислот зі збільшенням порядкового номера галогену сила кислоти збільшується: плавикова кислота є слабкою, а йодоводнева кислота — сильною, тобто сила кислот змінюється в ряді:
HF < НСl < НВr < НІ.
Силу оксигеновмісних кислот можна визначити за формулою Е(ОН)mОn. Якщо n < 2 — кислота слабка, якщо n більше або дорівнює 2 — сильна.
Взаємозв’язок сили кислоти із числом атомів Оксигену, які не входять до складу гідроксильних груп, можна пояснити в такий, спосіб. Атом Оксигену, як найбільш електронегативний, притягує до себе спільні електронні пари. У результаті електронна густина від атома Оксигену в групі ОН зміщується в бік кислото-твірного елемента й зв’язок між атомами Оксигену та Гідрогену в гідроксильній групі стає більш полярним.
Чим більше число атомів Оксигену, які не входять до групи ОН, тим полярніший зв’язок і сильніша кислота.
Ступінь дисоціації
Для кількісного опису сили електролітів використовують поняття «ступінь дисоціації».
Ступенем дисоціації а називають відношення числа молекул, що розпалися на іони (продисоційованих), до загального числа розчинених молекул.
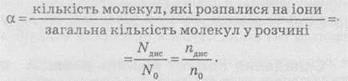
Різні електроліти дисоціюють на іони різною мірою. Як випливає з наведеного рівняння, ступінь дисоціації може змінюватися від 0 до 1. Ступінь дисоціації часто виражають у відсотках. Слід зазначити, що при дисоціації відбувається збільшення числа частинок у розчині. Наприклад, якщо в розчині перебуває електроліт типу Kat+An”, який повністю розпадається на іони, то число частинок збільшується у два рази.
Ступінь дисоціації також є характеристикою, за якою можна визначити, є електроліт сильним чи слабким. Так, якщо ступінь дисоціації електроліту в 0,1 М розчині більший 30 %, то його відносять до сильних електролітів, а якщо менший 3% — до слабких. Електроліти, в яких ступінь дисоціації має проміжні значення, відносять до електролітів середньої сили.
Ступені дисоціації слабкого електроліту, визначені різними способами (наприклад, за виміром електропровідності або температурою кипіння розчину), найчастіше збігаються. Однак для сильних електролітів визначення ступеня дисоціації різними способами дає різні результати. Отже, величина ступеня дисоціації не характеризує реальну (справжню) ступінь дисоціації, а представляє уявну величину.
Цей, а також низка інших фактів призвели до перегляду теорії Арреніуса у 20-х роках минулого сторіччя й до уточнення, внаслідок чого з’явилася нова теорія електролітів, яка враховує електростатичну взаємодію між іонами. Найбільший внесок у розвиток нової теорії зробив голландський учений П. Дебай.
Згідно із цією теорією, передбачається, що сильні електроліти в розведених розчинах дисоціюються повністю (α = 1). Відмінність виміряного ступеня дисоціації сильних електролітів від одиниці пояснюється електростатичними взаємодіями між різнойменно зарядженими іонами, тобто, якщо для якого-небудь сильного електроліту виміряний ступінь дисоціації α = 70%, то, згідно із новою теорією електролітів, це означає, що всі молекули дисоційовані на іони, але іони вільні лише на 70%, решта 30% іонів «зв’язані» електростатичними взаємодіями.
15.
Реакції іонного обміну, умови реакції. Іонні рівняння.
Іонні рівняння реакцій
Оскільки електроліти в розчинах утворюють іони, то для відображення змісту реакцій часто використовують так звані іонні рівняння, тому що в розчинах відбуваються реакції не між молекулами, а між іонами. Реакції, чиїм змістом є обмін іонами між реагентами, називають реакціями іонного обміну. У цьому розділі будуть розглядатися тільки реакції обміну в розчинах, що відбуваються без зміни ступеня окиснення елементів.
Складання іонних рівнянь реакцій
При складанні іонних рівнянь реакцій слід дотримуватися такого алгоритму:
1. Скласти молекулярне рівняння реакції (усі речовини — реагенти й продукти — записують у вигляді молекул) і розставити в ньому коефіцієнти:

2. Скласти повне іонне рівняння реакції. Для цього замість запису молекул усіх речовин, які є сильними електролітами, слід записати іони, у вигляді яких вони існують у розчинах, з урахуванням розставлених коефіцієнтів. Так, у даному разі сильними електролітами є всі речовини, окрім води. Тому замість молекули сульфатної кислоти записуємо іони, на які вона дисоціює в розчині, тобто Н+ і SO42-, замість калій гідроксиду — К+ та ОН-, замість калій сульфату — К+ і SO42-. Вода є дуже слабким електролітом, тому її записують у молекулярній формі. Одержуємо:
де Сm — моляльність розчину; Е і К— ебуліоскопічната кріоскопічна сталі,які залежать лише від властивостей розчинника — його температури кипіння (замерзання) Тк(3), молярної маси М і теплоти випаровування (плавлення) ΔНвип(пл), але не залежать від властивостей розчиненої речовини. Наприклад, для води ебуліоскопічна стала
Аналогічно визначають і кріоскопічну сталу.
Ебуліоскопічна та кріоскопічна сталі вказують на підвищення температури кипіння або зниження температури замерзання розчину з концентрацією Ст= 1 моль/кг. Оскільки для таких концентрованих розчинів рівняння не придатні, то сталі Е і К є екстраполяційними, тобто їх визначають експериментально для розведених розчинів із перерахунком на один моль розчиненої речовини.
На зміні температур кипіння та замерзання розчинів базуються ебуліоскопічнийі кріоскопічний методи визначення молекулярних масречовин
де т1і т2 — маси розчиненої речовини та розчинника; М— молярна маса розчиненої речовини. Пунктиром показані залежності тисків компонентів від складу для ідеальних розчинів.
КОНЦЕНТРАЦІЯ РОЗЧИНІВ—це величина, яку вимірюють масою або об’ємом розчиненої речовини, що міститься у певній масі або об’ємі розчину або розчинника. Найчастіше використовують такі способи вираження концентрації: масова частка, молярна, моляльна концентрація, молярна концентрація еквівалента, молярна частка, об’ємна частка та титр. Масову частку речовини Х w(Х) розраховують за формулою:
де m(X) — маса розчиненої речовини Х (в кг, г); m – маса розчину (в кг, г). Її виражають у частках одиниці або в %. В останньому випадку розрахунок здійснюють за формулою:
13.
Теорія електролітичної дисоціації, основні положення.
ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
Властивості електролітів узагальнені основоположником теорії електролітичної дисоціації Арреніусом (1887) і розвинуті у працях Кістяківського та Каблукова на основі хімічної теорії розчинів Менделєєва.
В основу теорії електролітичної дисоціаціїпокладено такі положення:
розчинення електроліту супроводжується розпадом його молекул на іони;
електролітична дисоціація є оборотним процесом;
електропровідність розчинів електролітів пропорційна загальній концентрації іонів у розчині.
Арреніус вважав, що молекули електролітів розпадаються на іони не під дією електричного струму, а в процесі розчинення, хоч його теорія не враховувала всієї складності явищ у розчинах. Зокрема, іони вважалися вільними частинками, що не залежали від молекул розчинника. Згідно зі сучасним поглядом, розпад полярних молекул (іонізація)або іонних кристалів(дисоціація)розчиненої речовини на іони відбувається під впливом полярних молекул розчинника, внаслідок чого утворюються хімічні сполуки — сольвати, а коли розчинником є вода — гідрати. Процес гідратації (сольватації) екзотермічний і відбувається спонтанно зі зменшенням ентальпії. Одночасно з дисоціацією відбувається й зворотний процес — асоціація.
Великі за розміром гідратні (сольватні) оболонки іонів заважають останнім при їх зіткненні у розведених розчинах знову утворювати молекули (кристали) вихідних речовин. Взаємодія між
протилежно зарядженими іонами у розчині послаблюється також під впливом розчинників. Мірою такого впливу єдіелектрична проникністьрозчинника. Чимбільше значення діелектричної проникності середовища, тим краще дисоціює електроліт (правило Нернста, 1894):
де F—сила взаємодії між іонами; zК і zа — заряди катіона та аніона; e — заряд електрона; NA — число Авогадро; έ — діелектрична проникність середовища; r- віддаль між центрами іонів.
Енергія електростатичної взаємодії у воді у 81 раз менша, ніж у вакуумі, тому у воді електроліти дисоціюють значно ліпше, ніж у розчинниках з малими значеннями є. У бензолі та інших подібних розчинниках електроліти майже не дисоціюють. Проте правило Нернста має винятки.
Кількісною характеристикою повноти перебігу електролітичної дисоціації є ступінь дисоціації α— відношення числа частинок електроліту, що розпалися на іони, до загального числа його частинок у розчині:
Ступінь дисоціації залежить від природи електроліту та розчинника, від концентрації електроліту й температури розчину. Залежно від значення α електроліти умовно поділяють на сильні, слабкіта середні.До сильних електролітівналежать майже всі солі, гідроксиди лужних і лужноземельних металів, багато кислот (НС1, НNОз, НСlO4, Н2SО4 тощо), до слабких— більшість основ, амфотерні гідроксиди, деякі кислоти (Н2S, Н3ВО3, Н2СО3, НСN, Н2SiO3, НNO2). Поділ електролітів на сильні та слабкі є умовним, оскільки сила електроліту значно залежить від природи розчинника, його діелектричної проникності. Насправді електролітом є не сама розчинена речовина, а речовина разом з розчинником (електролітичний розчин).Наприклад, водний розчин хлороводню є сильним електролітом, але бензольний розчин хлороводню практично не проводить електричний струм.
Ступінь дисоціації визначають експериментально за значенням ізотонічного коефіцієнта або вимірюванням електропровідності розчинів різних концентрацій.
14.
Ступінь дисоціації , сильні та слабкі електроліти.
Сильні та слабкі електроліти
Усі електроліти поділяють на сильні та слабкі. Сильні електроліти в розчинах дисоціюють повністю, а слабкі — частково, тобто частина молекул залишається в недисоційованому стані. До сильних електролітів відносять усі солі (за незначним винятком), луги (гідроксиди лужних металів, а також Барію, Стронцію й Кальцію) та деякі кислоти (НСl, НВr, НІ, HNO3, H2SO4(розб)). Інші електроліти відносять до слабких.
Силу електролітів можна пояснити ступенем іонності зв’язку, що підлягає розриву при дисоціації. Оскільки в солях між іонами металів та кислотних залишків зв’язок іонний, то майже всі солі належать до сильних електролітів. Аналогічний підхід справедливий також і для кислот та основ. Але якщо в основ полярність зв’язку між атомом металу й гідроксильною групою визначається тільки електронегативністю атома металу, то для кислот полярність зв’язку між атомами Оксигену та Гідрогену залежить від якісного й кількісного складу кислотного залишку.
У кислот, до складу яких атоми Оксигену не входять НЕ, сила кислот залежить від розміру атома Е. Чим більший радіус атома, тим більша довжина зв’язку Н-Е, а отже, тим простіше його розірвати й тим більшою є сила кислоти. Таким чином, у ряді галогеноводневих кислот зі збільшенням порядкового номера галогену сила кислоти збільшується: плавикова кислота є слабкою, а йодоводнева кислота — сильною, тобто сила кислот змінюється в ряді:
HF < НСl < НВr < НІ.
Силу оксигеновмісних кислот можна визначити за формулою Е(ОН)mОn. Якщо n < 2 — кислота слабка, якщо n більше або дорівнює 2 — сильна.
Взаємозв’язок сили кислоти із числом атомів Оксигену, які не входять до складу гідроксильних груп, можна пояснити в такий, спосіб. Атом Оксигену, як найбільш електронегативний, притягує до себе спільні електронні пари. У результаті електронна густина від атома Оксигену в групі ОН зміщується в бік кислото-твірного елемента й зв’язок між атомами Оксигену та Гідрогену в гідроксильній групі стає більш полярним.
Чим більше число атомів Оксигену, які не входять до групи ОН, тим полярніший зв’язок і сильніша кислота.
Ступінь дисоціації
Для кількісного опису сили електролітів використовують поняття «ступінь дисоціації».
Ступенем дисоціації а називають відношення числа молекул, що розпалися на іони (продисоційованих), до загального числа розчинених молекул.
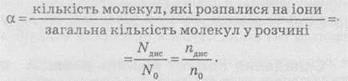
Різні електроліти дисоціюють на іони різною мірою. Як випливає з наведеного рівняння, ступінь дисоціації може змінюватися від 0 до 1. Ступінь дисоціації часто виражають у відсотках. Слід зазначити, що при дисоціації відбувається збільшення числа частинок у розчині. Наприклад, якщо в розчині перебуває електроліт типу Kat+An”, який повністю розпадається на іони, то число частинок збільшується у два рази.
Ступінь дисоціації також є характеристикою, за якою можна визначити, є електроліт сильним чи слабким. Так, якщо ступінь дисоціації електроліту в 0,1 М розчині більший 30 %, то його відносять до сильних електролітів, а якщо менший 3% — до слабких. Електроліти, в яких ступінь дисоціації має проміжні значення, відносять до електролітів середньої сили.
Ступені дисоціації слабкого електроліту, визначені різними способами (наприклад, за виміром електропровідності або температурою кипіння розчину), найчастіше збігаються. Однак для сильних електролітів визначення ступеня дисоціації різними способами дає різні результати. Отже, величина ступеня дисоціації не характеризує реальну (справжню) ступінь дисоціації, а представляє уявну величину.
Цей, а також низка інших фактів призвели до перегляду теорії Арреніуса у 20-х роках минулого сторіччя й до уточнення, внаслідок чого з’явилася нова теорія електролітів, яка враховує електростатичну взаємодію між іонами. Найбільший внесок у розвиток нової теорії зробив голландський учений П. Дебай.
Згідно із цією теорією, передбачається, що сильні електроліти в розведених розчинах дисоціюються повністю (α = 1). Відмінність виміряного ступеня дисоціації сильних електролітів від одиниці пояснюється електростатичними взаємодіями між різнойменно зарядженими іонами, тобто, якщо для якого-небудь сильного електроліту виміряний ступінь дисоціації α = 70%, то, згідно із новою теорією електролітів, це означає, що всі молекули дисоційовані на іони, але іони вільні лише на 70%, решта 30% іонів «зв’язані» електростатичними взаємодіями.
15.
Реакції іонного обміну, умови реакції. Іонні рівняння.
Іонні рівняння реакцій
Оскільки електроліти в розчинах утворюють іони, то для відображення змісту реакцій часто використовують так звані іонні рівняння, тому що в розчинах відбуваються реакції не між молекулами, а між іонами. Реакції, чиїм змістом є обмін іонами між реагентами, називають реакціями іонного обміну. У цьому розділі будуть розглядатися тільки реакції обміну в розчинах, що відбуваються без зміни ступеня окиснення елементів.
Складання іонних рівнянь реакцій
При складанні іонних рівнянь реакцій слід дотримуватися такого алгоритму:
1. Скласти молекулярне рівняння реакції (усі речовини — реагенти й продукти — записують у вигляді молекул) і розставити в ньому коефіцієнти:
2. Скласти повне іонне рівняння реакції. Для цього замість запису молекул усіх речовин, які є сильними електролітами, слід записати іони, у вигляді яких вони існують у розчинах, з урахуванням розставлених коефіцієнтів. Так, у даному разі сильними електролітами є всі речовини, окрім води. Тому замість молекули сульфатної кислоти записуємо іони, на які вона дисоціює в розчині, тобто Н+ і SO42-, замість калій гідроксиду — К+ та ОН-, замість калій сульфату — К+ і SO42-. Вода є дуже слабким електролітом, тому її записують у молекулярній формі. Одержуємо:


