ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.05.2024
Просмотров: 58
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
3. Скласти скорочене іонне рівняння реакції (іноді його називають іонно-молекулярним рівнянням реакції). Для цього в повному іонному рівнянні необхідно скоротити в лівій і правій частинах рівняння однакові іони. У нашому випадку однаковими є іони SO42- та К+. Одержуємо:
У разі потреби можна ще скоротити кратні коефіцієнти в рівнянні:
Умови протікання реакцій обміну в розчинах
Протилежно заряджені іони в розчинах притягуються й можуть утворювати продукти реакції. Згідно із теорією дисоціації, можливі два варіанти протікання реакцій обміну в розчинах:
а) утворювані речовини — сильні електроліти, добре розчинні у воді й повністю дисоціюються на іони;
б) одна (або кілька) з утворюваних речовин — газ, осад (речовина, яка погано розчиняється у воді) або слабкий електроліт (добре розчинний у воді).
Розгляньмо перший випадок — взаємодію натрій хлориду та калій сульфату — і запишімо молекулярне та іонне рівняння із цими речовинами:
І натрій сульфат, і калій хлорид є добре розчинними сполуками й сильними електролітами, тому в цьому разі при складанні скороченого іонного рівняння всі іони скорочуються. Це свідчить про те, що при змішуванні розчинів натрій хлориду та калій сульфату реакція не відбувається, а утворюється суміш іонів Na+, К+, Сl- і SO42-.
Другий випадок розгляньмо на прикладі двох реакцій:
У іонній формі рівняння (1) та (2) матимуть такий вигляд:
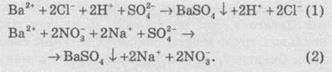
Барій сульфат є практично нерозчинним і вилучається зі сфери реакції, тому його записують у молекулярній формі. Однакові іони в обох частинах рівнянь скорочуються, й обидва рівняння перетворюються на однакові скорочені іонні рівняння:
Очевидно, що при взаємодії інших сульфатів з будь-якою розчинною сіллю Барію реакція буде описуватися таким самим скороченим іонним рівнянням. Отже, іонне рівняння, на відміну від молекулярного, належить не до однієї якої-небудь реакції між конкретними речовинами, а до цілої групи аналогічних реакцій.
Таким чином, якщо в результаті реакції одна з речовин вилучається зі сфери реакції, то реакція обміну відбувається повністю. Це можливо, якщо одним із продуктів реакції є: 1) слабко-розчинний газ, який виділяється з розчину; 2) слабко-розчинна речовина, що випадає в осад; 3) слабко-дисоційована речовина (слабкий електроліт) — слабкі кислоти, вода. У іншому разі реакція не відбувається, а утворюється суміш іонів.
16.
Дисоціація води. Водневий показник (рН середовища)
Дисоціація води.pH
Водa і як слабкий електроліт незначною мірою дисоціює на іони Н+ і ОН-, що перебувають у рівновазі з недисоційованими молекулами:
Н2O ⇆ Н+ + ОН-.
Концентрацію іонів звичайно виражають у молях іонів в 1 л. Як видно з рівняння дисоціації води, в ній величини [Н+] і [ОН-] однакові. Експериментально встановлено, що в одному літрі води за кімнатної температури (22 °С) дисоціації піддається лише 10-7 моль води і при цьому утворюється 10 моль/л іонів Н+ і 10-7 моль/л іонів ОН- .
Добуток концентрації іонів гідрогену і гідроксид-іонів у воді називається іонним добутком води (позначається Kв). За певної температури Кв — величина стала, чисельно дорівнює при 22 °С 10-14 :
Kв = [Н+] [ОН-] = 10-7 • 10-7 = 10-14. (5.4)
Сталість добутку [Н+] [ОН-] означає, що в будь-якому водному розчині ні концентрація іонів гідрогену, ні концентрація гідроксид-іонів не може дорівнювати нулю. Іншими словами, бyдь-який водний розчин кислоти, основи або солі містить як Н+, так і ОН- -іони. Дійсно, для чистої води [Н+] = [OН-
] = 10-7 моль/л. Якщо до води додати кислоту, то [Н+] стане більшою ніж 10-7, а [ОН- ] — меншою ніж 10-7 моль/л. Навпаки, якщо до води додати луги, то [Н+] стає меншою ніж 10-7 , а [ОН-] — більшою ніж 10-7 моль/л.
Зі сталості добутку [Н+] [ОН-] випливає, що при збільшенні концентрації одного з іонів води відповідно зменшується концентрація іншого іона. Це дає змогу обчислити концентрацію Н+ -іонів, якщо відома концентрація ОН- -іонів, і навпаки. Наприклад, якщо у водному розчині [Н+] = 10-3 моль/л, то [ОН-] визначатиметься так:
[ОН-] = Kв/[Н+] = 10-14/10-3 = 10-11 моль/л.
Отже, кислотність і основність розчину можна виражати через концентрацію або іонів Н+, або іонів ОН-. На практиці користуються першим способом. Тоді для нейтрального розчину [Н+] = 10—7 моль/л, для кислого [Н+] > 10 -7, для лужного [Н+] < 10-7 моль/л.
Щоб уникнути незручностей, пов’язаних із застосуванням чисел з від’ємними показниками ступеня, концентрацію іонів гідрогену прийнято виражати через водневий показник, що позначається символомpH (читається “пе-аш”).
Водневим показником pH називається десятковий логарифм концентрації водневих іонів, взятий з протилежним знаком:
pH = -lg[Н+] (5.5)
або
[Н+] = 10-рН, (5.6)
де [Н+] — концентрація іонів гідрогену, моль/л.
Поняття “водневий показник” введене датським хіміком С. Серенсеном у 1909 p.: літера “р” — початкова літера датського слова potenz — математичний ступінь, буква “Н” — символ гідрогену.
За допомогою
pH реакція розчинів характеризується так: нейтральна — pH =7, кисла — pH < 7, лужна — pH > 7.
Наведемо значення pH деяких найвідоміших розчинів і зазначимо відповідну їм реакцію середовища: шлунковий сік — pH = 1,7 (сильнокисла реакція), торф’яна вода — pH = 4 (слабкокисла), дощова вода — pH = 6 (слабкокисла), вода з водопроводу — pH = 7,5 (слабколужна), кров — pH = 7,4 (слабколужна), слина — pH = 6,9 (слабкокисла), сльози — pH = 7 (нейтральна).
Винятково значна роль pH в найрізноманітніших явищах і процесах — і в природі, і в техніці. Багато виробничих процесів у хімічній, харчовій, текстильній та інших галузях промисловості відбуваються лише за певної реакції середовища. Так само необхідна для нормального розвитку сільськогосподарських культур і одержання високих урожаїв і певна реакція ґрунтового розчину. Залежно від значення pH ґрунтового розчину ґрунти поділяються на сильнокислі (pH = 3...4), кислі (pH= 4...5), слабкокислі (pH = 5...6), нейтральні (pH = 6...7), слабколужні (pH = 7...8), лужні (pH = 8...9) і, нарешті, сильнолужні (pH = 9... 11).
Найчастіше рослини страждають від підвищеної кислотності, для усунення якої застосовують вапнування ґрунтів — внесення в них вапняків — карбонатів кальцію або магнію. Якщо ж ґрунти відрізняються підвищеною лужністю (солонцюваті і солончакові ґрунти), то для її усунення застосовують гіпсування — внесення розмеленого гіпсу CaSO4 • 2Н2О.
Необхідність вапнування або гіпсування ґрунтів встановлюють із урахуванням водневого показника розчину (сольової витяжки); залежно від величини pH визначають за таблицями і дози речовин, які вносять.
17.
Гідроліз солей.
Означення. Досвід показує, що розчини середніх солей мають лужну, кислу або нейтральну реакцію, хоча вони і не містять ні водневих, ні гідроксильних іонів. Пояснення цьому факту слід шукати у взаємодії солей з водою.
Взаємодія іонів солі з водою, що приводить до утворення слабкого електроліту, називається гідролізом солі.
1. Усі солі, утворені слабкою кислотою і сильною основою, піддаються гідролізу. Вони надають розчину лужної реакції (pH > 7).
2. Солі, утворені сильною кислотою і слабкою основою, також піддаються гідролізу. Вони надають розчину кислої реакції, як це має місце в розчині хлориду амонію NH4Cl. В цьому разі утворюється слабкий електроліт NH4OH. У результаті частина іонів ОН- зв’язується іонами NH+4 , а іони Н+залишаються в надлишку. Отже, внаслідок гідролізу NH4Cl розчин цієї солі набуває кислої реакції (pH > 7). Рівняння гідролізу можна записати так:
NH+4 + Н2О ⇆ NH4OH + Н+,
або точніше
NH+ + Н2O ⇆ NH3 ⇆ Н2O + Н+.
3. Ще легше піддаються гідролізу солі, утворені слабкою кислотою і слабкою основою. Наприклад:CH3COONH4.
Іони цієї солі одночасно зв’язують іони Н+ і OН-, зміщуючи рівновагу дисоціації води:
СН3СОО- + NH+4 + Н2O ⇆ СН3СООН + NH4OH (NH3 • Н2О).
У цьому разі реакція розчину залежить від ступеня дисоціації продуктів гідролізу — кислоти й основи; якщо переважають іони ОН- , вона лужна, а якщо іони Н+ — кисла, якщо ж їх число однакове — нейтральна. Оскільки у прикладі, що розглядається, ступені дисоціації СН3СООН і NH4OH, які утворюються внаслідок гідролізу, приблизно однакові, то розчин солі буде нейтральним.
Однак реакція водного розчину карбонату амонію (NН4)2СО3 — також солі слабкої кислоти і слабкої основи — слабколужна:
NH+4 + СО2-3 + Н2O ⇆ NH4OH + НСО-3,
оскільки ступінь дисоціації NH4OH більший, ніж ступінь дисоціації іона НСО3 .
4. Солі, утворені сильною основою і сильною кислотою, гідролізу не піддаються. Іони таких солей не можуть утворювати з водою слабких електролітів. У цьому випадку солі практично в реакції участі не беруть, і рівновага дисоціації води не порушується, концентрація Н+- і ОН- -іонів залишається такою самою, як і в чистої води, а значить, розчин матиме нейтральну реакцію (pH = 7).
Складання рівнянь гідролізу солей.
Гідроліз солей, утворених слабкими багатоосновними кислотами і сильними основами, відбувається ступінчасто (відповідно зворотному процесу — ступінчастій дисоціації), і при цьому утворюються кислі солі (точніше, аніони кислих солей).
Аналогічно під час гідролізу солей, утворених багатокислотними слабкими основами і сильними кислотами, утворюються основні солі (точніше, катіони основних солей). Гідроліз відбувається в

