Файл: 4 апта 40сра QU формуласы сйкес келеді изохоралык процесті жылулы эффектісі Формуласы арылы анытауа болады dSnr in V2V1 nr in P1P2.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.10.2024
Просмотров: 66
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
+изотермиялык
123.Адиобаталық процесс
+жылу алмайтын жылу бермитын
124.Интенсивті шамаларға жатады:
+тығыздық,концентрация,температура
3 апта 34 сұрақ
122. SI энергия бірлігі-джоуль. Дегенмен, жүйеден тыс қондырғы-калория әлі де қолданылады. Джоуль мен калория қалай байланысты?
+1кал=4,18
123. H0r,298=H0f,298 өнім -H0f,298, баст.зат
+ Гесстің бірінші салдары
124.Гесс заңының орындалу шарттары:
+ А=-∆U, p= const немесе V= const
125.Майер теңдеуіндегі Cp мәні ?
+20,785
126. Изохоралық термодинамикалық процесске тән:
+ Qv =
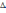
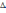 U
U127. Температураны өзгерткендегі реакцияның жылу эффектісінің өзгерісі жылу сыйымдылыққа тең болады:
+Кирхгофф заны
128. Реакцияның жылу эффектісі реакцияға түскен заттардың және реакция түскен заттардың және реакция өнімдерінің жану жылулар қосындыларының айырымына тең
+Гесс заңының екінші салдары
129.Гесс заңы орындалады:
+Жүйеде тек көлем ұлғаю жұмысы жасалғанда
130.G>0, болса
+процесс өздігінен оң бағытта жүрмейді
131.Қандай тұжырым Гесс заңына сәйкес келеді:
+ реакцияның жылу эффектісі технологиялық жолға байланысты емес
131. Q<0 , H>0 шарты орындалаты процесс:
+эндотермиялық процесс
132.Күй теңдеуі үшін үш негізгі параметрдің (PVT) нешеуі тәуелсіз болады:
+Бір
133. p*V көбейтіндісімен өлшенетін шаманың өлшем бірлігін көрсетіңіз
+ Джоуль
134. Джоульмен өлшенетін физикалық шамаларды таңдаңыз:
+ жылу мөлшері
135. Термохимия бұл..... ғылым
+химиялық реакциялардың жылу эффектілері мен механизмі туралы
136. Меншікті жылу сыйымдылығына анықтама беріңіз .
+ бұл зат массасының бірлігін бір градусқа қыздыру үшін қажет жылу мөлшері
137. Химиялық реакцияның жылу эффектісі:
+ температураның жоғарылауымен өседі, егер реакцияның жылусыйымдылығының өзгерісі оң болса
140. U , Q және A арасындағы сандық байланыс орнатады термодинамика заңы:
+Бірінші
141.Реакцияға қатысушылардың түзілу (немесе жану) жылуы және жылу сыйымдылығы арқылы:
+ Т=298 К кезіндегі химиялық реакцияның тепе-теңдік константасы.
142.Термодинамиканың үшінші заңына бағынады :
+қатты денелер
143.Стандартты жағдайда 1 моль күрделі зат жай заттарға ыдырағанда бөлінетін немесе сіңірілетін жылу мөлшері.
+Стандартты түзілу энтальпиясы.
144.Реакцияның жылу эффектісі жүру жолына тәуелді емес , бастапқы және өнім заттарының күйіне және табиғатына тәуелді:
+ Гесс заңы
145.Органикалық заттардың жылу сыйымдылығы
+Ср=а+вТ+сТ^2
146. Изобарлық-изотермиялық жағдайда химиялық реакция нәтижесінде бөлінетін немесе сіңірілетін жылу мөлшері
+ Реакцияның энтальпиясы
147.Молярлық жылусыйымдылық анықтау формуласы:
+
148.Химиялық реакциялардың жылуы анықталады:
+ Заттардың түзілуі мен жануының стандартты жылу негізінде
149. Q=U формуласы:
+изохоралык процестің жылулық эффектісі
150.Идеал газдар үшін Cp мен Cv арасындағы айырмашылық қандай:
+8,314 Дж/моль⋅К
151.Химиялық реакцияның жылу эффектісі анықтау үшін қолданылыды:
+Кирхгоф теңдеуі
152. Универсальная газовая постоянная R=8.314 если
+ P= Па, V= м^3
Бір фазалы жүйелердің еркіндік дәрежесі: 2
Эбулиоскопиялық тұрақты Е: еріткіштің табиғатына тәуелді
0>
Ерітіндінің иондық күші мына формуламен анықталады: I = ½ Σ Ci Zi2
Изотоникалық ерітінділер дегеніміз бірдей ерітінділер осмостық қысым
Ерітіндінің осмостық қысымы есептеледі: π= CRT;
Плазмадағы рН мәні қалыпты жағдайда: 7,4
Плазмолиз- бұл: Осмостық қысымы жоғары ерітіндіге эритроцитті салғанда байқалатын құбылыс
Таза еріткішпен салыстырғанда ерітіндіде: қату температурасы төмендейді
Ерітіндінің қату температурасы байланысты: еріген заттың концентрациясы туралы
Қандай ерітінді қанға изотонды: 0,9%-й (NaCl)
Гетерогенді жүйе: екі немесе одан да көп фазадан тұрады
Осмостық қысым қай ерітіндіде көбірек болады? С(NaCl) = 0,1 моль/л
Вена ішіне жіберілетін препарат ретінде қолданылатын дәрілік зат ерітіндісі қан плазмасымен салыстырғанда болу керек: Изотонды
Теңіз суында жүзу кезінде көздің аздап ауыруы және қызаруы келесі себептерден туындайды: көз алмасынан су осмосы
Ерітіндінің қайнау температурасын қалай анықтауға болады: қату нүктесі өлшеу арқылы
Молярлық концентрациясы 0,01 моль/л натрий гидроксиді ерітіндісі үшін рН мәні: 12
Дәрілік заттардың изотониялық концентрациясын есептеуге болады: Раульдің екінші заңы бойынша
Ерітіндінің қайнау температурасын өлшеуге негізделген талдау әдісі қалай аталады: эбулиометрия
Ерітінді буының ерітіндіге қатысты салыстырмалы қанықтылығы пропорционалды: заттың молярлық үлесі
Электролиттердің константа диссоциация константасы (тұрақтысы) қай заңға негізділіп анықталады? Оствальд
Тепе-теңдік күйіндегі жүйе: 2SO2(г)+O
2(г)=2SO3(г) гомогенді
Екі фазалы жүйелердің еркіндік дәрежесі: 1
Клапейрон-Клаузиус теңдеуі тепе-теңдік қысымның температураға тәуелділігін сипаттайды: бір компонентті бір фазалы жүйе
Келесі қасиеттер коллигативті қасиеттерге жатады: а) осмостық қысым; б) еріткіштің қаныққан буының ерітіндіге түсіретін қысымы; в) ерітінділердің қату және қайнау температурасы; г) ерітінділердің иондық күші; д) ерітінділердің буферлік сыйымдылығы; е) рН ерітінділері. а, б, в
Таза еріткішпен салыстырғанда ерітіндіде: қату температурасы төмендейді
Таза еріткішпен салыстырғанда ерітіндіге қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың молярлық үлесіне тең - Раульдың бірінші заңы
Криоскопическая константа К: еріткіштің табиғатына тәуелді
Гомогенді жүйеде фазалар саны (ф): ф=1
Гетерогенді жүйеде фазалар саны (f): ф>1
Гомогенді термодинамикалық жүйе: әр түрлі нүктелерде бірдей қасиеттерге ие және бір фазадан тұрады
Гиббстің фазалық ережесі: К=С+2-Ф
Коллигативтік қасиеттерге жатады:
ерітінді бетіндегі еріткіштің қаныққан бу қысымының төмендеуі, ерітіндінің қайнау температурасының жоғарылауы, ерітіндінің қату температурасының төмендеуі
Ерітіндінің қайнау температурасы:
еріткіштің қату температурасынан жоғары
Егер рОН=3, онда: рН=11
Концентрациясы 0,1 моль/л хлорсутек қышқылы ерітіндісі үшін рН мәні: 1
Тамыр ішілік дәрі ретінде қолданылатын дәрілік заттың ерітіндісі қан плазмасына қатысты болуы керек:
Изотоникалық
Булануы бастапқы сұйық қоспамен бірдей құрамды бу шығаратын ерітінділер деп аталады
азеотропты
Қышқылдар мен негіздердің электронды теориясы (Г. Льюис):
қышқыл-негіз реакцияларында донор-акцептор өзара әрекеттесуі жүреді
Еріген заттың молярлық массасын криоскопиялық анықтау үшін қатынастар қолданылады: Тқату = Кm2
Егер рН 3-ке тең болса:
pOH=11
2CO+O2=2CO2 реакция үшін: тура реакцияның кинетикалық теңдеуінің түріW=kC2co*Co2
W=-dC/dtөрнегі білдіреді: бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын
Химиялық реакцияның жылдамдығы деп нені айтады: көлемнің бірлігінде және де уақыттың бірлігінде реакцияласатын молекулалар санын айтады
Химиялық реакцияның кинетикалық теңдеуінде әрекеттесуші заттардың концентрациясы көтерілетін дәрежелер қосындысы қалай аталады: реакция реті
Химиялық кинетиканың фармацияның мәні: әр дәрілік заттың жарамдылық мерзімін, сол дәріні сақтағанда жүретін реакция жылдамдығын анықтап береді
Реакцияның жылдамдық константасыың мәні 0.8 (моль/л)-1с-1. Реакцияның реттілігі қандай: шарттардан реакция реттілігін анықтауға болмайды
Химиялық реакцияның механизмі деп: химиялық реакция сатыларының жиынтығын айтады
Реакцияның молекулярлығы бола алады: тек қана 1, 2, 3
Химиялық реакцияның жылдамдығы: химиялық заттардың концентрациясына тура пропорционал
Химиялық кинетика теориясы бойынша активтік соқтығысу теориясы бойынша Аррениус теңдеуі: K=Ae-Ea/RT
Химиялық реакцияны бастаған кезде молекулалардың тиімді соқтығысуы үшін қажетті энергия қалай аталады: активтендіру
Активтендіру энергиясының жоғарылауымен реакция жылдамдығы: төмендейді
Реакция жылдамдығының тұрақтысы тәуелді болады: температураға
Қандай теңдеу 2NO+O2=2NO2 реакция жылдамдығын сипаттайды: W=k(NO)2(O2)
Егер ұсынылған стехиометриялық реакция теңдеуі 2CO+O2=2CO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады: 3
Екінші ретті реакция қандай теңдеулермен өрнектеледі: W=k*c2
Бастапқы зат концентрациясына нөлдік ретті реакцияның жылдамдығы қалай өзгереді: нөлдік ретті реакция тәуелсіз концентрация болып табылады
Бірінші ретті химиялық реакцияның өлшем константасы қандай: уақыт-1
Химиялық реакция жылдамдығының константасы деп нені айтады: жылдамдық константасы деп реакцияласушы заттардың концентрациялары бірге тең болған жағдайда гомогенді химиялық реакцияның жылдамдығын айтады
Реакция реттілігі нөл санын, бөлшек мәндерді, теріс мәндерді қабылдай ма: реакция реттілігі тек еркін мәндерді қабылдайды
aA+bB=cC+dD кері реакциясы үшін реттілік тең: c+d
Қандай теңдеу химиялық реакция жылдамдығының температураға дәл тәуелділігін анықтайды: Аррениус теңдеуі
Қандай реакция тримолекулярлы болып табылады: 2NO+O2=2NO2
Екінші ретті химиялық реакция өлшем тұрақты уақыты қандай:
