Файл: 4 апта 40сра QU формуласы сйкес келеді изохоралык процесті жылулы эффектісі Формуласы арылы анытауа болады dSnr in V2V1 nr in P1P2.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.10.2024
Просмотров: 65
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Д) жүйенің ішкі энергиясы көлемнің өсуімен өсуде.
74. Оқшауланған жүйеде жүретін процесс бағытының өлшемі ретінде термодинамикалық функциялардың қайсысын қолдануға болады:
А) U
Б) S
С) G
Д) H
75. Қайтымсыз процестер үшін 2 термодинамика заңы:
А)
Б) TΔS=0
С) ΔG=ΔH-TΔS
Д)
76. Фазалық ауысулар үшін энтропияның өзгеруі:
А)

Б)
С)
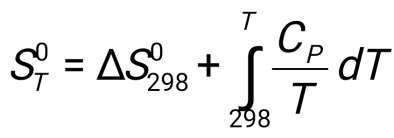
Д)

77. Әр түрлі температурада энтропияның өзгеруін есептеу:
А)

Б)
С)
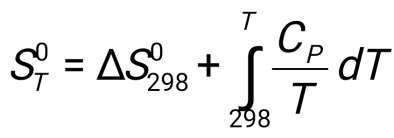
Д)

78. Термодинамиканың екінші басталу теңдеуі:
А) екінші типтегі мәңгілік қозғалтқышты құру мүмкін еместігі туралы постулаттың аналитикалық нысаны;
Б) химиялық тепе-теңдікті зерттеу нәтижелерін теориялық қорыту;
С) заттардың агрегаттық түрленуін талдаудан алынған теориялық;
Д) бұл идеалды шешімдер заңдарының теориялық жалпылауының нәтижесі.
79. «Абсолютті нөлдегі жеке кристалды заттың энтропиясы нөлге тең»
А) термодинамиканың нөлдік заңы
Б) термодинамиканың бірінші заңы
С) термодинамиканың екінші заңы
Д) термодинамиканың үшінші заңы
80. Қандай тұжырым Гесс заңына сәйкес келеді:
А) реакцияның жылу эффектісі күй функциясы болып табылады;
Б) реакцияның жылу эффектісі процестің өту жолына байланысты;
С) реакцияның жылу эффектісі технологиялық жолға байланысты емес
Д) барлық мәлімдемелер шындыққа сәйкес келеді
-
Газ заңдары дегеніміз не?
-
Параметрлерінің біреуінің мәні өзгермей қалған кездегі процестер -
Газдың бір параметрінің мәні тағайындалып қалған екі мәндер арасындағы сандық тәуелділік -
Газдың екі параметрлерінің мәні тұрақты болған кездегі процестер
2.Бір атомды идеал газдың ішкі энергиясын анықтайтын формула
-
ΔU=A+Q -
U=RT -
U=3m/2M RT
-
Адиабаталық процесс-
Параметрінің біреуінің мәні өзгермей қалған кезде өтетін процесс -
Жылу алмайтын, жылу бермейтін процесс -
Қысым тұрақты болған кезде термодинамика жүйе күйінің өзгеру процессі
-
-
Термодинамика ғылымы нені зерттейді?-
Жұмыс атқармай энергияның бір денеден екінші денеге берілу процессі -
Жылу құбылыстарына арналған энергияның сақталу заңы -
Денелердің молекулалық құрылымы ескерілмейтін жылулық процестер теориясы
-
-
Ішкі энергия дегеніміз не?-
Барлық молекулалардың кинетикалық энергиясымен осы бөлшектердің өзара әсерлесуін потенциялдық энергиясының қосындысына тең -
Жылу алмасу (жылу беру) кезінде дене алатын не жоғалтатын энергия -
Механикалық жұмыс жасау кезінде дененің энергия бөлуі
-
-
Менделеев-Клапейрон теңдеуі:-
P=nKT -

-
P1V1=P2V2
-
-
Егер сыртқы күштер идеал газбен, уақыттың кез келген мезетінде атқарылған жұмыс газдың қоршаған денелерге беретін ΔQ жылу мөлшерінде тең болатындай етіп, жұмыс істесе, онда бұл процесс ... аталады:-
Изобаралық -
Изохоралық -
Изотермиялық
-
-
Егер идеал газ қоршаған денелерге жылу мөлшерін бергенде уақыттың кез келген мезетінде берілген жылу мөлшері газдың ішкі энергиясының ΔU өзгеруіне тең болса, онда бұл процесс ... деп аталады:-
Изобаралық -
Изохоралық -
Изотермиялық
-
-
Идеал газдың жұмысы қай процессте нөлге тең?-
Изобаралық -
Изохоралық -
Изотермиялық
-
-
Термодинамиканың бірінші заңы-
Денелердің молекулалық құрылымы ескерілмейтін жылулық процестер теориясы -
Жылу құбылыстарына арналған энергияның сақталу заңы -
Ішкі энергияның механикалық түрге айналу процесін көрсететін заң
-
-
Уақыттың кез келген мезетінде берілген жылу мөлшері газдың атқарған жұмысына тең болатындай етіп, идеал газға жылу берілу қай процесте жүзеге асырылады?-
Изобаралық -
Изохоралық -
Изотермиялық
-
-
Изотермиялық процесс үшін термодинамиканың бірінші заңының математикалық өрнегін көрсетіңіз:-
Q=A -
Q=ΔU -
Q=ΔU+A
-
-
Газдың сығылу жұмысы оның ішкі энергиясының өзгерісіне тең . Бұл қандай процеске сәйкес келеді?-
Изобаралық -
Адиабаттық -
Изотермиялық
-
-
Қандай процесс кезінде ең көп жұмыс атқарылады?-
Изобаралық -
Изохоралық -
Изотермиялық
-
-
Изохоралық процесс үшін термодинамиканың бірінші заңының математикалық өрнегін көрсетіңіз:-
Q=A -
Q=ΔU -
Q=ΔU+A
-
-
Термодинамиканың бірінші заңының анықтамасы:-
Оқшауланған жүйелерде энергия қоры тұрақсыз -
Жылу ыстық денеден салқын денеге ауыса алады -
Энергия бір түрден екінші түрге эквиваленттік мөлшерде ауыса алады
-
-
Изобаралық процесс үшін термодинамиканың бірінші заңының математикалық өрнегін көрсетіңіз.-
Q=A -
Q=ΔU -
Q=ΔU+A
-
-
Адиабаталық процесс кезінде жүйеде жұмыс неге тең?-
A=Q -
A=-ΔU -
A=-ΔQ
-
-
Изотермиялық процесс кезінде жүйе энергиясы қалай анықталады?-
Q=A=PV/νRT -
Q=ΔU=m/MCvΔT -
Q=A=m/MRTlnV2/V1
-
-
127 0С температурадағымассасы 4г гелийдіңішкіэнергиясы неге тең? (М(Не)=4*10-3 кг/моль)-
4986Дж -
4986кДж -
498,6Дж
-
-
t= 270C температурадабіратомды идеал газдыңішкіэнергиясы U=15кДж. Осы газмолініңзат мөлшерінанықтаңыз:-
3моль -
4моль -
5моль
-
-
Массасы 4 кг гелийді 100 К-ге изохоралы қыздыру үшін қажетті жылу мөлшерін және газдың жұмысын анықтаңыз?-
1246.5кДж; 0 -
1246.5Дж; 2493Дж -
0; 2493кДж
-
-
Газдың 800 молін 500 К-геизобаралыққыздырған. Газдыңжұмысынанықтаңыз? (R=8,31 Дж/моль )-
831*104Дж -
831*106Дж -
831 Дж
-
-
Тұрақты қысымдағы жүйе жылуларының өзгерісі қалай аталады?-
Жұмыс -
Энтальпия -
Адиабата
-
-
Интенсивті шамаларға жатады:-
Тұтқырлық, масса, ішкі энергия -
Қысым, көлем, жылусыйымдылық -
Тығыздық, концентрация, температура
-
-
Экстенсивті шамаларды көрсетіңіз:-
Тұтқырлық, масса, ішкі энергия -
Көлем, жылусыйымдылық, термодинамикалық потенциал -
Тығыздық, концентрация, температура
-
-
Жанасу беттері жоқ, қасиеттері бірдей, бір текті жүйе қалай аталады?-
Гетерогенді -
Гомегенді -
Ашық
-
-
Энтальпия неге тең?-
H=Q-A -
H=U+Pv -
H=Pv
-
-
Жүйе атқаратын жұмыс ұлғаю жұмысы?-
Оң -
Теріс -
Ноль
-
-
Кинетикалық энегрия-
Бөлшектердің ілгерлемелі, тербелмелі, айналмалы қозғалыстарының энергиясы -
Жүйенің толық энергиясы -
Энегияның сақталуы, бңр түрден екінші түрге айналуы
-
31. Қай процесс қайтымды термодинамикалық процесс деп аталады?
а) әрекеттесуші және қарама-қарсы күштер арасындағы шектеулі айырмашылықпен жүретін процесс
б) жүйе сырттан қосымша энергияны қажет етпей, бастапқы күйіне келе алатын процесс
в) минималды жұмыс орындалатын процесс
д) тура және кері бағыттағы жолдары сәйкес келмейтін процесс
е) бастапқы заттардың өздігінен түзілуі жүрмейтін процесс
32. Көбінесе фармацевтикалық технологияда температура мен қысым тұрақты жағдайды қолдайды. Бұл процестің атауы қалай?
а) изохоралық
б)изохора- изотермиялық
в)изобаралық
д) изобара –изотермиялық
е)изотермиялық.
33. Қысым және температура тұрақты жағдайда химиялық тепе-теңдік шарты қай теңдеуде көрсетілген:
а)dG=0
б)dH=0
в)dU=0
д)dS=0
е)dF=0
34. Кез-келген процесстің қарқындылық факторы ... аталады?
а) Термодинамикалық потенциал
б)Бос энергия
в) Байланысқан энергия
д) Химиялық потенциал
е) Ішкі энергия
35. Дәрілік зат синтезі оқшауланған жүйеде жүреді. Өздігінен жүретін процесс ағынының критерийі қандай?
а)Ішкі энергия
б)Гиббс энергиясы
в) Гельмгольц энергиясы
д)Энтальпия
е) Энтропия өзгерісі
36. Фугитивтілік (ұшқыштық) бұл-
а) Жоғары концентрациядағы идеал газдар үшін термодинамикалық қатынасты пайдаланып, реал газдардың қасиеттерін есептеу үшін қолданылатын термодинамикалық функция
б) Реакцияның қозғалыс күші болып табылатын химиялық күштер
в)Жоғары қысымдағы идеал газдар үшін термодинамикалық қатынасты пайдаланып, реал газдардың қасиеттерін есептеу үшін қолданылатын термодинамикалық функция
д) Химиялық реакцияның бөлінген немесе сіңірілген жылу мөлшерін көрсетеді
е) Ерітіндінің каныққан концентрациясы
37. Фугитивтілік қалай есептеледі?
а) f=ℽ*P
б) f=ℽ*С
в) f=ℽ*a
д) a=ℽ*P
е) f=a*C
38. Изобара-изотермиялық тепе- теңдікте тұрған процессті қалай өрнектеуге болады?
а) dH=TdS + PdV
б) dU=Q-А
в) dG=∆H-T∆S
д) dF=∆U-T∆S
е) dS= δQ/ T
39. Стандартты емес жағдайдағы химиялық потенциал анықталады:
а) µ=µ0+RTln f/a
б) µ=µ0+RTlnP
в) µ=G0
д) µ=0
е) µ=µ0+RTlnG
40. Егер жүйе бастапқы күйден соңғы күйге изотермиялық жолмен ауысса, онда:
а) ∆G=0
б) ∆G=∆H+Т(∂G/∂T)p
в) ∆G=∆S/T+T(∂G/∂T)p
д) ∆F=∆H-T∆S
е) ∆G=−TdS +VdP
41. Термодинамикада ашық жүйелер үшін фундаменталды теңдеуді көрсетіңіз:
а) dU= TdS – PdV+

б) dU=−TdS +VdP +

в) dU=TdS+VdP+

д) dG=dS/T+T(∂G/∂T)p+

е) dH ≤ −TdS +VdP+

42.Егер жүйе тек қана ұлғаю жұмысын жасаса, келесі дифференциалды теңдеу қолданылады:
а) dH ≤ TdS + PdV ;
б) dH ≤ SdT +VdP
в) dH ≤ TdS +VdP;
д) dH ≤ −TdS +VdP ;
е) dU=−TdS +VdP +

43. Химиялық тепе-теңдік жағдайы сипатталады
А) тікелей және кері химиялық реакциялардың жүруін тоқтатумен
Б) тікелей және кері реакциялар жылдамдығының теңдігімен
С) өнімдердің жиынтық массасының реагенттердің жиынтық массасына теңдігімен
Д) реагенттер затының жиынтық санына өнім затының жиынтық санының теңдігі
44. Динамикалық тепе-теңдік күйіндегі жүйеге катализаторды енгізу
А) тек тікелей реакция жылдамдығын арттырады
Б) тек кері реакция жылдамдығын арттырады
C) тікелей және кері реакция жылдамдығын арттырады
Д) жылдамдыққа тікелей де, кері де реакция әсер етпейді
45. N2 + 3Н2↔2NH3 + Q жүйесіндегі химиялық тепе-теңдікті араластыруға
әсер етпейді
А) температураның төмендеуі
Б) қысымның жоғарылауы
С) реакция аймағынан аммиакты шығару
Д) катализаторды қолдану
46. Қандай жағдайларда реакция өздігінен жүре алмайды:
А) ΔS > 0,
Б) ΔG < 0,
С) ΔH =0,
Д) ΔG = 0
47. Қандай жағдайда реакция өздігінен алға бағытта жүреді?
А) ΔG=0,
Б) ΔS< 0,
С) ΔG < 0
Д) ΔG = 0
48. Химиялық реакция изохорасының теңдеуі
А)

Б)

С)

Д)

49. Химиялық реакция изобарасының теңдеуі
А)

Б)

С)

