ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 103
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
* еріген зат мөлшерінің ерітінді көлеміне қатынасы .
*+еріген зат массасының ерітінді массасына қатынасы.
* ерітінді көлемінің ерітінді массасына қатынасы.
* еріген зат массасының еріткіш массасына қатынасы.
! Қан плазмасына изотонды болатын натрий хлоридінің ерітінділері:*1%.
* +0,9%. * 1М. * 0,1%. * 5%.
! Қан плазмасына гипертонды болатын натрий хлоридінің ерітінділері:*0,01М.
* 0,9%. * 0,1%. * 0,15М. * +5%.
! Қан плазмасына гипотонды болатын натрий хлоридінің ерітінділері:*10%.
* 0,9%. * 1М. * 0,15М. *+0,05%.
! Электролит ерітінділерінде:
*ерітуге алынған молекула саны ерітіндідегі бөлшектер санына тең.
* ерітуге алынған молекула саны ерітіндідегі бөлшектер санынан артық.
* i = 1. *+i > 1. * i < 1.
! Бейэлектролит ерітінділерінде ассоциация процесі жүрмеген жағдайда:
*ерітуге алынған молекула саны ерітіндідегі бөлшектер санына кем.
* ерітуге алынған молекула саны ерітіндідегі бөлшектер санынан артық.
*+i = 1. * i > 1. * i < 1.
! Бейэлектролит ерітінділерінде ассоциация процесі жүрген жағдайда:
*ерітуге алынған молекула саны ерітіндідегі бөлшектер санына тең.
* i=1. * i > 1. * +i < 1
* ерітуге алынған молекула саны ерітіндідегі бөлшектер санынан кем.
.
! Венаның ішіне жіберетін инъекция ретінде қолданылатын ерітінді:
*+изотонды. * Гипертонды.
* Гипотонды.
* осмостық қысымы қан плазмасынан артық.
* осмостық қысымы қан плазмасының қысымынан төмен.
! Көз тамшылары ретінде қолданылатын ерітінді:*+изотонды. *Гипертонды.
* Гипотонды.
* осмостық қысымы көз сұйықтығымен артық.
* осмостық қысымы көз сұйықтығынан төмен.
! Ми сұйықтығына енгізу үшін қолданылатын ерітінді:*+изотонды.
*Гипертонды. * Гипотонды
* осмостық қысымы ми сұйықтығынан артық.
* осмостық қысымы ми сұйықтығынан төмен.
! Іріңді жараларды шаюға қолданылатын натрий хлоридінің ерітіндісі :
*Изотонды. *+гипертонды.
* осмостық қысымы қан плазмасының қысымынан артық.
* осмостық қысымы қан плазмасының қысымымен бірде.
* осмостық қысымы қан плазмасының қысымынан төмен.
! Осмостық қысымды есептеу үшін Вант-Гофф теңдеуінің математикалық теңдеуі:
*+ π = CRT .


! Коллигативті қасиеттерге жатпайды:
* ерітінді бетіндегі еріткіштің қаныққан бу қысымының төмендеуі.
* ерітіндінің қайнау температурасының жоғарылауы.
*ерітіндінің қату температурасының төмендеуі.
* +еріткіштің қаныққан бу қысымы.
* осмостық қысым.
! Қайнaу температурасында:
*сұйықтықтың қаныққан бу қысымы атмосфералық қысымнан төмен.
*+сұйықтықтың қаныққан бу қысымы атмосфералық қысыммен бірдей.
* сұйықтықтың қаныққан бу қысымы атмосфералық қысымнан жоғары.
* сұйықтықтың қаныққан бу қысымы атмосфералық қысымнан екі есе төмен.
* сұйықтықтың қаныққан бу қысымы атмосфералық қысымнан екі есе артық.
! Электролит ерітінділерінде:
*i = 1. * a > 1. * i < 1.
*+a ≤ 1. * a = 0.
! Бейэлектролит ерітінділерінде:
*i > 1. * i < 1. *+i = 1. *a < 1.
! 1М сірке қышқылы және 1М калий хлориді ерітінділерінің осмостық қысымдарының (π* мен (π* арасындағы байланыс мына қатынас бойынша анықталады:*π1 = π2. *π1 > π2.
*π1 ≥ π2. *+π1 < π2. *π1 = 2π2.
! 1М глюкоза және 1М алюминий хлориді ерітінділерінің осмостық қысымдарының (π* мен (π* арасындағы байланыс мына қатынас бойынша анықталады:*π1 = π2.
* π1 > π2. * π1 ≥ π2. *+π1 < π2. *π1 = 4π2.
! 1М сахароза және 1М алюминий нитраты ерітінділерінің осмостық қысымдарының (π* мен (π* арасындағы байланыс мына қатынас бойынша анықталады:
*π1 = π2. *π1 > π2. *π1 ≥ π2. *+π1 < π2.
! Судың криоскопиялық тұрақтысы 1,860 1 моляльді калий хлориді ерітіндісінің қату температурасы тең болады, егер 100% диссоциацияға ұшыраса:*00 С.
*-1,860 С. *+1,860 С. *+3,720 С.
*-3,720 С. +
! Судың криоскопиялық тұрақтысы 1,860 1 моляльді фруктоза ерітіндісінің қату температурасы тең болады:*-0,930 С.
* -1,860 С .+ * +1,860 С.
* -3,720 С. *+3,720 С.
! Судың эбуллиоскопиялық тұрақтысы 0,520 1 моляльді калий хлориді ерітіндісінің қайнау температурасы тең болады, егер 100% диссоциацияға ұшыраса:* 1000 С. *99,48 0 С.
*100,520 С. *98,960 С. *+101,040 С.
! Судың эбуллиоскопиялық тұрақтысы 0,520 1 моляльді глюкоза ерітіндісінің қайнау температурасы тең болады:
*1000 С. * 99,48 0 С. *+100,520 С.
* 98,960 С. * 101,040 С.
! 0,05 моляльді бейэлектролиттің судағы ерітіндісінің қату температурасы :*00 С.
*-0,930 С. *-1,860 С.
*-0,0930 С.+ *+0,930 С.
! 0,01 моляльді бейэлектролиттің судағы ерітіндісінің қату температурасы :
*0,1860 С. *-0,930 С. *-1,860 С.
*-0,0930 С. *-0,01860 С. +
! Эквимолярлы сулы ерітінділері үшін қату температурасы максимальды болатын ерітінді:*C6H5NH3Cl. *Ca(NO*2.
*Al(NO*3. *NaNO3. *+ C6H12O6.
! Эквимолярлы сулы ерітінділері үшін қату температурасы минимальды болатын ерітінді:*C6H5NH3Cl. *Ca(NO*2.
*+Al(NO*3. *NaNO3. *C6H12O6 (фруктоза).
! Эквимолярлы сулы ерітінділері үшін қайнау температурасы максимальды болатын ерітінді:
*C6H5NH3Cl (ани лингидрохлориді).
*Ca(NO*2. *+Al(NO*3. *NaNO3.
! Эквимолярлы сулы ерітінділері үшін қайнау температурасы минимальды болатын ерітінді:*C6H5NH3Cl.
* Ca(NO*2. * Al(NO*3. * NaNO3.
* +C6H12O6.
! Жартылай өткізгіш мембрана:
*органикалық зат молекулаларын өткізеді.
*+тек еріткіш молекулаларын өткізеді.
*тек еріген зат молекулаларын өткізеді.
*еріткіш және еріген зат молекулаларын өткізеді .
*еріткіш және еріген зат молекулаларын өткізбейді.
! Егер 18 г глюкоза 1000 г суда еріген болса, онда ерітінді моляльдығы тең болады:*1 моль/кг. *0,5 моль/кг.
*+0,1 моль/кг. *1,1 моль/кг.
*0,01 моль/кг.
! 0,1 моляльді ерітінді алу үшін 1 л суда еріту үшін сахарозаның қажетті массасы:
*342 г. *+34,2 г. *3,42 г. *0,342 г. *180
! Коллигативті қасиеттерге жатпайтыны:
*∆Тқай. *∆Тқату. *Π. *+Тқай. *Т.
! Коллигативті қасиеттерге жатқызуға келмейді:*∆Тқай. *+Тқату. *Π. *
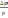
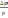 . *K.
. *K.! Бірдей температурада изотонды ерітінділердің тең болуы керек:
*Ерігіштік. *Тығыздығы.
*эквивалентті молярлы концентрациясы.
*+осмостық қысымы. *Көлемі.
! «Компоненттің парциальды қысымы оның ерітіндідегі мольдік үлесіне тура пропорциональ» деген ұғым қандай заң ретінде белгілі:*Генри. *Вант-Гофф.
*+Рауль. *Оствальд. *Нерист.
! Қышқылды буферді алу үшін араластыру керек:*/күшті қышқыл мен күшті негізді.
*әлсіз қышқыл мен әлсіз негізді.
*+әлсіз қышқыл және оның күшті негізден түзілген тұзын.
*күшті қышқыл және оның күшті негізден
*әлсіз негіз және оның күшті қышқылдан
! Сілтілік буферді алу үшін араластыру керек:*күшті қышқыл мен күшті негізді.
*әлсіз қышқыл мен әлсіз негізді.
*әлсіз қышқыл және оның күшті негізден
*күшті қышқыл және оның күшті негізде
*+әлсіз негіз және оның күшті қышқылдан түзілген тұзын.
! Сыртқы әсерлерден қандай-да бір параметрді белгілі бір деңгейде тұрақты ұстап тұратын тепе-теңдік жүйесі:
*Термодинамикалық. *Теңдік. *Оқшау.
*+буферлі. *Гомогенді.
! Протолиттік буферлі жүйе рН тұрақтылығын ұстап тұрады:
*температура жоғарылағанда.
*температура төмендегенде.
*концентрация жоғарылағанда.
*+аз мөлшерде күшті қышқыл немесе негіз қосылғанда.
*аз мөлшерде күшті тұзды қосылғанда.
! Протолиттік буферлі жүйенің негізгі сипаттамалары:*Қайнау температурасы.
*+рН. *температураның қатуы.
*еріткіштің қаныққан бу қысымы.
*Тығыздығы.
! Изотонды коэффициенті бірге тең ерітіндіні көрсетіңіз:*NaCL. *Ca(NO*2.
*+C12H22O11. *Al(NO*3. *NH4Cl.
! Изотонды коэффициенті екіге тең ерітіндіні көрсетіңіз:*CO(NH*2. *Ca(NO*2.
*C12H22O11. *CaCl2. *+NH4Cl.
! Изотонды коэффициенті үшке тең ерітіндіні көрсетіңіз:*CO(NH*2.
*+Ca(NO*2. *C12H22O11. *NaCl. *NH4Cl.
! Изотонды коэффициенті төртке тең ерітіндіні көрсетіңіз:*CO(NH*2.
*+Al(NO*3. *C12H22O11. *NaCl. *NH4Cl.
! Сірке қышқылының сулы ерітіндісінің эквивалентті өткізгіштігінің электролиттің концентрациясы артқан кезде төмендеуі
*Электрофаретикалық әсермен
* Релаксациялық әсермен
* Ерітінді тұтқырлығының азаюы
* +Диссоциация дәрежесінің төмендеуі
* Диссоциация дәрежесінің жоғарлауы
! Натрий хлоридінің сулы ерітіндісінің эквивалентті өткізгіштігінің электролиттің концентрациясы артқан кезде төмендеуі
*+Электрофаретикалық әсер
* Релаксациялық әсермен
* Ерітінді тұтқырлығының азаюы
* Диссоциация дәрежесінің төмендеуі
*Иондардың кинетикалық энергиясының артуы
! Электролиттің сулы ерітіндісін үздіксіз араластырғанда оның эквивалентті эдектрөткізгіші мынаған тең.* 0-ге
*Судың электрөткізгіштігіне
*+Иондардың шекті қозғалысының санына
*Иондардың қозғалысының әртүрлі шегіне
*Иондардың шекті қозғалысының шығуына
! Электролиттің сулы ерітіндісінің эквивалентті электрөткізгіштігі максималды болады
*Қаныққан ерітіндісінде
*Аса қаныққан ерітіндісінде
*+Үздіксіз араластыруда
*Араласқан ерітіндісінді
*Концентрлі ерітіндісінде
! Күшті электролиттің ерітіндісі үшін, бірзарядты екі иондарға диссоциацияланатын Кольрауш заңына сәйкес иондардың тәуелсіз қозғалысының теңдеуі мына түрде *+
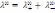
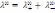
*
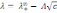
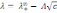 *
*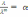
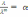
*
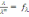
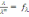 *
*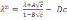
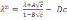
! Сулы ерітінділерде гидроксоний иондарының аномальді қозғалысы түсіндіріледі:
*Электрофаретикалық әсермен
*.Ерітінді тұтқырлығының азаюы
*.Диссоциация дәрежесінің төмендеуі
* дәрежесінің өсуі


