ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 98
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
*+Протон тасымалдануының эстафетті механизмімен
! Температураның өсуімен күшті электролиттер ерітінділерінің электрөткізгіштігінің жоғарылауы негізделеді:*Электрофаретикалық әсерге
*Релаксациялық әсерге
*+Ерітінді тұтқырлығының азаюына
*.Диссоциация дәрежесінің төмендеуіне
*Диссоциация дәрежесінің жоғарлауына
! Ерігіштік – бұл *Ерітінді концентрциясы
* Ерітіндінің концентрциясының максимальды болу мумкіндігі
*+Қаныққан ерітіндінің концентрациясы
* Заттардың еру жылдамдығы
*Еріткіш концентрациясы
! Негіз деп (протолиттік теорияға сәйкес):
*Металл атомы гидроксо топпен қосылған зат
*Молекула немесе протонның донор-ионы
*+Молекула немесе протонның акцептор-ионы
*Суда еріткенде рH-ы өсетін зат
*Молекула немесе протонның донор-ионы
!. 0,01М HCl ерітіндісінің рH-ын есептеңіз.
*0,01 *0,1 *1 *+2 *0,5
! Құрамында 0,1 моль/л натрий гидрофосфаты мен 0,3 моль/л калий дигидрофосфаты бар буферлік ерітіндінің рH-ын есепте. (рК=7,2**+6,73
*7,21 *7,11 *7,51 *67,3
! Қайнау температурасы – дегеніміз:
*сұйықтық буланады
*Сұйықтық тез буланады
*Булану сұйықтықтың барлық көлемінде жүреді
*+Сұйықтықтың бу қысымы сыртқы қысымға теңеседі
*Булану сұйықтықтың жоғарғы бетінде жүреді
! Ерітінділер – бұл
*Екі компонентті гомогенді жүйе
*+Көп компонентті гомогенді жүйе
*Бірнеше заттардың қоспасы
*Жаңа химиялық заттар
*Көп компонентті гетерогенді жүйе
! Ерітінділердің коллигативтік қасиеттері:
*+Еріген заттың сандық бөлшегіне тәуелді
*Еріген зат табиғатына тәуелді
*Еріген заттың сандық бөлшегіне тәуелді емес
*Еріген зат табиғатына тәуелді емес
*Еріген зат табиғатына тәуелді және еріген заттың сандық бөлшегіне тәуелді емес
! Таза еріткішпен салыстырғанда ерітіндінің:
*қаныққан бу қысымы қалыпты
*Қайнау температурасы төмен болады
*Қаныққан бу қысымы жоғары
*Қату температурасы өседі
*+Қату температурасы азаяды
! таза еріткішпен салыстырғанда ерітіндінің қаныққан бу қысымының қатысты төмендеуі еріген заттың мольдік бөлшегіне тең:
*Гиббс-Коноваловтың бірінші заңы
*+Раульдің бірінші заңы
*Гиббс-Коноваловтың екінші заңы
*Вант-Гофф заңы *Раульдің екінші заңы
! Вант-Гофф заңына сәйкес келетін теңдеу:
*


Тқайн = Еm* *+
 = CRT
= CRT *

 Тқату = Km* *
Тқату = Km* *
 Р/Р1 = x* *p1 = p10x1
Р/Р1 = x* *p1 = p10x1 !. Эбулиоскопиялық константа Е неге тәуелді:
* Еріген заттың табиғатына тәуелді
* Еріткіштің табиғатына тәуелді емес
* Бимелирован?
* Еріткіштің табиғатына және еріген заттың табиғатына тәуелді
*+Еріткіштің табиғатына тәуелді
!. Криоскопиялық константа К:
*+ Еріткіштің табиғатына тәуелді
* Еріген заттың табиғатына тәуелді
* Еріткіштің табиғатына тәуелді емес
* Температураға тәуелді
* Еріткіштің табиғатына және еріген заттың табиғатына тәуелді
! Еріген заттың криоскопиялық молярлық массасын анықтау үшін мына қатынас қолданылады:* +

 Тқату = Кm2
Тқату = Кm2 *

 Тқайн = Еm* *
Тқайн = Еm* * 
 S = Q/T
S = Q/T*
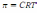
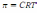 * Г = -C/RT(d
* Г = -C/RT(d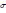
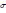 /dC)
/dC) !. Жоғары осмостық қысымы бар ерітіндіге эритроцитті салғанда мына процесс болады:*+плазмолиз * гемолиз
* судың плазмадан жасушаға өтуі
* эндосмос
*жасушаның сыртқы қабатының бөлінуі
! Көк тамырға енгізілетін дәрілік заттардың ерітіндісі қан плазмсына сәйкес келуі керек *+Изотонды * Гипертонды
* Гипотонды * Қаныққкан * Қанықпаған
! Жасушаның осмостық қысымы
* эндосмос * плазмолиз *гемолиз
*+ тургор * экзосмос
! Дәрілердің изотондық концентрациясын былай анықтауға болады
*. Арениус заңы бойынша
*. Фазалардың бөлінуі бойынша
*. Термодинамикалық жолмен
*+Раульдің екінші заңы бойынша
*. Кинетикалық жолмен
!. Изотондық коэффициент і неге тең:
*Электролиттер үшін 1 тең
* Бейэлектролиттер үшін 1 үлкен
* Электролиттер үшін 1 аз
* Бейэлектролиттер үшін 0 тең
*+Электролиттер үшін 1 тең
!. α(n-*+1 мөлшерін анықтайтын қайсысы:
*Иондану дәрежесінің
*Иондану константасының
*pH мөлшерін *Изотонды коэффициентті
*Ионды бөлшектерге бөлінген сан
!. Күшті электролиттер теориясын кім ұсынды?*+ Дебай мен Хюккель
* Вант-Гофф *Аррениус * Гиббс
!. Сұйық қоспа буланғанда алынған будың құрамы бастапқы сұйық қоспаның құрамындай болатын ерітінділерді тап:
*Гомогенді *Гететогенді *Теңмөлшерлі
*Қайтымды *+Азеотропты
!. Криоскопиялық тұрақты:
*. Концентрацияға тәуеді емес
*. Температураға тәуелді емес
*.Еріткіштің табиғатына тәуеді емес
*+Еріткіштің табиғатына тәуеді
*.Еріген заттың табиғатына тәуелді
! Эбулиоскопиялық тұрақты:
*. Концентрацияға тәуеді емес
*. Температураға тәуелді емес
*.Еріткіштің табиғатына тәуеді емес
*+Еріткіштің табиғатына тәуеді
*.Еріген заттың табиғатына тәуелді емес
!. Төменде көрсетілген заттардың қайсысының изотондық коэффициенті 1 тең*+C12H22O11 * NaCl * KNO3 * CuSO4
!. Төменде көрсетілген заттардың қайсысының изотондық коэффициентінің мәні 1 тең емес* манноза * глюкоза
* фруктоза * галактоза
*+натрий гидрокарбонаты
!. Буферлік ерітінділерге жатады
*. Күшті негіз және оның тұзы әлсіз қышқылмен
*+Әлсіз негіз және оның күшті тұзы күшті қышқылмен
*. Күшті қышқыл мен оның тұзы және әлсіз негіз
*. Күшті қышқыл мен оның тұзы және күшті негіз
*. Әлсіз қышқыл мен күшті негіз
! Сутектік көрсеткіш формула бойынша рН анықталады* pH= lgCH+ * рН=-1nСн+
* рН= ln СH+ * рН=-1n С он-
* +pН= - lgCн+
! Қышқылды ортада неге тең:*рН>7
* pН=7 *+рН<7 * [Н+] = 10-7моль/л
* [H+]<10-7 моль/л
! Бейтарап ортада тең:* рН = 0 *+pH=7
* рН<7 * [Н+] < 10-7 моль/л
* [H+ ]>10-7 моль/л
! молярлық концентрациясы 0,1 моль/л хлорсутек қышқылы ерітіндісінің pH-ы тең:* 7 * 0,1 *+1 * 13 * 5
! молярлық концентрациясы 0,01 моль/л және диссоциация дәрежесі α = 0 сірке қышқылының судағы ерітіндісінің рН-ы :
* 11 *+4 *12 * 2 * 10-4
!. молярлық концентрациясы 0,01 моль/л натрий гидроксиді ерітіндісінің pH-ы тең:
* 10-* *10-12 * 7 *+12 * 2
! молярлық концентрациясы 0,01 моль/л және диссоциация дәрежесі α = 0,001 сірке қышқылының судағы ерітіндісінің рН-ы тең:* 10
-9 * 2 *+9 * 10-5 * 5
! 250С-та судың иондық көбейтіндісі мынаған тең болады:* 7 * 14 * 10-7
* 1014 * +10-14
!.Фосфат буферге сәйкес келетін қоспа құрамын тап * H3PO4 + Na3PO4
* H3PO4+NaH2PO4
*Na2HPO4+Na3 PO4
*+NaH2PO4+Na2HPO4
* H3PO4+Na2HPO4
!.Гидрокарбонатты буферге сәйкес келетін қоспа құрамын тап:*+ H2CO3+NaHCO3
* Н2СO3+Nа2СО3 * Na2CO3+ CO2
* Н2СО3+NaOH * NaHCO3+NaOH
!.Егер рН-ы 3-ке тең болғанда:
*+ pOH = 11 * Сутегі иондардың концентрациясы 0,1 моль/л тең
* Сутегі иондардың концентрациясы 0,01 моль/л
* Сутегі иондардың концентрациясы 1 моль/л тең * рОН = 4
! Егер рОН= 3 боғанда :
*Гидроксил иондарының концентрациясы 0,2-ге тең * +рН = 11
*Гидроксил иондарының концентрациясы 0, 1-ге тең
*Сутегі иондарының концентрациясы 0, 001-ге тең * рН = 10
!. Вант-Гофф заңына сәйкес берілген температурада ерітіндінің осмостық қысымы мынаған тура пропорционал:
*+Еріген заттар молярлық концентрациясына
* Еріткіштің мольдік үлесіне
* еріген заттың молялдық концентрациясына
* еріген заттын массалық үлесіне
*Еріткіштің молярлық концентрациясына
!. Ақуыз қатысына негізделген қысым ... қысым деп аталады* осмостық
*+онкотическалық * гидростатикалық
* атмосфералық * парциалдық
!. Төменде көрсетілгендердің қайсысы фосфат буферге сәйкес келеді?
* H3PO4 + Na3PO4 * H3PO4+NaH2PO4
*Na2HPO4+Na3 PO4 * H3PO4+Na2HPO4
* +NaH2PO4+Na2HPO4
Ооо
1. Қандай жағдайлардаА+В->Схимиялықреакция жылдамдығының константасыреакцияның жылдамдығына тең (V = к)?
а)элементарлы химиялық реакцияларға;
в) реакцияласушы заттар газ фазасында болған жағдайда;
с)реакцияласушы заттардың концентрациялары бірге тең болған жағдайда(СА = СВ = а);+
д)реакция фазалар шекарасында өтетін жағдайда;
е)химиялық реакция жылдамдығының константасыреакцияның жылдамдығына тең болмайды.
2. Химиялық реакция жылдамдығы константасының физикалық мағынасы қандай?
а)газ фазасында өтетін жағдайда химиялық реакция жылдамдығының константасы реакцияның жылдамдығына тең болады;
в) реакцияласушы заттардың концентрациялары бірге тең болған жағдайдагомогендіхимиялықреакцияжылдамдығының константасы реакцияның жылдамдығына тең болады;+
с) реакция фазалар шекарасывда өтетін жағдайда химиялық реакция жылдамдығының константасыреакцияның жылдамдығына тең болады;
д)химиялық реакция жылдамдығы константасының физикалық мағынасы жоқ;
е) элементарлы химиялық реакцияларға, немесе бір сатьщан тұратын гетерогенді реакцияларға реакция жылдамдығының константасы реакцияның жылдамдығына тең болады.
3. Химиялық реакция жылдамдығының константасы деп нені айтады?
а) жылдамдық константасы деп элементарлы, бір сатымен өтетін реакция-лардың жылдамдығын айтады;
в) жылдамдық константасы деп газ фазасында өтетін химиялық реакция-ның жылдамдығын айтады;
с) жылдамдықконстантасыдепфазаларшекарасындаөтетін химиялық реакцияның жылдамдығын айтады;
д)жылдамдықконстантасыдепреакцияласушызаттардың концентра-циялары бірге тең болған жағдайда гомогенді химиялық реакцияның жылдамдығын айтады;+
е)жылдамдық константасы деп реакцияласушы заттарға идеалды газдар қасиеттері орындалатын жағдайдағы химиялық реакция жылдамдығын айтады.
4. Нөлінші ретті химиялық реакцияға жылдамдық константасының размерлігі қандай? С- концентрация; і – уақыт.
а)С-1-t-1
в)С-t-1;
с)t -1;
д)C 2 –t -1;
е)C -2-t -1+
5. Бірінші ретті химиялық реакцияға жылдамдық константасының размерлігі қандай? С – концентрация; і – уақыт.
а)С -1 –t -1;
в)С-t -1;
с)t -1;+
д)С 2-t -1;
е)С -1.
6. Екінші ретті химиялық реакцияға жылдамдық константасының размерлігі қандай? С – концентрация; і – уақыт.
а)С -1-t -1;+
в)С-t -1;
с)t -1;
д)С 2-t -1;
е)С -1.
7. Химиялық реакцияның жылдамдығы деп нені айтады?
а) элементар химиялық сатыда реакцияласушы заттар концентрация-ларының өзгеруін айтады;
в) элементар химиялық сатыда бастапқы зат концентрациясының өзгеруін айтады;
с) көлемнің бірлігінде және де уақыттың бірлігінде реакцияласатын молекулалар санын айтады;
д)бастапқы заттар және өнімдер концентрацияларының өзгеруін айтады;+
е) реакцияласушызаттарконцентрацияларыныңкөбейтіндісін айтады.
8. Реакция жылдамдығы теріс мәндерді қабыддай ма? А→В реакцияға W = -dСА/dt жазу не білдіреді?
а) реакция жылдамдығы теріс мәндерді қабыддайды, W = -dСА/dt жазу дұрыс;+


