ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.03.2024
Просмотров: 223
Скачиваний: 0
СОДЕРЖАНИЕ
химических элементов в земной коре
Особенности распределения химических
2.3. Биологический круговорот химических
2.4. Природные вариации концентраций
химических элементов в организмах
БИОГЕОХИМИЯ ГАЗОВОЙ ОБОЛОЧКИ ЗЕМЛИ
3.1. Биогеохимическая эволюция состава
организмов в массообмене газов
3.2. Геохимия и биогеохимия аэрозолей
3.3. Значение атмосферного массопереноса
водорастворимых форм химических
4.1. Состав Мирового океана — результат
4.3. Трансформация геохимического состава
природных растворов на контакте речных и
5.1. Планетарное значение педосферы
5.2. Органическое вещество педосферы
5.3. Роль почвы в регулировании
углерод-кислородного массообмена
5.4. Биогеохимическая трансформация
минерального вещества педосферы
5.5. Проблема возникновения почв и
эволюция почвообразования в истории
5.6. Распределение рассеянных элементов
биогеохимических циклов тяжелых
ГЛОБАЛЬНЫЕ БИОГЕОХИМИЧЕСКИЕ ЦИКЛЫ
7.2. Влияние живого вещества на
геохимию кислорода и водорода в биосфере
7.5. Общие черты циклов и распределения
В БИОСФЕРУ В РЕЗУЛЬТАТЕ МОБИЛИЗАЦИИ ИЗ ЗЕМНОЙ КОРЫ
8.5. Общие черты циклов и распределения
9.3. Общие черты циклов и распределения
масс тяжелых металлов в биосфере
10.1. Биогеохимическая зональность
10.2. Геохимическая неоднородность
10.3. Элементарный ландшафт (элементарная
хорологическая единица биосферы Мировой
11.1. Биогеохимия арктических ландшафтов
12.1. Биологический круговорот элементов
12.3. Водная миграция элементов в зоне
бореальных и суббореальных лесов
13.1. Биологический круговорот элементов
в аридных растительных сообществах
13.2. Особенности биологического
круговорота в экстрааридных пустынях
13.3. Биогеохимические особенности
13.4. Взаимосвязь биогеохимических
процессов с водной и атмосферной
миграцией элементов в аридных условиях
БИОГЕОХИМИЯ ТРОПИЧЕСКОГО ПОЯСА
14.1. Биологический круговорот химических
элементов в распространенных тропических
14.2. Биогеохимические особенности
15.2. Поступление тяжелых металлов
в экогеосистемы островов из атмосферы
биогеохимических циклов хозяйственной
деятельностью человеческого общества
16.2. Локальные (импактные) антропогенные биогеохимические аномалии тяжелых металлов
Несмотря на варьирование количества солей и силикатных пылевых частиц, в составе растений аридных ландшафтов ясно обнаруживается избирательное поглощение рассеянных элементов. Расчеты коэффициентов биологического поглощения К5показывают, что в степной и пустынной растительности в равной мере сказывается действие общих биогеохимических закономерностей. Наиболее активно вовлекаются в биологический круговорот стронций, медь, молибден, цинк. Величина их К5устойчиво превышает единицу. Очень слабо поглощаются титан, цирконий, ванадий. Значение их К5часто опускается ниже 0,1.
Графики, характеризующие интенсивность биологического поглощения элементов степной растительностью, приведены на рис. 13.1. Общее увеличение концентрации зольных элементов в растениях при переходе от степных ландшафтов к пустынным не меняет соотношение величины К5микроэлементов.
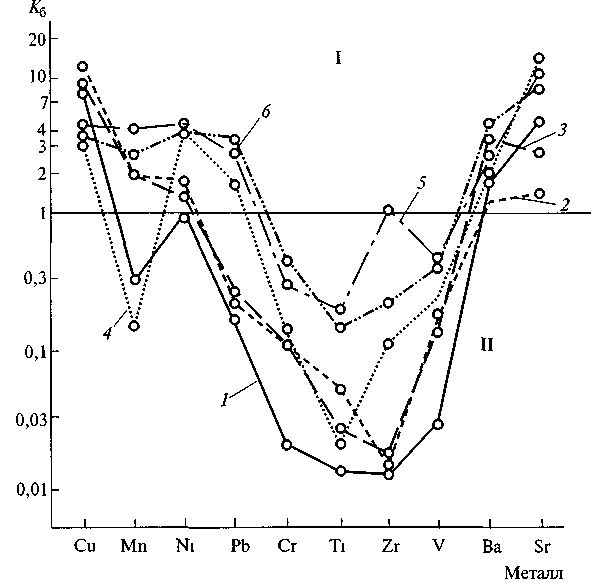
Рис 131 Интенсивность биологического поглощения металлов растениями, характерными для северных степей Среднерусской возвышенности (по Л Е Савельевой, 1979)
I — надземная часть 1 — клевер, 2 —- злаки, 3 — разнотравье, II — корни 4 — клевер, 5 — злаки, 6 — разнотравье
13.2. Особенности биологического
круговорота в экстрааридных пустынях
Значительный научный, а в недалеком будущем, возможно, и практический интерес представляют биогеохимические процессы, происходящие в наименее благоприятных для жизни условиях экстрааридных пустынь. Такие пустыни занимают огромное пространство в центре суперконтинента Евразии. Одной из наиболее суровых пустынь Центральной Азии является Гоби. В ее западной части обычно выпадает атмосферных осадков от 20 до 50 мм/год при испаряемости 1250 мм/год Поверхность пологих предгорных склонов (бэлей) и межгорных равнин покрыта плотным каменистым панцирем. Панцирь, образованный щебнем метаморфических и вулканических горных пород с блестящей черной глазурью «пустынного загара», способствует ощущению полной безжизненности местности. Примерно раз в 7—10 лет до Гоби доходят несущие влагу воздушные массы и здесь выпадают обильные дожди. Их результатом являются многочисленные мелкие ложбины (сайры), рассекающие поверхность гамады (каменистой пустыни) на отдельные вытянутые участки.
Большая часть пустыни Гоби покрыта редкой растительностью, состоящей из кустарников и полукустарничков. Среди кустарников преобладает черный саксаул (Haloxylonammodendrori), эфедра Пржевальского (EphedraPrzewalskii), парнолистник (Zygophyllumxanthoxylon), реамюрия (Reamuriasoongorica); среди полукустарничков — баглур (Anabasisbrevifoha), симпегма (Sympegmaregeln). На периферии пустынной зоны появляются злаки (Stipaglareosa), луки (Alliummongolicum) и др. На крайнем юге, в области распространения экстрааридных ландшафтов участки каменистой пустыни полностью лишены растительности или несут очень редкие экземпляры ильинии (lljiniaregelii) — 1,3 экземпляра на 100 м2 (Казанцева Т. И., 1986). В мелких сайрах, расчленяющих поверхность гама-ды, растут отдельные экземпляры саксаула и эфедры.
Установлено, что в промытых бидистиллированной водой растениях экстрааридных ландшафтов концентрация щелочных, ще-лочно-земельных элементов и железа измеряется десятыми и сотыми долями процента; марганца, цинка, стронция и частично хрома — значениями 10п мкг/r; меди, никеля и ванадия — п мкг/г; свинца и кобальта — как правило, менее 1 мкг/г сухой массы растений. Необходимо учитывать, что элементы распределяются по органам растений неодинаково. Концентрация натрия в зеленых органах значительно выше, чем в стволах кустарников и стеблях полукустарничков, в которых выше концентрация кальция. Распределение стронция, железа и марганца аналогично кальцию: большие значения приурочены к стволам и стеблям. Распределение других тяжелых металлов сложнее. Более высокие концентрации цинка
установлены в стеблях ильинии и стволе саксаула, но в эфедре концентрация этого металла выше в листьях. Максимальные концентрации меди обнаружены в листьях кустарников (эфедры и саксаула), но в ильинии большие значения относят к стеблям.
Интенсивность вовлечения химических элементов из почвы в биологический круговорот показана на рис. 13.2. Наибольшие значения К6, рассчитанные для ежегодно нарастающей зеленой массы растений пустынь Заалтайской Гоби, обнаружены для цинка (до 20 — 40) и натрия (до 15); для стронция, хрома, меди, никеля и ванадия К6равен от 1 до 10; для железа и марганца К5 < 1.
При сопоставлении значения К5продукции растительности всей суши (см. табл. 2.4) и изученных растений видно, что главные ценозообразователи экстрааридных пустынь Заалтайской Гоби (саксаул и ильиния) отличаются большей интенсивностью поглощения натрия и отчасти магния и стронция. Это обусловлено крайне засушливыми условиями, усиленной транспирационной деятельностью растений и высокой концентрацией солей в почвах. Обращает внимание, что величина kqнекоторых тяжелых металлов превышает средние значения их К5для продукции растительности суши. Возможно, что это связано с присутствием в почвах экстрааридных ландшафтов легкомобилизуемых форм металлов, в первую очередь тех, содержание которых в почвообразующем субстрате гобийских пустынь превышает кларк гранитного слоя литосферы. К таким металлам относятся цинк, медь, хром и ванадий.
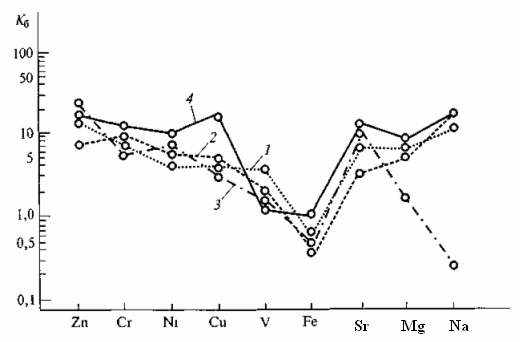
Рис. 13.2. Интенсивность биологического поглощения химических
элементов растениями-ценозообразователями экстрааридных
пустынь Гоби:
1 — саксаул, 2 — ильиния, 3 — эфедра Пржевальского, 4 — баглур
Палеогеографическая эволюция Южной Монголии на протяжении кайнозоя характеризовалась прогрессивно нарастающим иссушением. Этот процесс в Гоби, как и в других пустынях Центральной Азии, с одной стороны, как предполагал Н.И.Вавилов, подавлял видообразование, а с другой — способствовал сохранению видов и форм, хорошо приспособленных к аридным ланд-шафтно-геохимическим условиям. Поэтому наряду с общими чертами биогеохимии, свойственными растительности гобийских пустынь, отдельные растения обнаруживают специфические особенности. Например, в стеблях полукустарничков обнаружено наиболее высокое среди изученных растений содержание железа, а в их зеленых органах — натрия. При этом для баглура
(Anabasisbrevifolia) характерна высокая концентрация стронция. Последняя, возможно, является систематическим признаком, так как эффект избирательной аккумуляции стронция был ранее отмечен нами в пустыне Устюрт для биюргуна (Anabasissalsa).
Специфическими особенностями состава обладают кустарники. Как представители древнеаридной флоры, некоторые из них выработали механизмы, нейтрализующие высокое содержание солей в окружающей среде. Например, в эфедре Пржевальского, растущей в сайрах среди лишенных растительности каменистых пустынь, обнаружено неожиданно низкое содержание главного солеобразующего элемента — натрия и в то же время очень высокое — стронция. В парнолистнике и кориоптерисе отмечены максимальные среди пустынных растений концентрации цинка. Эти и другие факты, свидетельствующие о геохимической специализации флоры Заалтайской Гоби в связи с историей ее формирования и специфическими существующими условиями, нуждаются в дальнейшем пристальном изучении.
Весьма важное геохимическое значение в условиях экстрааридных пустынь приобретает выделение растениями водорастворимых солей при транспирации. Солевые выделения развеиваются ветром, оказывая существенное влияние на состав аэрозолей, или смываются атмосферными осадками, образуя особый поток химических элементов в их биогеохимических циклах.
В зеленых органах растений экстрааридных пустынь Заалтайской Гоби обнаружены следующие количества водорастворимых форм (мкг/г сухого вещества растений): натрия и калия — десятки тысяч в саксауле и тысячи в ильинии; кальция и магния — на один-два порядка меньше; железа — от нескольких единиц в ильинии до 100 и более в эфедре; марганца — от 3 до 19; стронция и цинка — 1 — 2; меди и никеля — десятые доли. Кобальт, хром и свинец отмечены во всех пробах в виде следов; ванадий не обнаружен.
Количества водорастворимых соединений натрия и калия имеют тот же порядок, что и их соединения, прочно связанные в тканях растений. В смывах с зеленых побегов саксаула натрия оказалось больше, чем в веществе растений после промывания, хотя в смывы переходит лишь небольшая часть магния. В отличие от саксаула зеленые побеги эфедры Пржевальского выделяют очень немного водорастворимых соединений натрия, но значительное количество магнезиальных солей. Это свидетельствует о различных механизмах, действующих по отношению к избыточному количеству разных химических элементов в этих кустарниках, наиболее приспособленных к условиям экстрааридных пустынь Заалтайской Гоби.
Содержание водорастворимых форм тяжелых металлов и стронция, которые уходят в смывы, в среднем составляет 5 — 10% от общего количества этих элементов. Прямой пропорциональности между содержанием водорастворимых и прочносвязанных форм элементов не обнаружено, но определенная связь между этими формами существует. Так, повышенная концентрация стронция в зеленых органах эфедры Пржевальского, железа и марганца в саксауле соответственно отражаются на количестве их растворимых форм.
Результаты анализов свидетельствуют, что с уменьшением степени засушливости состав водорастворимых соединений закономерно меняется. Прежде всего это отражается на уменьшении содержания натрия в водных смывах с растений в направлении от экстрааридных ландшафтов к периферии пустыни. В смывах с надземной части растений, типичных для степей (ковыле и полы-нях), концентрация натрия в сотни раз меньше, чем в смывах с зеленых органов растений крайне засушливых пустынь (саксаула, ильинии, баглуре). Можно предположить, что интенсивное выделение зелеными органами растений водорастворимых соединений служит процессом, нейтрализующим отрицательное влияние высокой концентрации в почвенных растворах экстрааридных пустынь не только солей, но и рассеянных металлов.
Полученные результаты позволяют в первом приближении оценить массы химических элементов, вовлекаемые в биологический круговорот в экстрааридных экогеосистемах пустыни Гоби. По данным Т.И.Казанцевой (1986), продукция надземной биомассы ильиниевого сообщества на гамаде равна 220 кг/км2 сухого вещества, продукция саксаулово-ильиниевого сообщества, расположенного в мелких ложбинах — сайрах, расчленяющих гамаду, — 247 кг/км2. Продукция сообщества ксерофитных кустарников — саксаула и эфедры Пржевальского, приуроченных к относительно крупным сайрам, — около 800 кг/км2. Данные о захвате масс элементов в биологический круговорот приведены в табл. 13.5 (для сравнения приведены данные о менее аридном сообществе, расположенном на периферии пустыни и образованным баглуром и ковыльком).
Таблица 13.5
Массы химических элементов, захватываемые в биологический
круговорот в экстрааридных ландшафтах Заалтайской Гоби, г/(км2 год)
| Растительное сообщество | Химический элемент | |||||||||
| Na | Mg | Sr | Fe | Mn | Zn | Cu | N1 | V | Cr | |
| Экстрааридные пустыни | ||||||||||
| Ильиниевое на мезоплакоре | 3960/ 1580 | 770/ 20 | 8/ 0,1 | 110/ 1 | 7/ 0,3 | 4/ 0,2 | 1/ 0,1 | 2/ 0,1 | 1/0,1 | 3/ 0,1 |
| Саксаулильиниевое в сайре | 28150/ 13040 | 8650/ 620 | 107/ 3 | 2200/ 119 | 205/ 54 | 91/7 | 16/0,3 | 14/ 0,2 | 0,35/ 0,1 | 36/ 0,1 |
| Саксаулэфедровое в сайре | 91200/ 101 600 | 36 000/ 2000 | 347/ 9 | 7130/ 387 | 665/ 152 | 294/ 22 | 50/ 0,8 | 0,44/ 0,7 | 144/ 0,1 | 116/ 0,1 |
| Остепненные пустыни | ||||||||||
| Баглуровое с злаками на мезоплакоре | 271800/ 113250 | 60300/ 760 | 1739/ 11 | 26440/ 32 | 1228/ 77 | 658/ 16 | 298/ 0,1 | 170/ 0,1 | 97/ 0,1 | 254/ 0,1 |

