Файл: Федеральное агенство по образованию рф гоу впо бурятский государственный университет.doc
Добавлен: 27.04.2024
Просмотров: 70
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Fe) (зависимость оптической плотности от содержания железа (мг)) (рис.15). Фактор пересчета: F Fe2(SO4)3(NH4)2SO4*24H2O / Fe=0,1162
Данные для построения градуировочного графика представлены в таблице 13.
Таблица 13
Данные для построения градуировочного графика
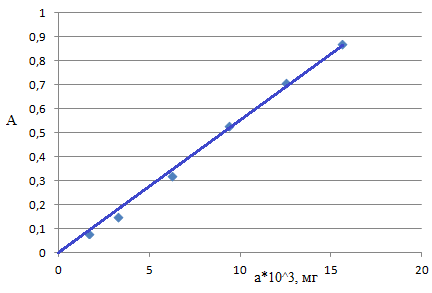
рис.15. Зависимость оптической плотности от содержания железа
(рН=9,0, λ=540нм, l=1см)
Фотометрическое определение железа.
В стеклянные стаканы(50см3) вносили по 1см3растворов, полученных по п.п.1.1. Добавляли по 1см3раствора ПАР (СПАР=2,5∙10-3М) устанавливали рН =9 и измеряли оптическую плотность растворов на фоне раствора ПАР (СПАР=1,0∙10-3М, рН=9,0) при λ=540нм и l=1cм. По градуировочному графику находили содержание железа в пробах.
Метрологическая оценка результатов фотометрического определения железа.
Контроль правильности результатов анализа осуществлялся методом «введено-найдено», для этого определение железа проводилось в 3-х параллелях проб без добавки и 3-х параллелях с добавками железа (mн=10г). Согласно нормативным документам, содержание железа в пробе(m
н=10г) составляет 0,21-0,32мг (Vк=50см3), т.е. концентрация железа в колбе (4,2-6,2)∙10-3мг/см3. С учетом аликвоты (1см3) содержание железа в фотометрируемом растворе должно находится в интервале 4,2-6,2∙10-3мг.
Добавка составляла 0,388 мг железа, т.е., в пробу массой 10г вводилось 1,0 см3 раствора с концентрацией железа 0,388мг/см3.
Измерение оптической плотности проводилось трижды из каждой пробы. Результаты определения железа в пробах хлеба «Флагман» без добавки железа и с добавлением железа представлены в таблице 14.
Расчет содержания железа в пробе: аi=аграф.∙Vк /Val
Статистическая обработка данных приведена в таблице 15.
Таблица 14
Результаты определения железа в хлебе «Флагман»
Доверительный интервал определения железа
в пробе без добавки:
δ = t•S/√n =2,31•0,00421/3 = 0,003
в пробе с добавкой:
δ = t•S/√n =2,31•0,00785/3 = 0,006
Содержание железа в пробе без добавки составляет: (0,251 + 0,003)мг
Содержание железа в пробе с добавкой составляет: (0,637+0,006)мг
Таблица 15
Оценка правильности методом «введено-найдено»
аij ср.=0.386 ∑= 0,017
d = ∑(аij-а0)/n = 0.017/9 = 0.0019 dr = d·100/ аij = 0.0019*100/0.386 = 0.49%
σΣ=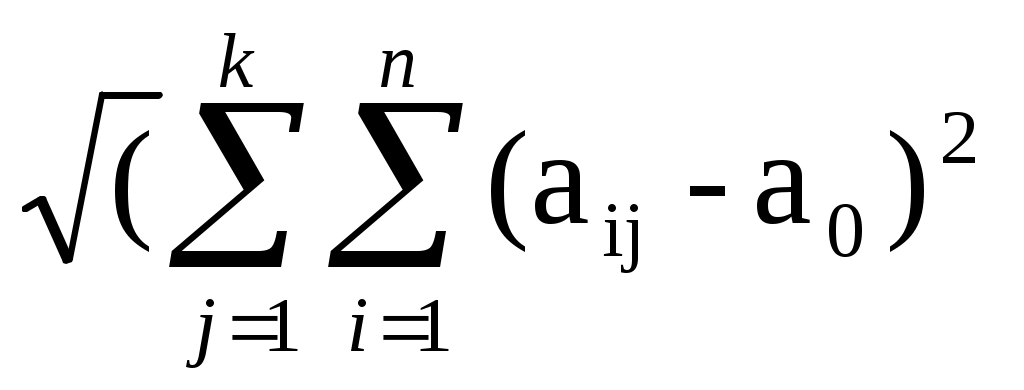 /(n-1)) = 0.00486 σΣ r = (σΣ/ аij)∙100%= 0.00486*100/0.386=1.26%
/(n-1)) = 0.00486 σΣ r = (σΣ/ аij)∙100%= 0.00486*100/0.386=1.26%
tэксп. = dr* √n/ σΣ r = 0.49*3/1,26 = 1.17 tтабл. = 2.31 (Р=0.95, f=8)
δ = t•S/√n =2,31•0,00486/3 = 0,004 μ = аij ср.+δ = 0.386+0,004
С учетом среднего квадратического отклонения были назначены нормативы контроля сходимости, воспроизводимости и точности. При расчете нормативов контроля опирались на алгоритм расчета, приведенный в работах [36,37].
Значение характеристики суммарной погрешности оценивали по значениям характеристик составляющих погрешности (случайной и систематической).
Δ = 1.96√Δ2с/3 + σ(Δ)
Поскольку tэксптабл. систематическая погрешность отсутствует, т.е Δс = 0 и, следовательно суммарная погрешность определяется только значением случайной: Δ = 1.96·1.26 = 2.47%.
Нормативы оперативного контроля:
D = 2.77·1.26= 3.49% отн. от среднего результата анализа (0,03∙х);
K=0,84· Δ = 2.47· 0.84 = 2.08% отн. (внутрилабораторный контроль).
- норматив контроля сходимости: d=2.33%( 0,02∙x);
- норматив контроля воспроизводимости: D=3.49% (0,03∙х);
- норматив контроля точности: K=2.08% (внутрилабораторный)
K=2.47% (внешнелабораторный).
of formation constants – XVIII. The hydrolysis of iron (III) in aqueous KNO3 solutions // Talanta, 1994. – Vol. 41, № 9. – Р. 1577 – 1582.
Данные для построения градуировочного графика представлены в таблице 13.
Таблица 13
Данные для построения градуировочного графика
| V Fe2(SO4)3(NH4)2SO4*24H2O, см3 | 0,5 | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 |
| С Fe2(SO4)3(NH4)2SO4*24H2O, моль/дм3∙104 | 0,05 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 |
| СFe, мг/см3∙104 | 0,325 | 0,650 | 1,250 | 1,875 | 2,499 | 3,125 |
| аFe,мг∙103 | 1,625 | 3,250 | 6,250 | 9,375 | 12,495 | 15,625 |
| А, усл.ед. | 0,080 | 0,150 | 0,320 | 0,530 | 0,710 | 0,870 |

рис.15. Зависимость оптической плотности от содержания железа
(рН=9,0, λ=540нм, l=1см)
Фотометрическое определение железа.
В стеклянные стаканы(50см3) вносили по 1см3растворов, полученных по п.п.1.1. Добавляли по 1см3раствора ПАР (СПАР=2,5∙10-3М) устанавливали рН =9 и измеряли оптическую плотность растворов на фоне раствора ПАР (СПАР=1,0∙10-3М, рН=9,0) при λ=540нм и l=1cм. По градуировочному графику находили содержание железа в пробах.
Метрологическая оценка результатов фотометрического определения железа.
Контроль правильности результатов анализа осуществлялся методом «введено-найдено», для этого определение железа проводилось в 3-х параллелях проб без добавки и 3-х параллелях с добавками железа (mн=10г). Согласно нормативным документам, содержание железа в пробе(m
н=10г) составляет 0,21-0,32мг (Vк=50см3), т.е. концентрация железа в колбе (4,2-6,2)∙10-3мг/см3. С учетом аликвоты (1см3) содержание железа в фотометрируемом растворе должно находится в интервале 4,2-6,2∙10-3мг.
Добавка составляла 0,388 мг железа, т.е., в пробу массой 10г вводилось 1,0 см3 раствора с концентрацией железа 0,388мг/см3.
Измерение оптической плотности проводилось трижды из каждой пробы. Результаты определения железа в пробах хлеба «Флагман» без добавки железа и с добавлением железа представлены в таблице 14.
Расчет содержания железа в пробе: аi=аграф.∙Vк /Val
Статистическая обработка данных приведена в таблице 15.
Таблица 14
Результаты определения железа в хлебе «Флагман»
| Проба | Данные | Хср | Хi -Хср | (Хi -Хср)2*106 | V*106 | S | |
| Без добавки | 1 2 3 | 0,252 0,248 0,250 0,260 0,245 0,254 0,251 0,252 0,249 | 0,251 | 0,001 -0,003 -0,001 0,009 -0,006 0,003 0,000 0,001 -0,002 | 1,00 9,00 1,00 81,00 36,00 9,00 0,00 1,00 4,00 | 17,75 | 0,00421 |
| С добавкой | 1 2 3 | 0,636 0,628 0,637 0,651 0,628 0,644 0,644 0,637 0,631 | 0,637 | -0,001 -0,009 0,000 0,014 -0,009 0,007 0,007 0,000 -0,006 | 1,00 81,00 0,00 196,00 81,00 49,00 49,00 0,00 36,00 | 61,63 | 0,00785 |
Доверительный интервал определения железа
в пробе без добавки:
δ = t•S/√n =2,31•0,00421/3 = 0,003
в пробе с добавкой:
δ = t•S/√n =2,31•0,00785/3 = 0,006
Содержание железа в пробе без добавки составляет: (0,251 + 0,003)мг
Содержание железа в пробе с добавкой составляет: (0,637+0,006)мг
Таблица 15
Оценка правильности методом «введено-найдено»
| № | Введено Fe(мг): а0 | Найдено Fe(мг): аij | Преобразование значений | | σΣ | σΣ r(относ.) (или σ(Δ)) | |
| аij-а0 | (аij-а0)2.106 | ||||||
| 1 | 0,388 | 0,384 0,380 0,387 | -0,004 -0,008 -0,001 | 16,00 64,00 1,00 | 189·10 -6 | 0.00486 | 1,26 |
| 2 | 0,391 0,383 0,390 | 0,003 -0,005 0,002 | 9,00 25,00 4,00 | ||||
| 3 | 0,393 0,385 0,382 | 0,005 -0,003 -0,006 | 25,00 9,00 36,00 | ||||
аij ср.=0.386 ∑= 0,017
d = ∑(аij-а0)/n = 0.017/9 = 0.0019 dr = d·100/ аij = 0.0019*100/0.386 = 0.49%
σΣ=
tэксп. = dr* √n/ σΣ r = 0.49*3/1,26 = 1.17 tтабл. = 2.31 (Р=0.95, f=8)
δ = t•S/√n =2,31•0,00486/3 = 0,004 μ = аij ср.+δ = 0.386+0,004
С учетом среднего квадратического отклонения были назначены нормативы контроля сходимости, воспроизводимости и точности. При расчете нормативов контроля опирались на алгоритм расчета, приведенный в работах [36,37].
Значение характеристики суммарной погрешности оценивали по значениям характеристик составляющих погрешности (случайной и систематической).
Δ = 1.96√Δ2с/3 + σ(Δ)
Поскольку tэксп
Нормативы оперативного контроля:
-
Сходимости: d = D/1.5 = 3.49/1.5 = 2.33% отн. от среднего результата анализа (0.02·х) -
Воспроизводимости: D= Qp,n·σ(Δ), где Qp,n – квантиль, равная 2.77 для двух параллелей и Р = 0.95, σ(Δ) – случайная составляющая погрешности анализа = 1.26%.
D = 2.77·1.26= 3.49% отн. от среднего результата анализа (0,03∙х);
-
Точности: К=Δ = 2.47% отн. (внешнелабораторный контроль);
K=0,84· Δ = 2.47· 0.84 = 2.08% отн. (внутрилабораторный контроль).
1 2 3 4 5
ВЫВОДЫ
-
Проведен анализ литературных данных по комплексообразованию Fe неорганическими и органическими лигандами. -
Рассчитаны константы диссоциации ПАР, построена номограмма распределения форм реагента в зависимости от рН; -
Установлены оптимальные условия комплексообразования Fe с ПАР: рН=9,0 λ=540нм. -
Определен состав комплекса, выяснена форма иона-комплексообразователя и лиганда, рассчитана константа устойчивости комплекса: Me:R=1:2, (Fe(OH)2+, (НR-), lgКуст.=11,83. -
Показано, что реакция комплексообразования железа с ПАР является чувствительной: ε=58900 л∙моль-1∙см-1. -
Определено содержание железа в реальном объекте – хлебе «Флагман». СКО составляет 1,26%. -
Назначены нормативы оперативного контроля для фотометрической методики:
- норматив контроля сходимости: d=2.33%( 0,02∙x);
- норматив контроля воспроизводимости: D=3.49% (0,03∙х);
- норматив контроля точности: K=2.08% (внутрилабораторный)
K=2.47% (внешнелабораторный).
СПИСОК ЛИТЕРАТУРЫ
-
Орлов Д.С., Садовникова Л.К., Лозановская И.Н. Экология и охрана биосферы при химическом загрязнении. – 2002. – 90 с. -
Позняковский В.М. Гигиеничнеские основы питания и экспертизы продовольственных товаров. – Новосиб.:НГУ. – 1996. – 432 с. -
Авраменко В.Н., Есельсон М.П. Спектральный анализ в пищевой промышленности. – М.: Пищевая промышленность. – 1979. – 246 с. -
Чичибабин А.Е. Азокраски пиридина α – ряда // ЖРФХО – 1918. – т. 50 – С. 512-519. -
Чичибабин А.Е., Рязанцев М.Д. Диазотирование и диазореакции α –аминопиридина // ЖРФХО – 1915. – т. 47 – С. 1571-1589. -
Sommer L., Hnilickova М. Azofarbstoffe als Komplexbildner und analytische Reagentien. – Folia prir.fak. UJEP (CSSR, Brno), 1964. – Bd. 5 – S. 115-191. -
Cheng K.L., Bray R.H. 1-(2-Pyridylazo)-2-naphthol as possible analytical reagent // Anal. Chem. – 1955. – Vol. 27 – P. 782 – 785. -
Wehber P. Uber Pyridin-(2-azo-4)-resorcin (PAR), Thioharnstoff und Tris-(hydroxymethyl)-amino methan // Z. anal. Chem. – 1959. – Bd. 166, № 3 - S. 186 – 189. -
Иванов В.М. Гетероциклические азотсодержащие азосоединения. – М.: Наука, 1982. – 230 с. -
Geary W.J., Bottomley F. Steric hindrance effects in the use of heterocyclic azodyesstuffs as spectrophotometric reagents // Talanta, 1967 – Vol. 14, №5 – P. 537 – 542. -
Schawarzenbach G. Organic complex forming compounds // Experientia (suppl. 5) – 1956. – P. 162 – 192. -
Korbl J.,Pribil R. Metallochromic indicators // Coll. Czech. Chem. Comms – 1957. – Vol. 22, №4 – Р. 1122 – 1129. -
Индикаторы / Под редакцией Э. Бишоп – М.: Мир, 1967 – т.1 – 380 с. -
Угай Я.А. Общая и неорганическая химия. – М.: Высшая школа, 2000. – 527 с. -
Перевощикова Н.Б., Корнев В.И. К вопросу о гидролизе ионов железа (III) в водных растворах // Вестник Удмуртского университета. – 2006. - №8. – С. 189 – 198. -
Daniele P.G., Rigano C., Sammartano S., Zelano V. Ionic strength dependence
of formation constants – XVIII. The hydrolysis of iron (III) in aqueous KNO3 solutions // Talanta, 1994. – Vol. 41, № 9. – Р. 1577 – 1582.
-
Перевощикова Н.Б., Корнев В.И. комплексные соединения железа(III) с нитрилотриуксусной и дикарбоновыми кислотами в водных растворах // Координационная химия, 1999. – Т. 25, № 11. – С. 829 – 834. -
Колосов И.В., Инцкирвели Л.Н., Варшал Г.М. Изучение гидролиза железа(III) методом ионного обмена // Журн. неорг. химии, 1975. – Т. 20, № 8. – С. 2121 – 2128. -
Якубов Х.М., Щербакова В.Е., Костромина Н.А. Исследование гидролиза перхлората железа(III) методом ядерной магнитной релаксации // Журн. неорг. химии, 1982. – Т. 27, № 5. – С. 1203 – 1208. -
Перин Д. Органические аналитические реагенты. – М.: Мир, 1967. –
380 с. -
Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Ленинград.: Химия, 1991. – 432 с. -
Пешкова В.М., Савостина В.М., Иванова Е.К. Аналитические реагенты: оксимы. – М.: Наука, 1977. – 235 с. -
Умланд Ф., Янсен А. Комплексные соединения в аналитической химии: теория и практика применения. – М.: Мир, 1975. – 499 с. -
Сендэл Е.Б. Колориметрическое определение следов металлов. – Ленинград – М.: Изд-во химической литературы, 1949. – 559 с. -
Кропачева Т.Н., Пагин А.Н., Корнев В.И. Комплексообразование железа (III) с оксиэтилидендифосфоновой кислотой в водных растворах // Вестник Удмуртского университета. – 2012. - № 4. – С. 63-68. -
Коренман И.М. Органические реагенты в неорганическом анализе: справочник. – М.: Химия, 1980. – 447 с. -
Патент СССР № 4712243/26. / Пилипенко А.Т., Сафронова В.Г., Закревская Л.В. Способ определения железа в водных растворах. - Опубл. 30.01.1992, Бюл. № 4. -
Краткий справочник химика / Под ред. Б.В. Некрасова. - М.: Химия, 1957. – 448 с. -
Булатов М.И., Калинкин И.П Практическое руководство по спектрофотометрическому и фотоколориметрическому анализу. – М.:Химия, 1972. – 385 с. -
Бабко А.К. Физико-химический анализ комплексных соединений в растворах. – Киев, 1955. – 264 с. -
Зайцев О.С. Исследовательский практикум по общей химии. – М.: МГУ, 1994. – 480 с. -
Рабжаева А.Н. Реакция комплексообразования Zn с 4-(2-пиридилазо)резорцином и ее аналитические возможности. – Дипломная работа. – Улан – Удэ, 2005. – 51 с. -
ТУ 9110-002-50151448-04 «Изделия хлебобулочные с витаминами и железом от «Михалыча». -
ГОСТ 5667-65 Хлеб и хлебобулочные изделия. Правила приемки, методы отбора образцов, методы определения органолептических показателей и массы изделий.
-
ГОСТ 26929-94 Сырье и продукты пищевые. Подготовка проб. Минерализация для определения содержания токсичных элементов
-
Руководство по методам анализа качества и безопасности пищевых продуктов / под ред. И.М.Скурихина, В.А.Тутельяна. – М.: Брандес – Медицина, 1998. – 340 с. -
Приложения по метрологическому обеспечению нормативных документов на методики анализа сырья и пищевых продуктов / под ред. Н.П.Пикула. – Томск.: Томский политехнический университет, 1998. –
54 с.

