Файл: Федеральное агенство по образованию рф гоу впо бурятский государственный университет.doc
Добавлен: 27.04.2024
Просмотров: 71
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Рис. 11. Определение числа протонов (n=1)
Тангенс угла наклона прямой равен 1, т.е. число протонов, выделяющихся при комплексообразовании равно 1.
Вид иона металла, участвующего в реакции комплексообразования определяли по методу Назаренко [29]. Все расчеты проводили на основе зависимости оптической плотности от рН раствора.
П
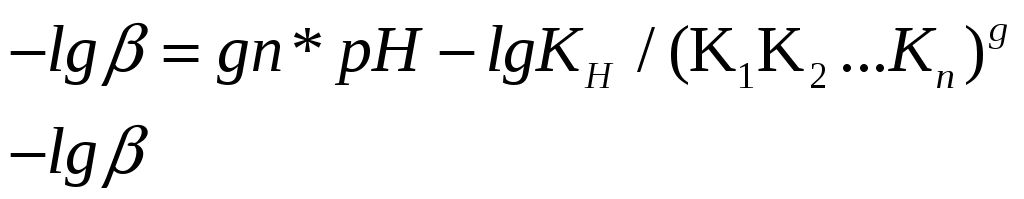 роцесс комплексообразования можно выразить химическим уравнением:
роцесс комплексообразования можно выразить химическим уравнением:- является функцией рН, характеризующей степень закомплексованности металла в зависимости от рН;
gn-угловой коэффициент прямой, равный произведению числа лигандов, координируемых ионом металла и числа ионов водорода, вытесняемых из молекулы лиганда ионом — комплексообразователем.
Величину β можно выразить через равновесные концентрации металла и реагента с учетом констант диссоциации реагента и констант гидролиза металла. Константы гидролиза для железа были вычислены из соответствующих констант диссоциации гидроксида железа (III) [21,31]:
КД1=[Fe(OH)+2][OH-]/[Fe(OH)3], КД1=4,80·10-11
КД2=[FeOH2+][OH-]/[Fe(OH)2+],КД2=1,82·10-11
КД3=[Fe3+][OH-]/[FeOH2+],КД3=1,50·10-12
Тогда, КГ1=КW/КД3, КГ1=6,70·10-3
КГ2=КW/КД2, КГ2=5,50·10-4
КГ3=КW/КД1, КГ3=2,10·10-4


Cк =
КГ1=6,70∙10-3; КГ2=5,50∙10-4; К3=4,4∙10-7; К4=7,47∙10-10; К5=1,05∙10-11 [32].
Расчетные данные представлены в таблице 8, а графическая интерпретация - на рис. 12.
Из рис.12 видно, что координирующим ионом в данном случае является Fe(OH)2+.
Далее был установлен вид иона лиганда, входящего во внутреннюю сферу комплекса. Учитывая, что при рН=9 лиганд существует в виде двух форм [H2R] и [HR-], металл вступает в реакцию в форме Fe(OH)2+, и в результате образования депротонированного комплекса из молекулы лиганда вытесняется один протон, была изучена зависимость lgCК/СFe от рН раствора и сопоставлена с изменением концентраций форм ПАР: [HR-] и [H2R].
Равновесные концентрации рассчитывались по формулам:

С0ПАР - исходная концентрация ПАР,
К1, К2, К3, К4, К5 - константы диссоциации ПАР.
Расчетные данные приведены в таблице 8, графический вариант на рис.12.
Таблица 8
Определение вида иона-комплексообразователя по методу Назаренко
рН
8,0
8,1
8,2
8,3
8,4
8,5
8,6
8,7
8,8
8,9
[H+]∙108
1
0,79
0,63
0,50
0,40
0,30
0,25
0,20
0,16
0,13
Ск*105
0,938
0,942
0,949
0,954
0,959
0,966
0,972
0,977
0,984
0,988
βFe3+
1.45*10-21
8.34*10-22
4.38*10-22
2.33*10-22
1.21*10-22
5.74*10-23
2.74*10-23
1.24*10-23
4.64*10-24
3.01*10-25
-lg βFe3+
20.84
21.08
21.34
21.63
21.92
22.24
22.56
22.91
23.33
24.50
βFeOH2+
9.23*10-16
7.04*10-16
4.66*10-16
3.12*10-16
2.04*10-16
1.22*10-16
7.31*10-17
4.16*10-17
1.96*10-17
7.08*10-18
-lg βFeOH2+
15.01
15.15
15.33
15.51
15.69
15.91
16.13
16.38
16.71
17.15
βFe(OH)2+
4.10*10-11
4.09*10-11
3.62*10-11
3.18*10-11
2.68*10-11
2.05*10-11
1.57*10-11
1.13*10-11
6.76*10-12
5.62*10-12
-lg βFe(OH)2+
10.38
10.39
10.44
10.49
10.57
10.69
10.8
10,95
11,17
11,25
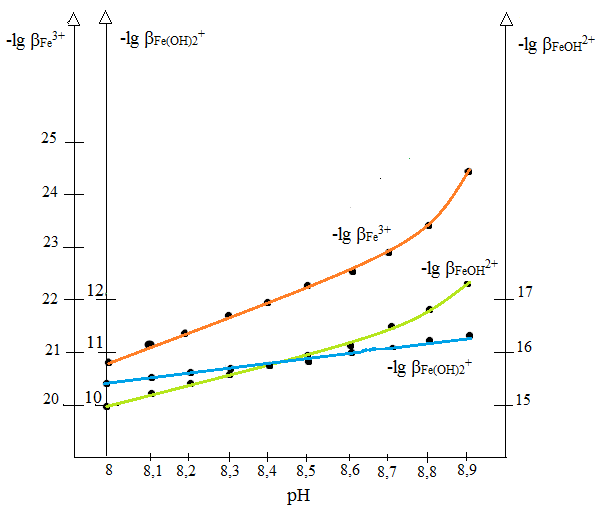
Рис. 12. Определение вида иона-комплексообразователя.
Таблица 9
Определение вида иона лиганда, входящего во внутреннюю сферу комплекса
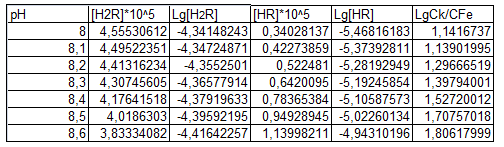
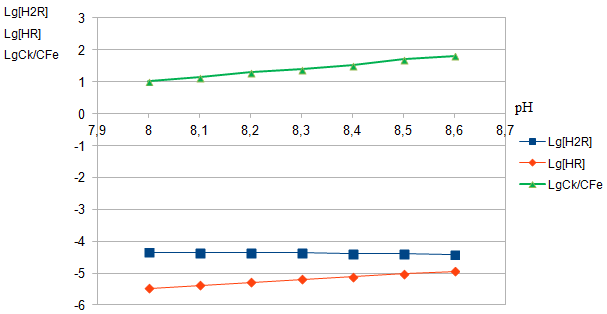
Рис. 13. Определение вида иона лиганда, входящего во внутреннюю сферу комплекса
Из рис.13 следует, что изменение lg[HR-] происходит параллельно изменению lgCК/СFe. Следовательно, во внутреннюю сферу комплексного соединения входит именно эта форма ПАР. Кроме того, построив зависимость lgCК/СFe=f(lg[HR-]), по тангенсу угла наклона прямой, находим, что число остатков лиганда во внутренней сфере равно двум, что подтверждает состав комплекса Fe(III):ПАР=1:2 (рис.14).
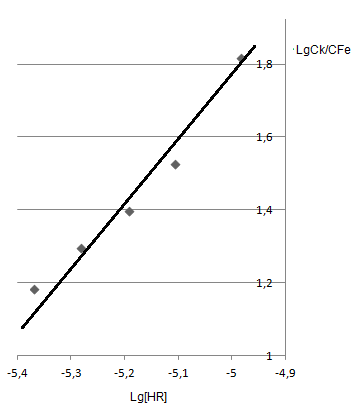
Рис.14.Определение числа остатков лиганда во внутренней сфере комплекса (n=2).
Таким образом, учитывая полученные данные было установлено, что в реакцию комплексообразования вступает гидролизованный ион железа Fe(OH)2+ связывая две молекулы ПАР (Н2R) в результате реакции из молекулы лиганда выделяется 1 протон.
На основе этих данных и учитывая что при оптимальном значении рН=9 ПАР существует в виде двух форм [H2R],[HR-] (преимущественно в форме [H2R]), можно представить следующее уравнение, описывающее процесс комплексообразования ПАР с Fe(III), в результате которого получается комплексное соединение состава 1:2
Fe(OH)2+ + 2H2R↔[Fe(OH)2(HR-)2]- + 2H+
Выражение для расчета константы устойчивости имеет вид:
Куст.=СК/СFe∙C2HR-
Данные для расчета константы устойчивости и их статистическая обработка представлены в таблице 10.
Таблица 10
Расчет константы устойчивости комплекса [Fe(OH)2(HR-)2]-
(Р=0,95, n=7, tn =2,45)
рН
8,0
8,1
8,2
8,3
8,4
8,5
8,6
Ах
0,530
0,532
0,536
0,539
0,542
0,546
0,549
Ск*105
0,938
0,942
0,949
0,954
0,959
0,966
0,972
СFe*106
0,660
0,540
0,480
0,360
0,310
0,270
0,200
[HR-]*105
0.340
0.423
0.523
0.642
0.784
0.949
1.140
lg Куст
12.089
11.989
11.859
11.808
11.702
11.599
11.573

11.803
d
0,286
0,186
0,056
0,005
0,101
0,204
0,230
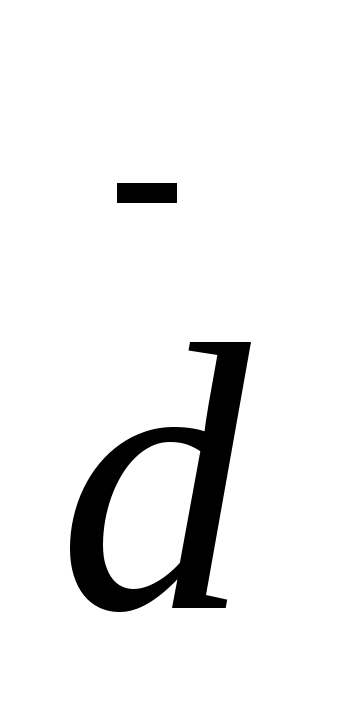
0,153
V
0,037
S
0,193
δ
0,179
μ± δ
11,803±0,179
Чувствительность изученной фотометрической реакции оценивали по величине молярного коэффициента светопоглощения (табл.11):
ε=Амах/С∙l
где Амах – оптическая плотность при полном связывании металла в комплекс;
С-концентрация комплекса;
l- толщина поглощающего слоя (1см).
Величина молярного коэффициента светопоглощения
(58900моль-1см-1л) свидетельствует о высокой чувствительности аналитической реакции комплексообразования железа с ПАР.
Таблица 11
Расчет молярного коэффициента светопоглощения
(Р=0,95; n=7; f=6; tn=2,45)
| рН | 8,0 | 8,1 | 8,2 | 8,3 | 8,4 | 8,5 | 8,6 | 8,7 | 8,8 | 8,9 |
| [H+]∙108 | 1 | 0,79 | 0,63 | 0,50 | 0,40 | 0,30 | 0,25 | 0,20 | 0,16 | 0,13 |
| Ск*105 | 0,938 | 0,942 | 0,949 | 0,954 | 0,959 | 0,966 | 0,972 | 0,977 | 0,984 | 0,988 |
| βFe3+ | 1.45*10-21 | 8.34*10-22 | 4.38*10-22 | 2.33*10-22 | 1.21*10-22 | 5.74*10-23 | 2.74*10-23 | 1.24*10-23 | 4.64*10-24 | 3.01*10-25 |
| -lg βFe3+ | 20.84 | 21.08 | 21.34 | 21.63 | 21.92 | 22.24 | 22.56 | 22.91 | 23.33 | 24.50 |
| βFeOH2+ | 9.23*10-16 | 7.04*10-16 | 4.66*10-16 | 3.12*10-16 | 2.04*10-16 | 1.22*10-16 | 7.31*10-17 | 4.16*10-17 | 1.96*10-17 | 7.08*10-18 |
| -lg βFeOH2+ | 15.01 | 15.15 | 15.33 | 15.51 | 15.69 | 15.91 | 16.13 | 16.38 | 16.71 | 17.15 |
| βFe(OH)2+ | 4.10*10-11 | 4.09*10-11 | 3.62*10-11 | 3.18*10-11 | 2.68*10-11 | 2.05*10-11 | 1.57*10-11 | 1.13*10-11 | 6.76*10-12 | 5.62*10-12 |
| -lg βFe(OH)2+ | 10.38 | 10.39 | 10.44 | 10.49 | 10.57 | 10.69 | 10.8 | 10,95 | 11,17 | 11,25 |
| рН | 8,0 | 8,1 | 8,2 | 8,3 | 8,4 | 8,5 | 8,6 |
| Ах | 0,530 | 0,532 | 0,536 | 0,539 | 0,542 | 0,546 | 0,549 |
| Ск*105 | 0,938 | 0,942 | 0,949 | 0,954 | 0,959 | 0,966 | 0,972 |
| СFe*106 | 0,660 | 0,540 | 0,480 | 0,360 | 0,310 | 0,270 | 0,200 |
| [HR-]*105 | 0.340 | 0.423 | 0.523 | 0.642 | 0.784 | 0.949 | 1.140 |
| lg Куст | 12.089 | 11.989 | 11.859 | 11.808 | 11.702 | 11.599 | 11.573 |
| | 11.803 | ||||||
| d | 0,286 | 0,186 | 0,056 | 0,005 | 0,101 | 0,204 | 0,230 |
| | 0,153 | ||||||
| V | 0,037 | ||||||
| S | 0,193 | ||||||
| δ | 0,179 | ||||||
| μ± δ | 11,803±0,179 | ||||||
| рН | Cк∙105 | А | ε∙10 -5 | | d∙10 -5 | 10 -5 | V∙ 10 -11 | S∙ 10 -5 | δ∙ 10 -5 | ( 10 -5 |
| 8,0 | 0,938 | 0,530 | 0,605 | 0,589 | 0,016 | 0,008 | 0,001 | 0,01 | 0,009 | 0,589± 0,009 |
| 8,1 | 0,942 | 0,532 | 0,597 | 0,008 | ||||||
| 8,2 | 0,949 | 0,536 | 0,593 | 0,004 | ||||||
| 8,3 | 0,954 | 0,539 | 0,586 | 0,003 | ||||||
| 8,4 | 0,959 | 0,542 | 0,582 | 0,007 | ||||||
| 8,5 | 0,966 | 0,546 | 0,581 | 0,008 | ||||||
| 8,6 | 0,972 | 0,549 | 0,577 | 0,012 |
Влияние посторонних ионов на аналитические характеристики реакции ПАР с Fe(III) рассматривали с учетом тех ионов, которые могут сопутствовать железу в пищевых продуктах и для которых известны цветные реакции с ПАР (табл.12).
Таблица 12
Влияние посторонних ионов на реакцию комплексообразования железа(III) с ПАР (Fe:ион=1:Х )
| Ион | Zn2+ | Cu2+ | Cd2+ | Pb2+ | Со2+ | Ni2+ | Mn2+ |
| Х | - | - | 25 | 10 | - | - | - |
| ПДК, мг/кг | 35,0 | 7,0 | 0,07 | 0,35 | - | - | - |
Влияния ионов цинка, меди, кобальта, никеля и марганца не отмечено, хотя в литературе имеются сведения о их взаимодействии с ПАР. Это связано с тем, что с данными металлами ПАР образует комплексные соединения в кислой среде ( рН менее 5). Оптимальным рН комплексообразования железа с ПАР является рН=9, при котором комплексы указанных металлов разрушаются. Влиянием кадмия и свинца можно пренебречь, поскольку данная фотометрическая реакция рассматривается с целью практического применения для анализа пищевых продуктов, а в большинстве пищевых продуктов содержание железа значительно превышает содержание данных компонентов.
2.3. Фотометрическое определение Fe(III) в пищевых продуктах
Железо это жизненно – важный для человека микроэлемент, который участвует в процессах кроветворения, внутриклеточного обмена и регулирования окислительно-восстановительных процессов. Поэтому необходимо обеспечивать поступление этого элемента в организм человека в т.ч. использование комплексных препаратов поливитаминов с микроэлементами( в условиях обычного умеренного климата здоровому человеку необходимо 11-30 мг Fe в день). Кроме того, имеется ряд продуктов лечебного и лечебно-профилактичекого назначения
, в состав которых входят различные добавки, содержащие железо.
Хлеб «Флагман» («Бурятхлебпром») хорошо зарекомендовал себя как продукт профилактического назначения. Изготовляется хлеб по ТУ 9110-002-50151448-04 «Изделия хлебобулочные с витаминами и железом от «Михалыча» [33]. В состав этого продукта входит одноименная добавка- «Флагман»: по нормативным документам содержание железа составляет 2,41-3,20мг/100г.
Отбор проб для последующего определения железа производился непосредственно перед анализом по ГОСТ 5667[34].
Подготовка к анализу
Процедура отбора состояла в отделении мякиша от корки с последующим его измельчением и квартованием. Взвешивали две навески по 10 г крошки исследуемого образца хлеба и количественно переносили в чашки для озоления. Чашки помещали на электрическую плиту и обугливали в течении 1-2 часов, периодически перемешивая. После озоления на плитке, чашки помещали в муфель, предварительно разогретый до 2500С и через каждые 20мин повышали температуру на 500С до 4500С (1ч20мин). Выдерживали при этой температуре до получения серой золы в течение 2-3часов. Затем навески вынимали и охлаждали до комнатной температуры. Сухой остаток обрабатывали несколькими капелями HNO3 (к.) и прокаливали на плитке досуха. Операции озоления в муфеле повторяли до получения бело-серой золы без черных вкраплений.
После охлаждения, золу растворяли в 2-5 см3 HCl (1:1) и количественно переносили в мерные колбы (Vк=50см3) (не доводя дистиллированной водой до метки). Далее раствором NH4OH (0,1н) устанавливали рН 5,0 (контроль по универсальной индикаторной бумаге). После этого дистиллированной водой растворы доводили до метки и проводили спектрофотометрическое определение железа.
Построение градуировочного графика.
В сухие конические колбы (Vк=50см3) вносили 0,5 1,0 2,0 3,0 4,0 5,0 см3 стандартного раствора соли железа (СFe2(SO4)3(NH4)2SO4*24H2O = 5,0∙10-4М). Добавляли в каждую колбу по 5,0см3 раствора ПАР (СПАР=1,0∙10-3М), 2,5см3 боратногобуферного раствора (рН=9,0) и доводили до метки дистиллированной водой.
Измерение оптической плотности проводили на фоне раствора ПАР V=5см3 (СПАР=1,0∙10-3М, рН=9,0) при λ=540нм и l=1cм. Строили график А=f(a

