Файл: Федеральное агенство по образованию рф гоу впо бурятский государственный университет.doc
Добавлен: 27.04.2024
Просмотров: 69
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РФ
ГОУ ВПО «БУРЯТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Химический факультет
Кафедра неорганической и органической химии
УДК 542.951
Д 685
ДОРЖИЕВА АЛЬБИНА БАИРОВНА
КОМПЛЕКСООБРАЗОВАНИЕ В СИСТЕМЕ:
Fe (III) – ПИРИДИЛАЗОРЕЗОРЦИН
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
Научный руководитель:
канд.хим.наук
_________Л.Н.Корсун
Работа допущена к защите
«_____»________________2015 г.
Зав.каф.неорганической и
органической химии
________________________
Улан-Удэ
2015
ОГЛАВЛЕНИЕ
Стр
ВВЕДЕНИЕ 3
ГЛАВА I. Органические реагенты в аналитической химии. 5
1.1.Гетероциклические азосоединения как металлоиндикаторы. 5
1.2.Комплексные соединения железа (III) 10
1.2.1.Комплексы с неорганическими лигандами 10
1.2.2.Комплексы с органическими лигандами 13
Глава II. Комплексообразование в системе: Fe(III) – пиридилазорезорцин 16
2.1. Спектрофотометрическое исследование аналитических характеристик пиридилазорезорцина 17
2.2. Исследование реакции комплексообразования железа с ПАР 21
2.3. Фотометрическое определение Fe(III) в пищевых продуктах 35
ВЫВОДЫ 41
СПИСОК ЛИТЕРАТУРЫ 42
34.ГОСТ 5667-65 Хлеб и хлебобулочные изделия. Правила приемки, методы отбора образцов, методы определения органолептических показателей и массы изделий. 44
35.ГОСТ 26929-94 Сырье и продукты пищевые. Подготовка проб. Минерализация для определения содержания токсичных элементов 44
ВВЕДЕНИЕ
Одним из сильнейших по действию и наиболее распространенным химическим загрязнением объектов окружающей среды является загрязнение тяжелыми металлами. Тяжелые металлы обладают высокой способностью к многообразным химическим, физико-химическим и биологическим реакциям. Многие из них имеют переменную валентность и участвуют в окислительно-восстановительных процессах. Кроме этого, их соединения способны перемещаться и перераспределяться в объектах окружающей среды, т.е. мигрировать, что приводит к изменению их содержания во вторичных объектах – продовольственном сырье и пищевых продуктах [1]. По требованиям Всемирной организации здравоохранения в пищевых продуктах и продовольственном сырье регламентируется содержание 8 элементов (Hg, Cd, Pb, Cu, Fe, Zn, Sr, As).
Среди них с точки зрения санитарных норм, особое место занимает железо, которое в организме человека выполняет ряд жизненно-важных функций: дефицит железа вызывает анемию, избыточное содержание может вызвать состояние шока и способствовать развитию хронической интоксикации [2]. В связи с этим необходим постоянный контроль за содержанием этого элемента в пищевой продукции. Это определяет актуальность и практическую направленность дипломной работы.
Для определения железа в различных объектах, в том числе и в пищевых продуктах, наиболее часто применяются оптические методы, в частности, спектрофотометрические и фотометрические, позволяющие сократить до минимума время анализа при обеспечении необходимой точности результатов [3].
В качестве чувствительных фотометрических реагентов для определения железа используются органические реагенты, в том числе, гетероциклические азосоединения, к которым и относится рассматриваемый в работе ПАР (4-(2-пиридилазо)резорцин). В литературе есть данные о применении ПАР в качестве индикатора на ионы Fe3+, поскольку при взаимодействии Fe(III) c ПАР образуется окрашенное соединение. Однако, нет информации о характеристиках образующегося окрашенного соединения, условиях его образования, устойчивости, аналитических возможностях этой реакции. Новизна дипломной работы заключается в определении недостающих характеристик и выяснении возможности аналитического использования фотометрической реакции взаимодействия железа с ПАР.
Цель работы - фотометрическое исследование реакции комплексообразования Fe(III) c пиридилазорезорцином с точки зрения применимости ее для обнаружения железа в пищевой продукции.
Задачи исследования:
-
Рассмотреть литературные данные о взаимодействии ионов Fe3+ с неорганическими и органическими лигандами; -
Установить основные характеристики органического реагента (Кд, распределение долей форм ПАР в зависимости от рН); -
Определить оптимальные условия комплексообразования Fe(III) с ПАР, состав комплекса, установить формы металла - комплексообразователя и лиганда образующих комплексное соединение, оценить устойчивость комплекса, чувствительность реакции; -
Выяснить возможность фотометрического определения железа с ПАР в реальном объекте.
ГЛАВА I. Органические реагенты в аналитической химии.
-
Гетероциклические азосоединения как металлоиндикаторы.
Азооксисоединения являются органическими реагентами успешно используемыми в аналитической химии. Однако большинство этих реагентов координирует ионы металлов за счет оксигрупп поэтому их селективность снижена. Введение в молекулу реагентов гетероатомов (азота, кислорода, серы), которые избирательно координируют ионы металлов, значительно повышает их селективность.
Первыми гетероциклическими азосоединениями,которые использовались для определения ионов металлов, были реагенты, содержащие в своей структуре группу:
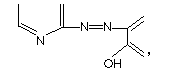
где диазосоставляющей компонентой является азотсодержащий гетероцикл, а азосоставляющей являются различные фенолы и нафтолы с оксигруппой в орто-положении.
Впервые пиридиновые азосоединения как родоначальники гетероциклических азосоединений были получены Чичибабиным с сотрудниками в 1918 г. [4,5]. Однако они долгое время не находили практического применения. В 1951 г. Лью [6] исследовал реакции 1-(2-пиридилазо)-2-нафтола (ПАН-2) с рядом ионов металлов. Первая публикация о возможности использования ПАН-2 как комплексонометрического индикатора принадлежит Ченгу и Брею [7], а в 1957 г. Вебер [8] сообщил об аналогичных возможностях 4-(2-пиридилазо)резорцина. Позже в качестве комплексонометрических индикаторов стали использовать и другие гетероциклические азосоединения.
В настоящее время известно около 15 аминов гетероциклического ряда, используемых в качестве диазосоставляющих, и около 30 соединений (в основном оксипроизводные бензола, нафталина, хинолина), используемых в качестве азосоставляющих.
Все реагенты поглощают свет в видимой области спектра. Изменение ионного состояния реагентов резорцинового ряда приводит к сдвигу полосы максимального поглощения в длинноволновую область при переходе от молекулярных форм к катионным, а также батохромным сдвигом при переходе от молекулярных форм к однократно диссоциированным и далее к двукратно диссоциированным. При этом положение максимумов светопоглощения смещается на 30-100 нм.
Положения максимумов светопоглощения и их молярные коэффициенты погашения для различных форм гетероциклических азосоединений приведены в таблице 1[9].
Таблица 1
Спектрофотометрические характеристики гетероциклических азосоединений
| Реагент | Среда (µ) | λмакс ,нм (ε*10-4) | |||
| Hn+1R+ | HnR | Hn-1R- | R2- | ||
| АНАДЭАФ | 20 об.% этанола | 600(1,54) | 460(3,94) | 470(3,86) | |
| АНАК | То же | 590(4,47) | 450(3,40) | 470(3,00) | |
| КТРАДЭАФ | | 430 | 440-475 | 480 | |
| ТЕТРАН-2 | | 520(1,13) | 400(1,15) | 460(1,27) | 490(1,13) |
| ТЕТРА | | | 400(1,13) | 460(2,36) | |
| ПАР | Вода » » | 420(1,48) 395(1,55) 395 | 392(1,52) 383(1,57) 385 | 414(2,31) 415(2,89) 413 | 502(1,78) 485(1,73) 490 |
| 3-ПАР | » (0,1) | | | 420 | 480 |
| 3-СН3-ПАР | » | 407(0,63) | 407(0,61) | 425(0,80) | 492(0,50) |
| 4-СН3-ПАР | » (0,1) » | 400(1,19) | 392(1,14) | 415 417(1,72) | 490 490(1,49) |
| 5-СН3-ПАР | » (0,1) » | 420(1,31) | 390(1,37) | 415 420(2,22) | 490 490(1,50) |
| 6-СН3-ПАР | » | 408(0,94) | 397(0,85) | 416(1,28) | 487(0,91) |
| 5-Br-ПАР | » (0,1) » | 450 | 390 | 420 420 | 500 510 |
Как видно из табл.1 стерические препятствия, которые возникают при введении заместителей в диазосоставляющую, приводят к понижению значений молярных коэффициентов, что можно проследить на примере метильных производных ПАР [10].

