Файл: Методические указания для выполнения лабораторных работ для студентов бакалавриата направлений 21. 03. 01 Нефтегазовое дело.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 253
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2 Определение теплоты диссоциации слабой кислоты
Электропроводность растворов электролитов
Термодинамика электрохимических систем
Строение вещества. Молекулярные спектры
Поверхностные явления. Сорбция
Лабораторная работа № 8. Исследование кинетики молекулярной адсорбции
Лабораторная работа № 9. Исследование обменной адсорбции ионов
Лабораторная работа № 10. Исследование кинетики ионообменной адсорбции
Устойчивость дисперсных систем
Лабораторная работа № 11. Изучение коагуляции гидрозоля железа
, 1,92 Дж/см3К, VHg – объем баллона термометра, содержащего ртуть, мл; Cст – удельная теплоемкость стекла, 0,79 дж/гК; m – общая масса стеклянных частей калориметрической установки, г.
5. Для каждой концентрации кислоты вычислить тепловой эффект процессов нейтрализации и диссоциации по уравнению:
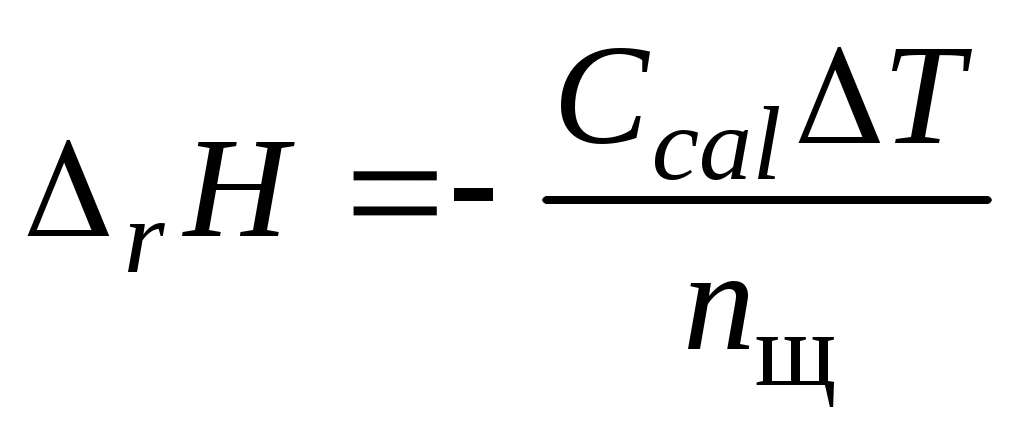 , Дж/моль,
, Дж/моль,
где nщ – количество вещества щелочи в пипетке, моль,
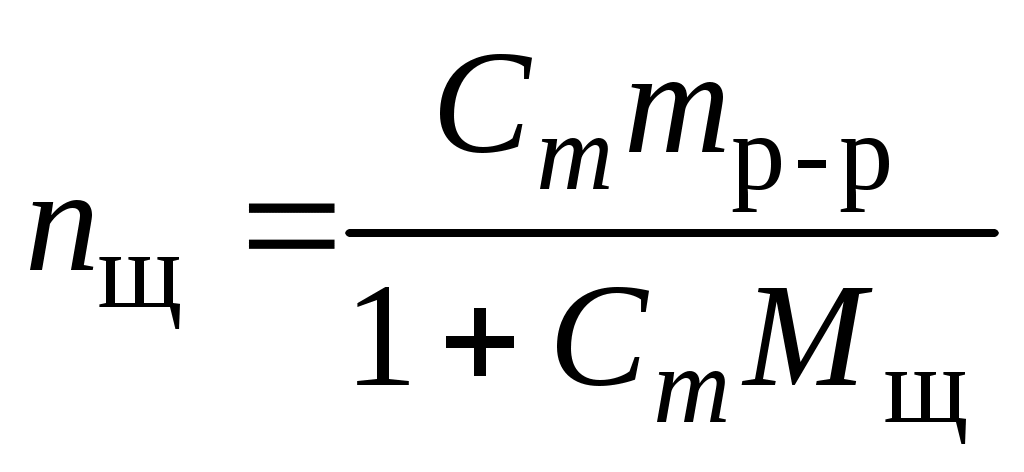 ,
,
где Сm – моляльная концентрация раствора щелочи (KOH или NaOH), моль/кг;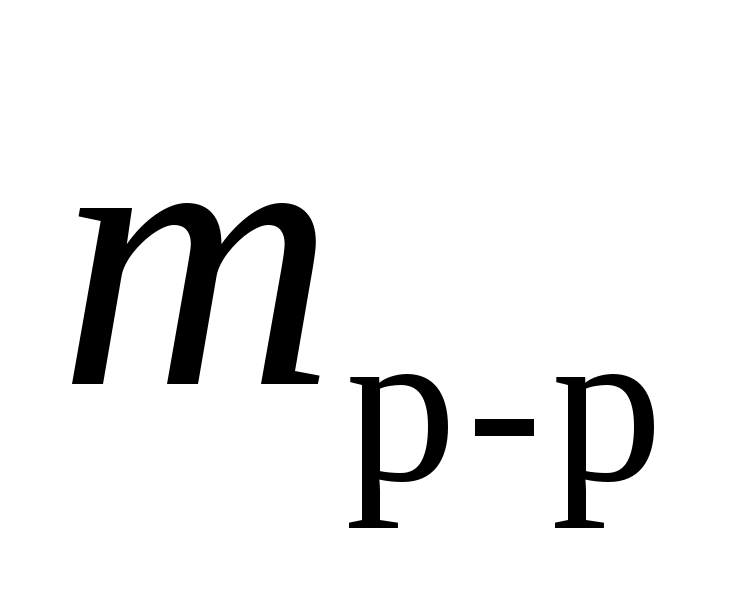 – масса раствора щелочи, кг; Мщ – молярная масса щелочи, кг/моль.
– масса раствора щелочи, кг; Мщ – молярная масса щелочи, кг/моль.
6. Пользуясь справочными данными рассчитать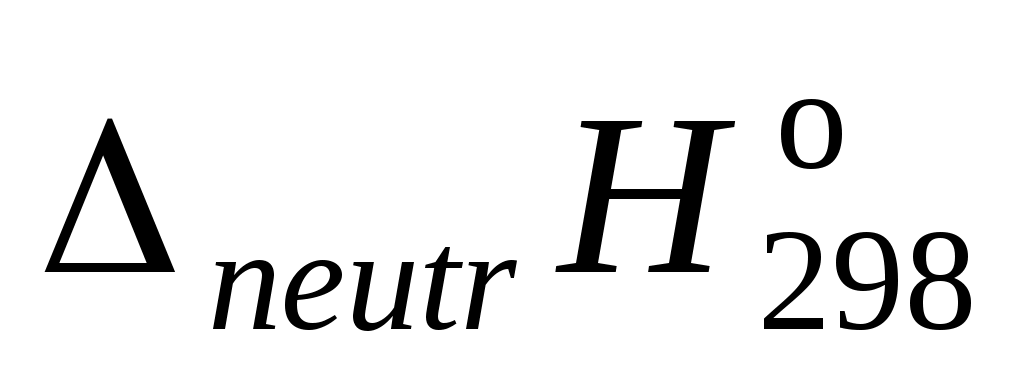 реакции нейтрализации
реакции нейтрализации
Н+ + ОН = Н2О.
7. Для каждой концентрации кислоты вычислить изменение энтальпии диссоциации по уравнению:
dissH = rH neutrH.
8. Усреднить значения теплового эффекта реакции диссоциации по двум параллельным опытам.
9. Оценить относительную инструментальную ошибку:
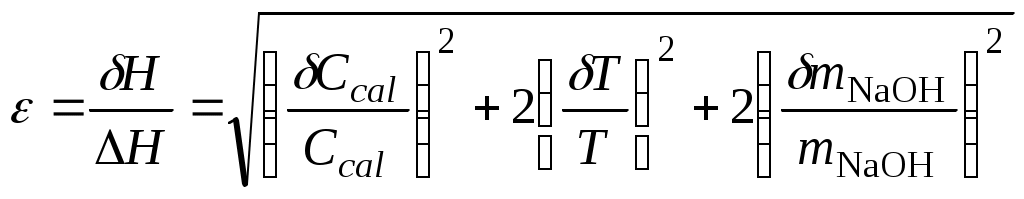 .
.
Относительную погрешность расчетного определения теплоемкости системы обычно принимают равной 3 %; погрешность определения температуры определяется ценой деления термометра Бекмана (0,005°Б), массы – технической характеристикой весов (0,01 г).
обычно принимают равной 3 %; погрешность определения температуры определяется ценой деления термометра Бекмана (0,005°Б), массы – технической характеристикой весов (0,01 г).
10. Рассчитать абсолютную погрешность измерения теплового эффекта. Ответ записать по форме: .
.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Электропроводность растворов обусловлена подвижностью ионов, образующихся при диссоциации электролитов в полярных растворителях. Электропроводность растворов электролитов зависит от многих факторов: природы электролита, природы растворителя, концентрации раствора, температуры и др.
Электропроводностью называется величина, обратная сопротивлению:
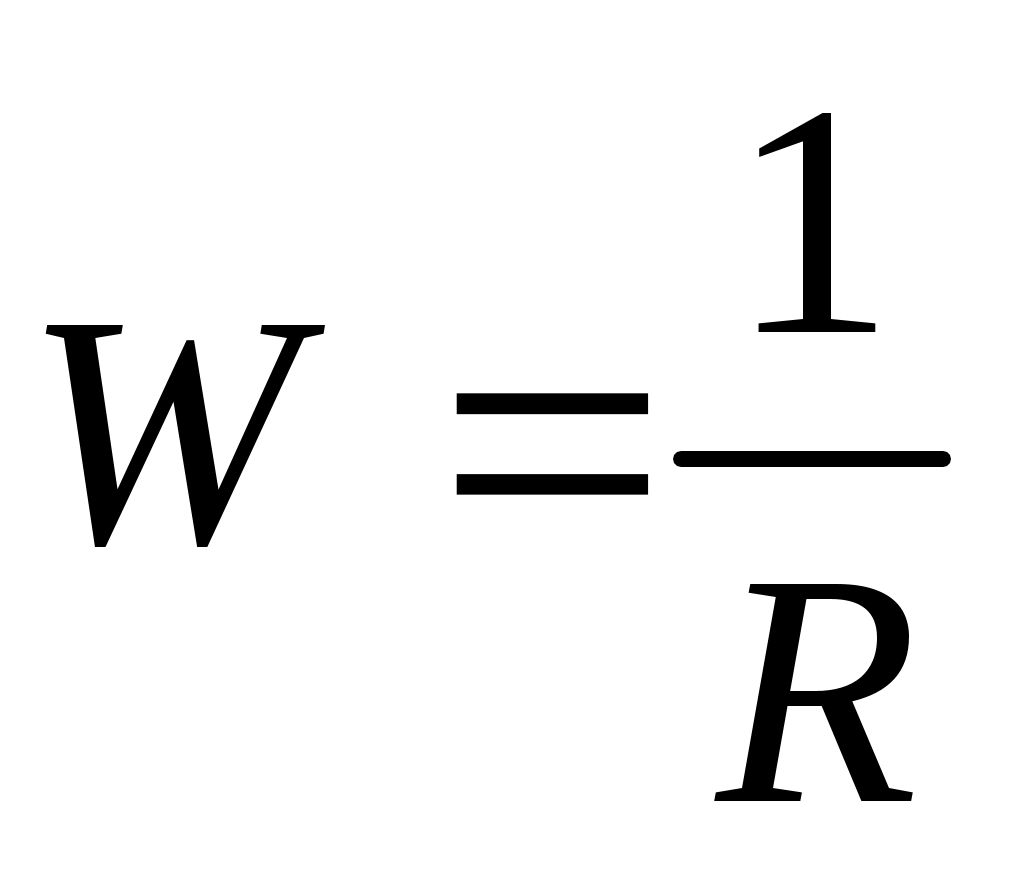 ,
,
где R – сопротивление раствора, Ом; W – электропроводность раствора, Ом−1 или См (сименс).
В кондуктометрии используют удельную и эквивалентную электропроводность
Удельная электропроводность представляет собой величину, обратную удельному сопротивлению:
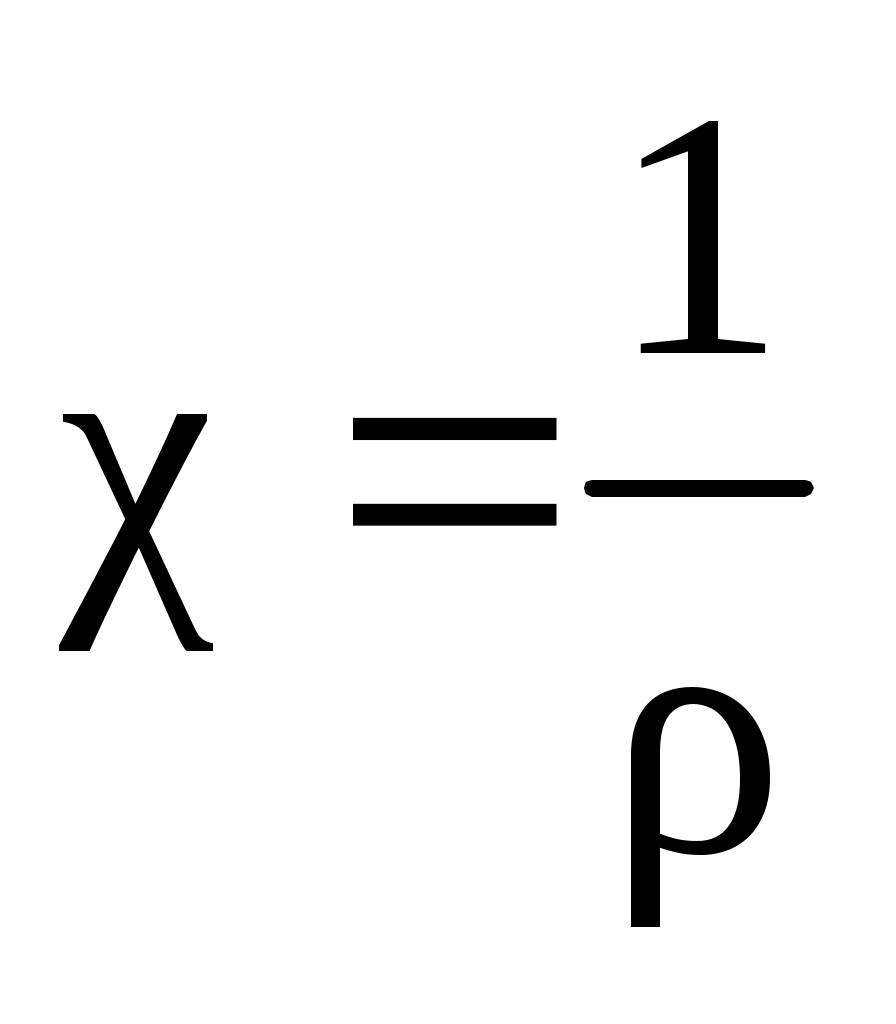 .
.
Повышение температуры на 1 К увеличивает удельную электропроводность примерно на 2 – 2,5 %. Это объясняется уменьшением вязкости раствора и уменьшением гидратации ионов, а для растворов слабых электролитов – увеличением степени диссоциации.
Эквивалентная электропроводность:
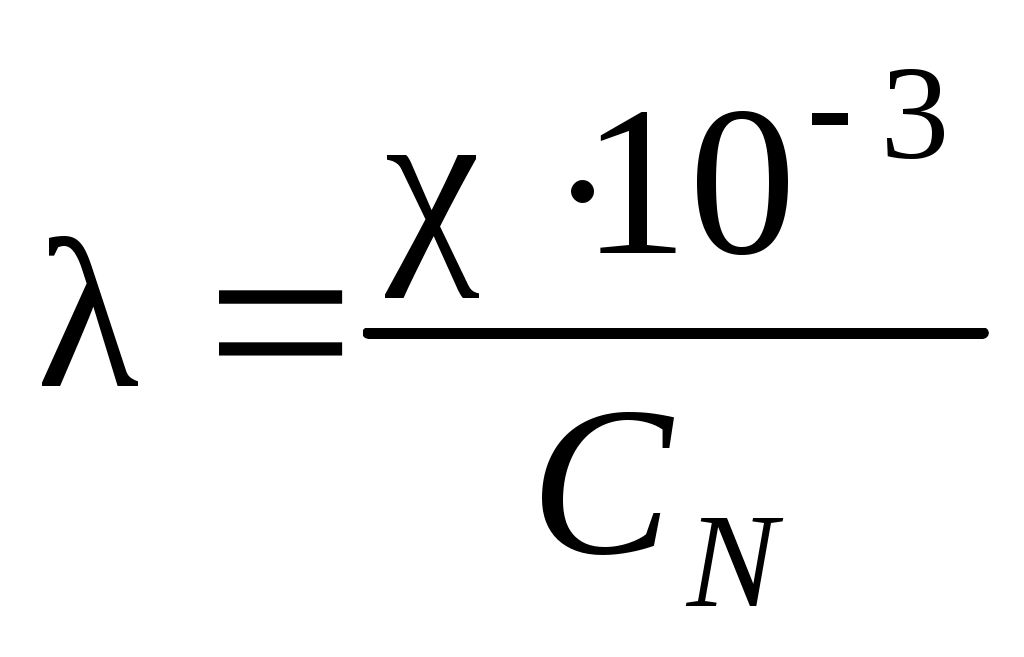 ,
,
где СN – нормальная концентрация электролита, экв/л. Единицы измерения удельной электропроводности соответственно См·м2·экв−1.
Перенос электричества в растворах электролитов осуществляется ионами и электропроводность раствора зависит от подвижности ионов. Подвижностью иона называют скорость движения данного иона в электрическом поле при разности потенциалов 1 В.
Взаимосвязь подвижности и удельной электропроводности описывает уравнение:
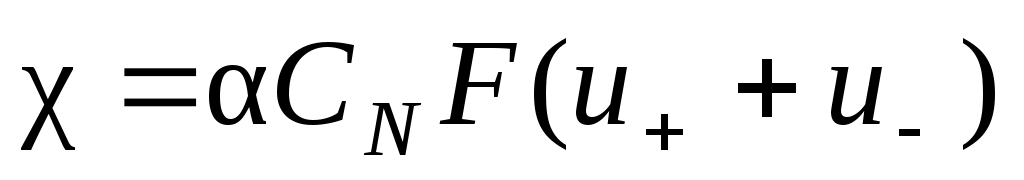 ,
,
где – степень диссоциации электролита (для разбавленных растворов сильных электролитов = 1); СN – нормальная концентрация электролита, экв/м3; F – число Фарадея; u+ и u– - подвижности катиона и аниона соответственно.
Эквивалентная электропроводность связана с подвижностью иона выражением:
i = Fui , ()
где i – удельная электропроводность катиона либо аниона; ui – подвижность катиона либо аниона.
Эквивалентная электропроводность раствора определяется уравнением:
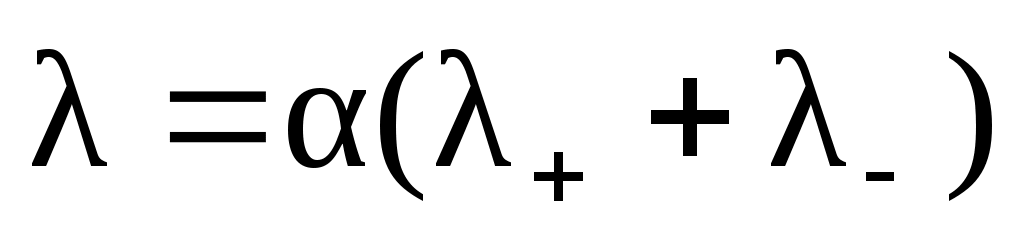 .
.
При бесконечно большом разбавлении степень диссоциации → 1 и эквивалентная электропроводность стремится к наибольшему значению ∞. В этом случае:
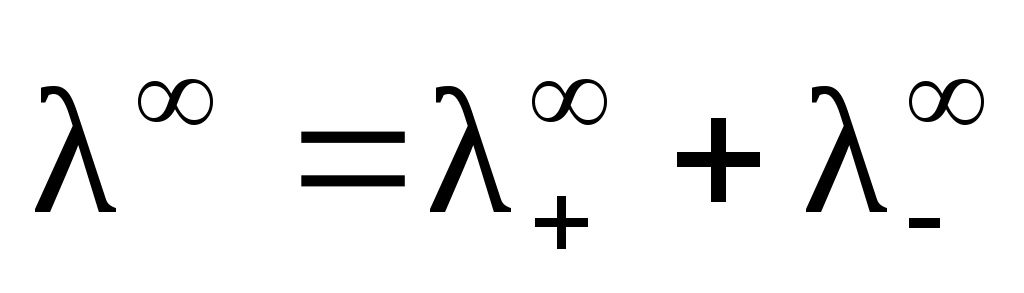
предельная эквивалентная электропроводность равна сумме предельных эквивалентных электропроводностей ионов при бесконечном разбавлении (закон Кольрауша). Предельные эквивалентные электропроводности ионов являются справочными величинами.
Отношение эквивалентной электропроводности раствора сильного электролита к ее предельному значению ∞ называют коэффициентом электропроводности или «кажущейся степенью диссоциации».
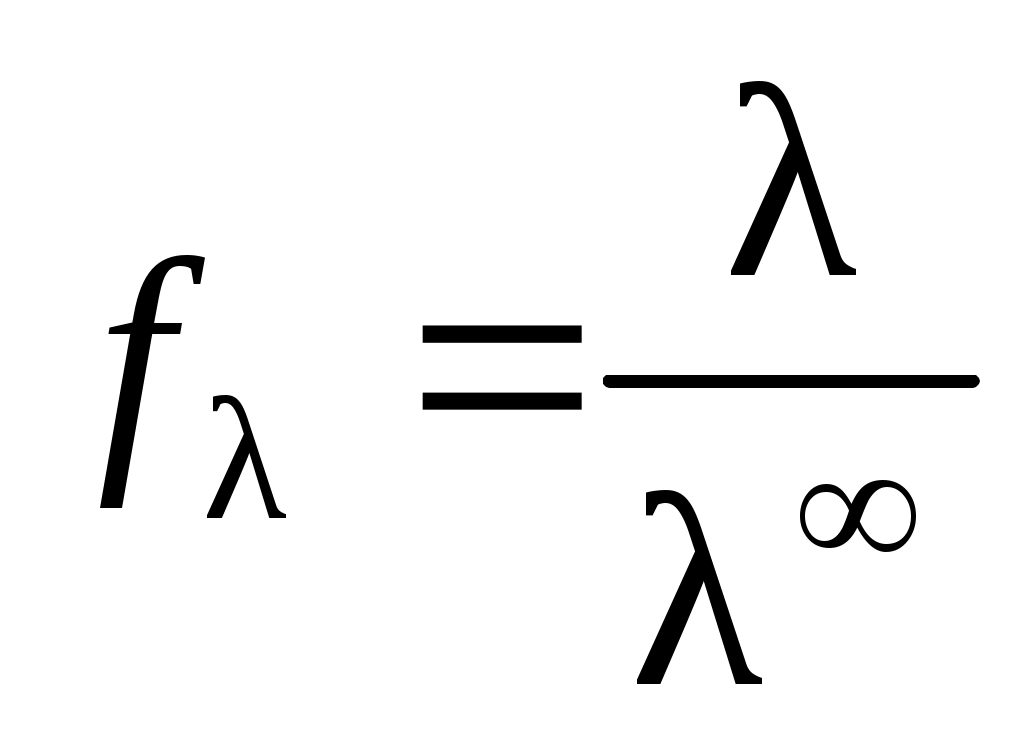 .
.
Отношение эквивалентной электропроводности раствора слабого электролита к ее предельному значению ∞ представляет собой степень диссоциации:
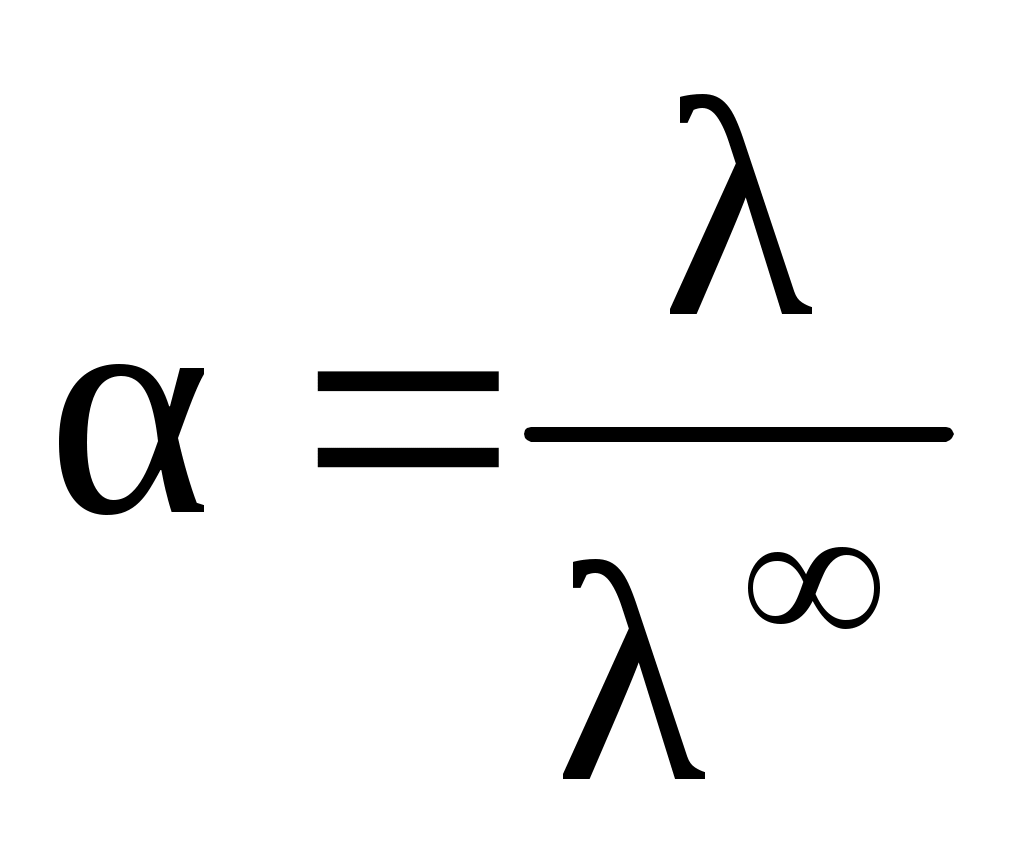 .
.
В случае сильного электролита = 1. Изменение эквивалентной электропроводности с концентрацией обусловлено коэффициентом электропроводности f, т.е. влиянием электростатического взаимодействия ионов на скорость их движения. Уменьшение эквивалентной электропроводности растворов сильных электролитов с ростом концентрации объясняется торможением движения ионов в электрическом поле – с увеличением концентрации раствора ионы сближаются и электростатическое взаимодействие между ними возрастает.
Для растворов слабых электролитов эквивалентная электропроводность зависит от концентрации электролита из-за изменения степени диссоциации. С увеличением концентрации электролита степень диссоциации уменьшается и это приводит к уменьшению эквивалентной электропроводности.
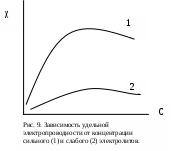
В разбавленных растворах удельная электропроводность увеличивается почти пропорционально концентрации. В более концентрированных растворах f уменьшается, что приводит к снижению электропроводности (рис. 9).
Величина удельной электропроводности в растворах слабых электролитов пропорциональна произведению α
С. При небольших концентрациях это произведение увеличивается с ростом концентрации, и удельная электропроводность растет. Однако при дальнейшем увеличении концентрации это произведение уменьшается из-за снижения степени диссоциации, вследствие чего удельная электропроводность слабых электролитов, как и сильных, после достижения максимального значения снижается (рис. 9).
Для оценки участия данного вида ионов в переносе электричества *.Гитторфом было введено понятие числа переноса иона. Число переноса иона – это отношение количества электричества, перенесенное данным видом ионов qi к общему количеству электричества qобщ, перенесенному всеми видами ионов:
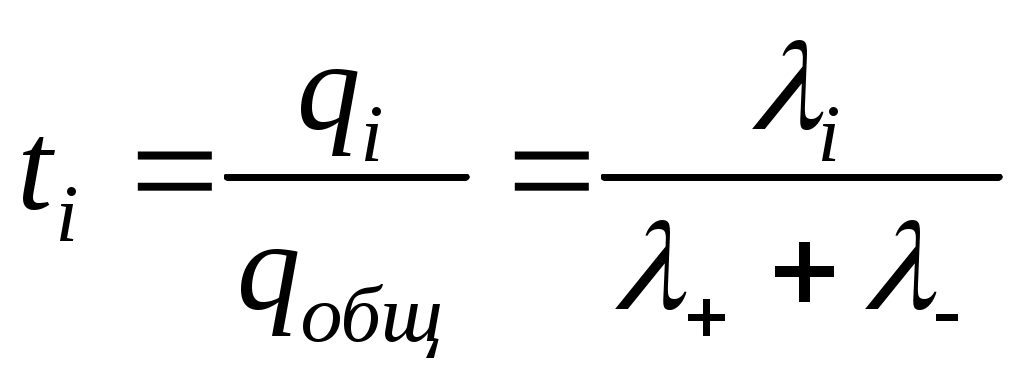 .
.
Число переноса зависит от природы не только данного иона, но и противоиона. Сумма чисел переноса всех видов ионов в растворе равна единице.
При протекании электрического тока через раствор в приэлектродном пространстве происходит изменение концентрации электролита вследствие движения ионов в электрическом поле и участия ионов в электродных процессах. Допустим, что через раствор электролита MeAn, в котором Mez+ – катион металла, Anz− – кислотный остаток бескислородной кислоты, проходит некоторое количество электричества q. На катоде происходит восстановление катионов металлов: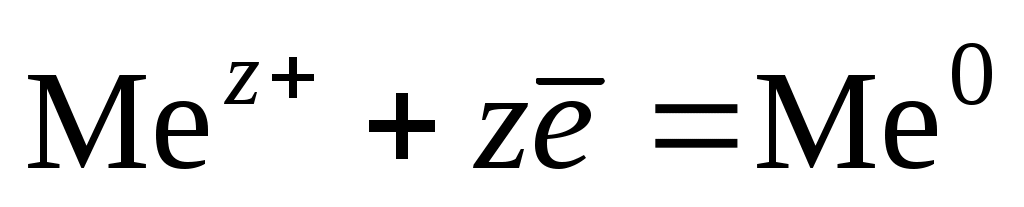 . Изменение концентрации Меz+ в катодном пространстве
. Изменение концентрации Меz+ в катодном пространстве 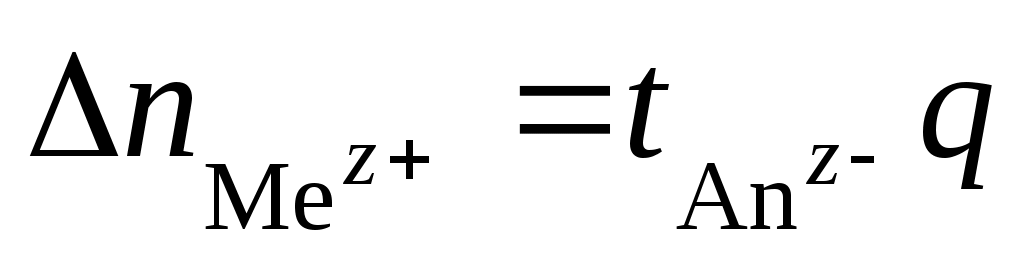 . На аноде протекает процесс окисления анионов:
. На аноде протекает процесс окисления анионов: 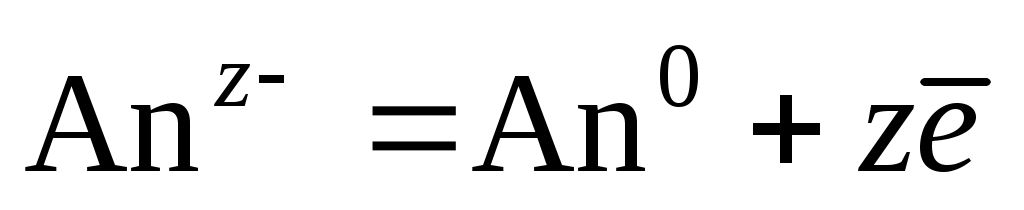 . Изменение содержания электролита в анодном пространстве:
. Изменение содержания электролита в анодном пространстве: 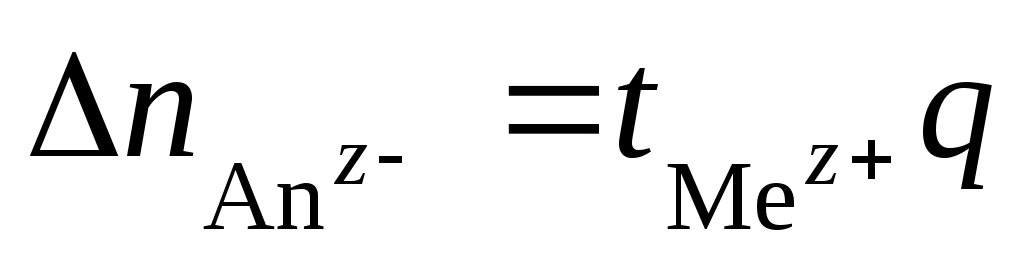 .
.
Число переноса иона любого знака равно отношению убыли электролита у электрода противоположного иону знака к количеству разложенного электролита:
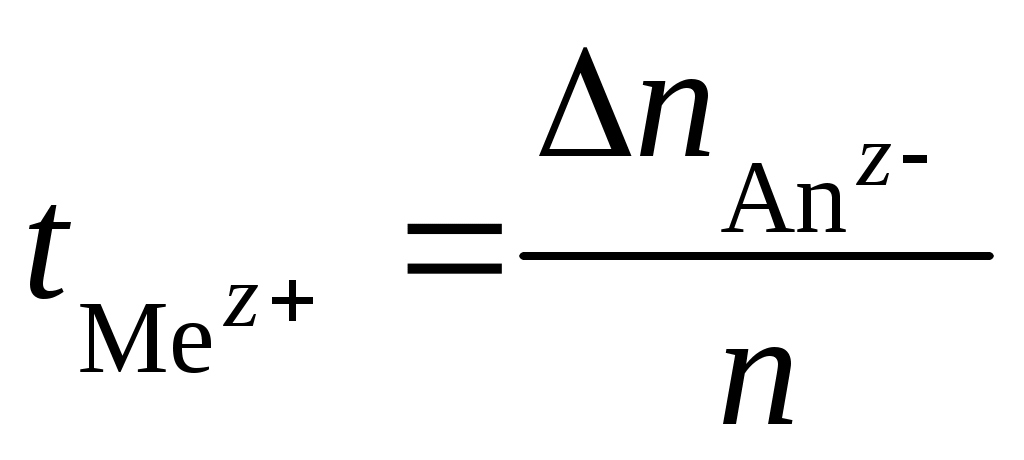 ;
; 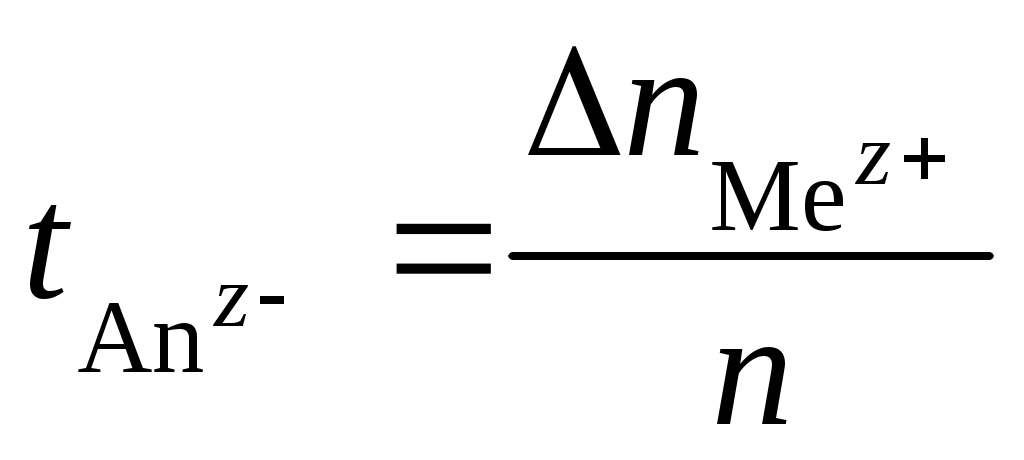 .
.
1. Чем обусловлена электропроводность растворов электролитов?
2. Что такое удельная электропроводность?
3. Как связана удельная электропроводность с молярной и эквивалентной электропроводностями?
4. Что такое подвижность иона?
5. Как зависит величина удельной электропроводности от подвижности иона?
6. Взаимосвязь эквивалентной электропроводности и подвижности иона. Закон Кольрауша.
7. Как определить степень диссоциации слабого электролита по данным электропроводности?
8. Как зависит эквивалентная электропроводность от концентрации сильного и слабого электролита?
9. Чем объясняется наличие максимума на зависимости удельной электропроводности от концентрации сильного и слабого электролита?
5. Для каждой концентрации кислоты вычислить тепловой эффект процессов нейтрализации и диссоциации по уравнению:
где nщ – количество вещества щелочи в пипетке, моль,
где Сm – моляльная концентрация раствора щелочи (KOH или NaOH), моль/кг;
6. Пользуясь справочными данными рассчитать
Н+ + ОН = Н2О.
7. Для каждой концентрации кислоты вычислить изменение энтальпии диссоциации по уравнению:
dissH = rH neutrH.
8. Усреднить значения теплового эффекта реакции диссоциации по двум параллельным опытам.
9. Оценить относительную инструментальную ошибку:
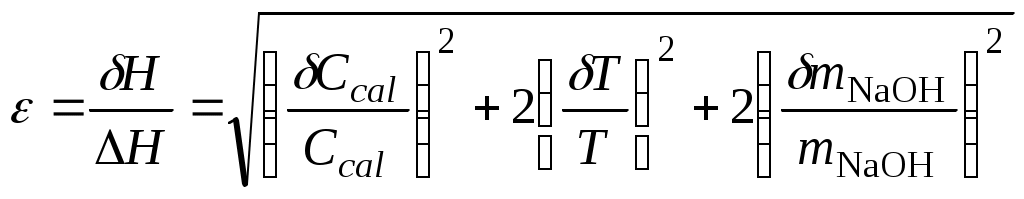 .
.Относительную погрешность расчетного определения теплоемкости системы
10. Рассчитать абсолютную погрешность измерения теплового эффекта. Ответ записать по форме:
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Электропроводность растворов электролитов
Краткие теоретические сведения
Электропроводность растворов обусловлена подвижностью ионов, образующихся при диссоциации электролитов в полярных растворителях. Электропроводность растворов электролитов зависит от многих факторов: природы электролита, природы растворителя, концентрации раствора, температуры и др.
Электропроводностью называется величина, обратная сопротивлению:
где R – сопротивление раствора, Ом; W – электропроводность раствора, Ом−1 или См (сименс).
В кондуктометрии используют удельную и эквивалентную электропроводность
Удельная электропроводность представляет собой величину, обратную удельному сопротивлению:
Повышение температуры на 1 К увеличивает удельную электропроводность примерно на 2 – 2,5 %. Это объясняется уменьшением вязкости раствора и уменьшением гидратации ионов, а для растворов слабых электролитов – увеличением степени диссоциации.
Эквивалентная электропроводность:
где СN – нормальная концентрация электролита, экв/л. Единицы измерения удельной электропроводности соответственно См·м2·экв−1.
Перенос электричества в растворах электролитов осуществляется ионами и электропроводность раствора зависит от подвижности ионов. Подвижностью иона называют скорость движения данного иона в электрическом поле при разности потенциалов 1 В.
Взаимосвязь подвижности и удельной электропроводности описывает уравнение:
где – степень диссоциации электролита (для разбавленных растворов сильных электролитов = 1); СN – нормальная концентрация электролита, экв/м3; F – число Фарадея; u+ и u– - подвижности катиона и аниона соответственно.
Эквивалентная электропроводность связана с подвижностью иона выражением:
i = Fui , ()
где i – удельная электропроводность катиона либо аниона; ui – подвижность катиона либо аниона.
Эквивалентная электропроводность раствора определяется уравнением:
При бесконечно большом разбавлении степень диссоциации → 1 и эквивалентная электропроводность стремится к наибольшему значению ∞. В этом случае:
предельная эквивалентная электропроводность равна сумме предельных эквивалентных электропроводностей ионов при бесконечном разбавлении (закон Кольрауша). Предельные эквивалентные электропроводности ионов являются справочными величинами.

Отношение эквивалентной электропроводности раствора сильного электролита к ее предельному значению ∞ называют коэффициентом электропроводности или «кажущейся степенью диссоциации».
Отношение эквивалентной электропроводности раствора слабого электролита к ее предельному значению ∞ представляет собой степень диссоциации:
В случае сильного электролита = 1. Изменение эквивалентной электропроводности с концентрацией обусловлено коэффициентом электропроводности f, т.е. влиянием электростатического взаимодействия ионов на скорость их движения. Уменьшение эквивалентной электропроводности растворов сильных электролитов с ростом концентрации объясняется торможением движения ионов в электрическом поле – с увеличением концентрации раствора ионы сближаются и электростатическое взаимодействие между ними возрастает.
Для растворов слабых электролитов эквивалентная электропроводность зависит от концентрации электролита из-за изменения степени диссоциации. С увеличением концентрации электролита степень диссоциации уменьшается и это приводит к уменьшению эквивалентной электропроводности.

В разбавленных растворах удельная электропроводность увеличивается почти пропорционально концентрации. В более концентрированных растворах f уменьшается, что приводит к снижению электропроводности (рис. 9).
Величина удельной электропроводности в растворах слабых электролитов пропорциональна произведению α
С. При небольших концентрациях это произведение увеличивается с ростом концентрации, и удельная электропроводность растет. Однако при дальнейшем увеличении концентрации это произведение уменьшается из-за снижения степени диссоциации, вследствие чего удельная электропроводность слабых электролитов, как и сильных, после достижения максимального значения снижается (рис. 9).
Для оценки участия данного вида ионов в переносе электричества *.Гитторфом было введено понятие числа переноса иона. Число переноса иона – это отношение количества электричества, перенесенное данным видом ионов qi к общему количеству электричества qобщ, перенесенному всеми видами ионов:
Число переноса зависит от природы не только данного иона, но и противоиона. Сумма чисел переноса всех видов ионов в растворе равна единице.
При протекании электрического тока через раствор в приэлектродном пространстве происходит изменение концентрации электролита вследствие движения ионов в электрическом поле и участия ионов в электродных процессах. Допустим, что через раствор электролита MeAn, в котором Mez+ – катион металла, Anz− – кислотный остаток бескислородной кислоты, проходит некоторое количество электричества q. На катоде происходит восстановление катионов металлов:
Число переноса иона любого знака равно отношению убыли электролита у электрода противоположного иону знака к количеству разложенного электролита:
Контрольные вопросы
1. Чем обусловлена электропроводность растворов электролитов?
2. Что такое удельная электропроводность?
3. Как связана удельная электропроводность с молярной и эквивалентной электропроводностями?
4. Что такое подвижность иона?
5. Как зависит величина удельной электропроводности от подвижности иона?
6. Взаимосвязь эквивалентной электропроводности и подвижности иона. Закон Кольрауша.
7. Как определить степень диссоциации слабого электролита по данным электропроводности?
8. Как зависит эквивалентная электропроводность от концентрации сильного и слабого электролита?
9. Чем объясняется наличие максимума на зависимости удельной электропроводности от концентрации сильного и слабого электролита?

