Файл: Методические указания для выполнения лабораторных работ для студентов бакалавриата направлений 21. 03. 01 Нефтегазовое дело.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 272
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2 Определение теплоты диссоциации слабой кислоты
Электропроводность растворов электролитов
Термодинамика электрохимических систем
Строение вещества. Молекулярные спектры
Поверхностные явления. Сорбция
Лабораторная работа № 8. Исследование кинетики молекулярной адсорбции
Лабораторная работа № 9. Исследование обменной адсорбции ионов
Лабораторная работа № 10. Исследование кинетики ионообменной адсорбции
Устойчивость дисперсных систем
Лабораторная работа № 11. Изучение коагуляции гидрозоля железа
Те же операции повторить с колбами № 2 и 3. Таким образом, в колбе № 3 будет раствор, разбавленный в 1000 раз.
2. В химические стаканчики налить контрольные растворы, в отдельный стаканчик отобрать пробу раствора аммиака.
3. Подсоединить электроды к прибору: хлорсеребряный электрод – к гнезду вспомогательного электрода, ионоселективный электрод – к гнезду «изм».
4. Включить в сеть иономер, нажать кнопку «вкл.» на панели прибора.
5. Промыть электродную пару дистиллированной водой, протереть насухо кусочком фильтровальной бумаги, промыть исследуемым раствором.
6. Поместить электроды в измерительный стакан с самым разбавленным контрольным раствором, дождаться устойчивых показаний прибора и записать значение ЭДС.
Примечание: для очень разбавленных растворов показания ЭДС могут устанавливаться в течении не менее 2-3 мин.
7. Измерить ЭДС остальных контрольных растворов следуя в направлении увеличения концентрации. При смене раствора электроды насухо протирать кусочком фильтровальной бумаги. Результаты измерений занести в таблицу 1.
8. Раствор аммиака два раза последовательно разбавить в 10 раз. Получатся пробы: исходный раствор, раствор. Разбавленный в 10 раз и раствор, разбавленный в 100 раз.
9. Промыть электродную пару дистиллированной водой, протереть насухо кусочком фильтровальной бумаги.
10. Измерить ЭДС всех растворов аммиака, начиная с самого разбавленного. При смене раствора электроды насухо вытирать кусочком фильтровальной бумаги. Растворы оставить для определения концентрации ОН−.
II. Определение концентрации гидроксид-ионов
На рН-метре при помощи комбинированного электрода или пары стеклянный электрод – хлорсеребряный электрод измерить рН всех растворов аммиака. Результаты измерений ЭДС и рН занести в таблицу 2:
III. Определение аналитической концентрации NH4OH в задаче
1. В две конические колбы для титрования отобрать по 5 мл раствора аммиака.
2. В каждую колбу добавить 3 – 4 капли метилового оранжевого и дистиллированную воду примерно до 20 мл.
3. Титровать раствором серной кислоты до перехода желтой окраски раствора в оранжевую.
Содержание протокола лабораторной работы
Концентрация стандартного раствора хлорида аммония
Концентрация раствора серной кислоты (титранта)
Объем пробы раствора аммиака, взятой для его анализа титрованием, мл
Объем серной кислоты, израсходованный для титрования пробы аммиака, мл: V1, V2, Vсреднее.
Таблица 1
Данные измерений ЭДС контрольных растворов
| № раствора | С(), моль/кг | Е, В |
| 1 | | |
| 2 | | |
| 3 | | |
Таблица 2
Результаты измерений ЭДС и рН растворов аммиака
| № раствора | С, моль/л | Е, В | рН |
| 1 | «исходный» | | |
| 2 | 1/10 | | |
| 3 | 1/100 | | |
Обработка экспериментальных данных
1. Определить аналитическую концентрацию исходного раствора аммиака по формуле:
и вычислить концентрации разбавленных растворов.
2. Построить градуировочную зависимость в координатах Е – рС по данным ионометрического анализа контрольных растворов, где рС = −lgC(
3. По градуировочной зависимости определить концентрацию ионов аммония в каждом растворе аммиака.
4. Вычислить степень диссоциации 1 по полученным экспериментальным данным по формуле:
5. Определить по данным рН концентрации гидроксид-ионов для каждого раствора:
[OH−] = 10 – (14 – pH)
6. Вычислить степень диссоциации 2:
7. По полученным значениям 1 и 2 рассчитать значения констант диссоциации Kd1 и K
d2:
7. Результаты вычислений занести в таблицу:
| № | [NH4OH], моль/л | Е, В | рNH4 | [ | 1 | Kd1 | pH | [OH−], моль/л | 2 | Kd2 |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
Результат представляют в конечном виде:
K = Kd, ср K = …..
И определяют отклонение от справочных данных:
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Строение вещества. Молекулярные спектры
Краткие теоретические сведения
Спектры возникают при переходе системы (например, молекулы) из одного стационарного состояния в другое. При этом система поглощает или испускает энергию в виде кванта, величина которого равна разности энергий двух состояний:
h = E2 − E1,
где h – постоянная Планка, - частота света.
Благодаря поглощению веществом лучистой энергии в определенной области спектра свет, прошедший через индивидуальную жидкость или раствор, имеет в этой области интенсивность I меньшую, чем интенсивность падающего света I0. Уменьшение интенсивности светового потока зависит от числа поглощающих молекул, т.е. от толщины светопоглощающего слоя l и концентрации вещества в растворе С. Для монохроматического излучения зависимость интенсивности поглощаемого света от числа поглощающих молекул описывается законом Бугера-Ламберта-Бера:
или
где - коэффициент поглощения, зависящий от единиц измерения концентрации и толщины слоя: если концентрация выражена в моль/л, то называют молярным коэффициентом поглощения; численно равен обратной толщине слоя жидкости с единичной концентрацией (например, 1 моль/л), уменьшающей интенсивность света в 10 раз. D – оптическая плотность, соотношение (I/I0) называется пропусканием.
Закон Бугера-Ламберта-Беера справедлив только для газов и достаточно разбавленных растворов в инертных растворителях.
Оптическая плотность зависит от длины волны поглощаемого света. График этой зависимости называется спектром поглощения. Спектр поглощения вещества обычно представляет собой набор полос различной интенсивности и ширины. Каждая полоса связана с электронными переходами внутри молекулы поглощающего свет вещества. Положение максимума определяется происходящим при поглощении изменением энергии системы. Чем меньше энергия, требуемая для переноса электрона, тем ниже частота поглощенного кванта света
, и максимум поглощения находится в более длинноволновой части спектра. Вещества, избирательно поглощающие свет в области 380 – 780 нм, окрашены.
С помощью фотометрического исследования окрашенных комплексов в растворах можно определить состав и константу нестойкости этих комплексов. Константой нестойкости называют константу равновесия диссоциации комплекса на составляющие его ионы или молекулы. При этом различают ступенчатые и общие Kn константы нестойкости. Ступенчатые константы описывают процессы последовательного, постадийного отделения лигандов по схеме:
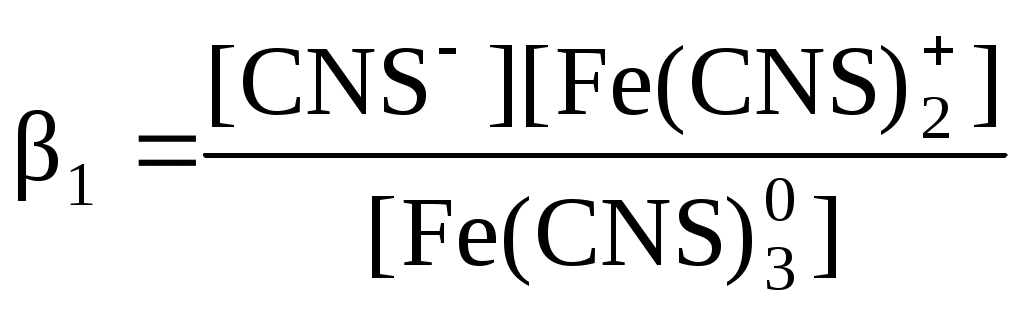 .
.Суммарный процесс описывает уравнение:
с общей константой нестойкости:
В условиях избытка тиоцианат-иона, т.е. при
и концентрация свободных ионов железа может быть вычислена по уравнению:
Подставим полученные выражения для концентраций и в уравнение для константы нестойкости:
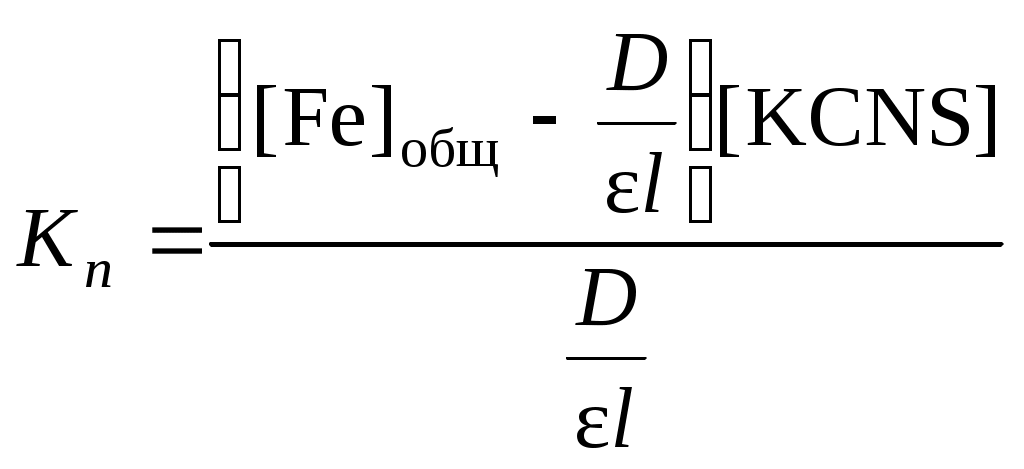 .
.Данное уравнение можно привести к виду:
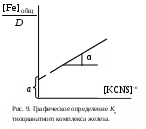
Задавая ряд значений концентрации тиоцианата калия,

