Файл: Методические указания для выполнения лабораторных работ для студентов бакалавриата направлений 21. 03. 01 Нефтегазовое дело.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 266
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2 Определение теплоты диссоциации слабой кислоты
Электропроводность растворов электролитов
Термодинамика электрохимических систем
Строение вещества. Молекулярные спектры
Поверхностные явления. Сорбция
Лабораторная работа № 8. Исследование кинетики молекулярной адсорбции
Лабораторная работа № 9. Исследование обменной адсорбции ионов
Лабораторная работа № 10. Исследование кинетики ионообменной адсорбции
Устойчивость дисперсных систем
Лабораторная работа № 11. Изучение коагуляции гидрозоля железа
Линейная скорость взаимного перемещения фаз под действием электрического поля определяется уравнением Гельмгольца-Смолуховского:
где ε – диэлектрическая проницаемость среды; ζ - электрокинетический потенциал; η – вязкость дисперсионной среды; Н - напряженность электрического поля,
где Е – разность потенциалов, В; L – расстояние между электродами, м.
Коагуляция лиофобных коллоидно-дисперсных систем чаще всего вызывается электролитами. Коагуляцию вызывают ионы, противоположные по знаку заряду коллоидных частиц.
Минимальная концентрация электролита, начиная с которой за определенный промежуток времени в коллоидном растворе наблюдается видимый эффект коагуляции (изменение цвета, помутнение, появление хлопьевидного осадка) называется порогом коагуляции или критической концентрацией Скр. Эта величина служит сравнительной мерой агрегативной устойчивости дисперсной системы и коагулирующей способностью ионов электролита.
Величина порога коагуляции вычисляется по формуле:
где СЭЛ – концентрация раствора электролита, применяемого для коагуляции, VЭЛ – наименьший объем раствора электролита, V – суммарный объем коллоидного раствора с электролитом.
В соответствии с правилом Шульце-Гарди пороги коагуляции уменьшаются с увеличением заряда иона-коагулянта и, согласно теории Дерягина-Ландау обратно пропорционально шестой степени этого заряда. Например, пороги коагуляции для одно- двух- и трехвалентных ионов
а их коагулирующая способность Р (величина, обратная порогу коагуляции) соответственно относится как
PI:PII:PIII = 1:64:729.
Для прогноза устойчивости дисперсных систем и выбора коагулянта необходимо представлять строение коллоидной частицы – мицеллы.
В состав мицеллы входит ядро, состоящее из агрегата атомов, молекул или ионов (от ста до миллионов), на поверхности которого образуется двойной электрический слой. Ядро + слой потенциалопределяющих ионов + плотный слой противоионов составляет гранулу мицеллы. Гранула имеет заряд который совпадает по знаку с зарядом потенциалобразующих ионов. Противоионы
диффузного слоя уравновешивают заряд гранулы, таким образом, мицелла в целом нейтральна.

Строение коллоидных частиц принято выражать с помощью мицеллярных формул. Ниже приведен пример мицеллярной формулы золя AgI, полученного по реакции
AgNO3 + KI = AgI + KNO3 при избытке KI:
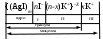
Следует отметить, что состав мицеллы может изменяться как количественно, так и качественно при изменении состава среды. Так, если бы в приведенном выше примере средой был бы раствор нитрата серебра (при избытке AgNO3), мицелла имела бы следующую формулу:

Контрольные вопросы
1. Что такое золь?
2. Какие условия нужны для получения лиофобного золя?
3. Какими методами обычно получают лиофобные золи?
4. Что такое физическая и химическая конденсация?
5. Какова основная особенность лиофобных дисперсных систем?
6. Какие возникают на поверхности коллоидной частицы?
7. Какие существуют варианты образования двойного электрического слоя?
8. Какова структура двойного электрического слоя?
9. Как изменяется потенциал ДЭС с расстоянием от поверхности?
10. Какие явления называются электрокинетическими и в чем их сущность?
11. Что такое электрокинетический потенциал, и от каких параметров зависит его величина?
12. По какому уравнению можно определить значение электрокинетического потенциала на основании изучения процессов электроосмоса или электрофореза?
13. Что вызывает коагуляцию лиофобных золей?
14. Что называется порогом коагуляции?
15. Какова формулировка и математическая запись правила Шульце-Гарди?
16. Каково строение мицеллы?
Лабораторная работа № 11. Изучение коагуляции гидрозоля железа
Цель работы
Синтез гидрозоля гидроксида железа конденсационным методом, определение порога электролитной коагуляции золя и изучение зависимости его от заряда коагулирующего иона.
Сущность работы
Гидрозоль гидроксида железа синтезируют методом конденсации, путем проведения реакции гидролиза хлорида железа при 100°С: FeCl3 + 3H2O = Fe(OH)3 + 3HCl. Агрегативная устойчивость золя гидроксида железа обеспечивается наличием на поверхности дисперсных частиц двойных электрических слоев. Формулу мицеллы ионостабилизированного золя гидроксида железа можно записать следующим образом: {[Fe(OH)3]n·mFe3+·3(m – x)Cl−}3xCl−
В процессе коагуляции высокодисперсного золя гидроксида железа образуются сравнительно небольшие по размерам седиментационно устойчивые агрегаты, поэтому исследования коагуляции частиц [Fe(OH)3]n удобнее проводить с помощью турбидиметрического метода. Применимость этого метода основывается на сильной зависимости интенсивности ослабления светового потока от размеров частиц. При коагуляции частиц ослабление света увеличивается, следовательно, растет кажущаяся оптическая плотность.
Оборудование и реактивы
Фотоэлектроколориметр; кюветы стеклянные толщиной 1 см – 2 шт.; салфетки; электрическая плитка или колбонагреватель; круглая колба объемом 500 мл – 1 шт.; колба коническая объемом 100 мл – 10 шт.; градуированная пипетка объемом 10 мл – 1 шт.; градуированная пипетка объемом 5 мл – 2 шт.; мерная пипетка объемом 10 мл – 1 шт.; хлорид железа (III) – раствор, концентрацией 2 %; сульфат натрия – раствор, концентрацией 0,0125 М; ацетат натрия – раствор концентрацией 0,5М. хлорид натрия – раствор концентрацией 0,5М
Выполнение работы
1. В колбу с 500 мл кипящей воды мерной пипеткой прилить 10 мл раствора хлорида железа. Образовавшийся золь, красно-коричневого цвета, охладить до комнатной температуры.
2. В 10 нумерованных колб емкостью 100 мл налить по 10 мл золя, дистиллированную воду и раствор электролита (Na2SO4 или CH3COONa или NaCl) в следующих объемах:
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Объем воды, мл | 10,0 | 9,0 | 8,5 | 8,0 | 7,5 | 7,0 | 6,5 | 6,0 | 5,5 | 5,0 |
| Объем электролита, мл | 0 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 4,5 | 5,0 |
3. Выдержать пробы 2-4 минуты.
4. Измерить оптическую плотность золя каждой колбы с помощью фотоколориметра на длине волны 365 нм в кюветах на 0,5 см. Раствор сравнения – дистиллированная вода. При измерении оптической плотности действовать в соответствии с инструкцией к прибору.
Содержание протокола лабораторной работы
| Наименование электролита 1 | |
| Химическая формула электролита 1 | |
| Концентрация раствора электролита 1 | |
| Наименование электролита 2 | |
| Химическая формула электролита 2 | |
| Концентрация раствора электролита 2 | |
Зависимость кажущейся оптической плотности золя гидроксида железа от объема добавленного электролита
| № | Объем электролита | Объем воды | Оптическая плотность золя, D | |
| VЭ, мл | V(H2O), мл | NaCl | Na2SO4 | |
| 1 | 0 | 10 | | |
| 2 | 1,0 | 9,0 | | |
| 3 | 1,5 | 8,5 | | |
| 4 | 2,0 | 8,0 | | |
| 5 | 2,5 | 7,5 | | |
| 6 | 3,0 | 7,0 | | |
| 7 | 3,5 | 6,5 | | |
| 8 | 4,0 | 6,0 | | |
| 9 | 4,5 | 5,5 | | |
| 10 | 5,0 | 5,0 | | |
Обработка результатов эксперимента
1. Построить графики зависимости D = f(Vэл) для Na2SO4, CH3COONa или NaCl.
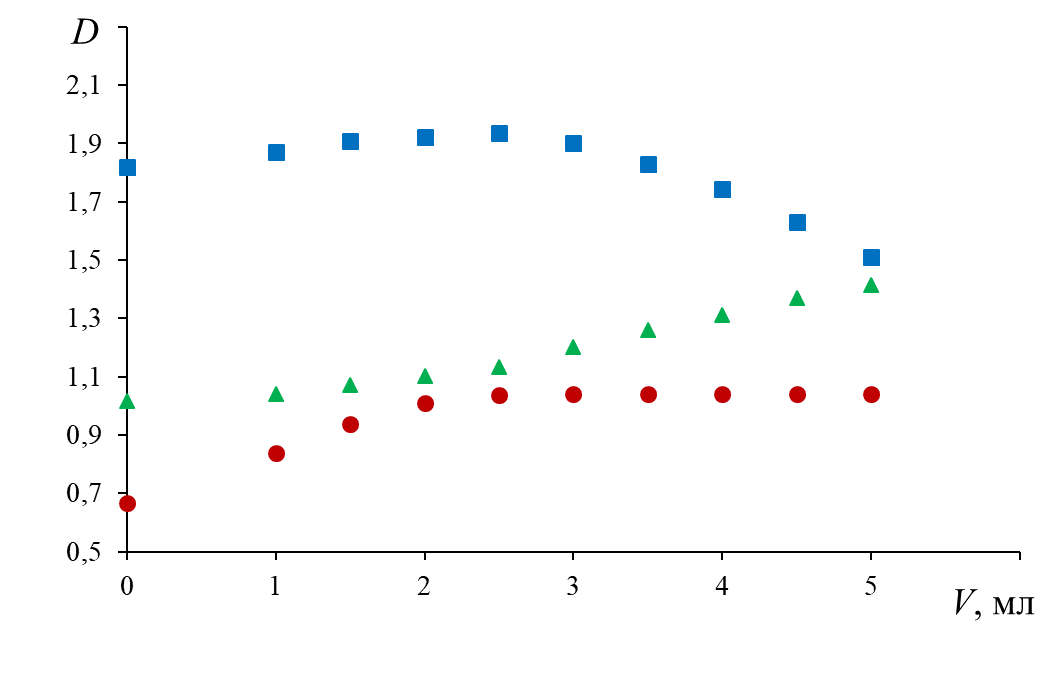
Варианты хода зависимостей оптической плотности от длины волны при разных температурных условиях для одного и того же электролита.
2. По графикам найти пороговые объемы электролита Vэл, вызывающие быструю коагуляцию золя.
2.1. Массив данных разбивают на 2 части относительно положения перегиба.
2.2. Каждую часть аппроксимируют линейной зависимостью.
2.3. По пересечению линий тренда определяют VЭЛ – наименьший объем раствора электролита, вызывающий коагуляцию.
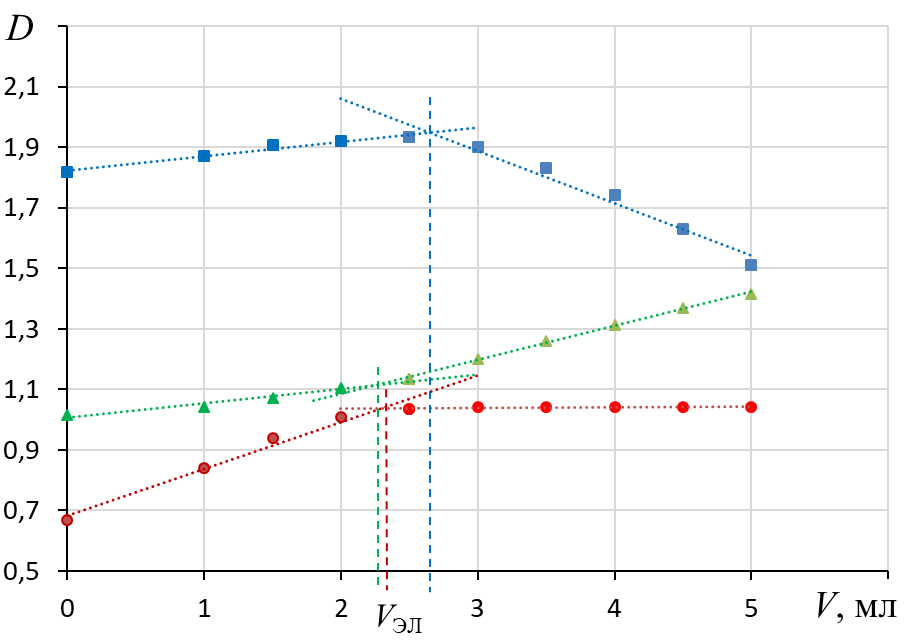
3. Рассчитать значение Скр, называемую порогом коагуляции
где СЭЛ – концентрация раствора электролита, применяемого для коагуляции, VЭЛ – наименьший объем раствора электролита, V – суммарный объем коллоидного раствора с электролитом.
4. Сравнить найденные значения Скр для Na2SO4 и CH3COONa и проверить их соответствие правилу Шульце – Гарди.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Литература
1. Стромберг А.Г., Семченко Д.П. Физическая химия. Издание 4. М.: Высшая школа, 2003.
2. Ипполитов Е.Г., Артемов А.В., Батраков В.В. Физическая химия. М.: Академия. 2005.
3. Еремин В.В., Каргов С.И., Успенская И.А. Основы физической химии. Теория и задачи. М.: Экзамен. 2005.
4. Денисов Е.Т., Саркисов О.М., Лихтенштейн Г.И. Химическая кинетика. М.: Химия, 2000.
5. Дибров И.А., Чиркст Д.Э., Литвинова Т.Е., Дубровская Н.Я. Неорганическая химия. Растворы. Сборник задач. СПб.: Изд-во СПГГИ, 2001.

