Файл: Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.04.2024
Просмотров: 161
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
образуется морфин, содержащий фенольную группу. При взаимодействии морфина с формальдегидом появляется синяя окраска.
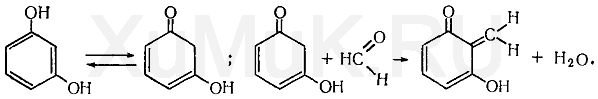
Реакция с резорцином
Альдегиды реагируют с резорцином в его таутомерной форме (кетоформе) с образованием окрашенного соединения:
Реакция восстановления ионов серебра. Из аммиачного раствора солей серебра формальдегид выделяет металлическое серебро
Кроме формальдегида эту реакцию дают и некоторые другие восстанавливающие вещества.
Реакция с реактивом Фелинга
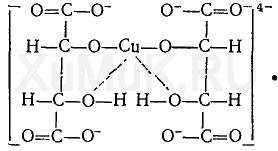
При нагревании реактива Фелинга с формальдегидом выпадает осадок оксида или гидроксида меди. Оксид меди (I) имеет черную окраску. Окраска гидроксида меди (I) зависит от размера частиц. Очень мелкие частицы имеют голубовато-зеленую окраску, а крупные — красную. Поэтому при взаимодействии реактива Фелинга с восстановителями в большинстве случаев выпадает желтый или красный осадок.
В реактиве Фелинга, который представляет собой смесь сульфата меди, щелочи и сегнетовой соли, медь входит в состав комплексного иона:
Эта реакция не специфична. Кроме формальдегида ее дают и другие альдегиды алифатического ряда, восстанавливающие сахара и др.
Схема анализа дистиллята химическим методом на галогенпроизводные углеводородов
Анализ второго дистиллята начинают с исследования ядовитых галогенпроизводных алифатического ряда.
Галогенпроизводственные алифатического ряда
Летальные дозы для них такие: хлороформ СHCl3 = 50—70 граммов; четыреххлористый углерод СCl4 = 20—50 мл;
По токсическому действию:
-
хлороформ и хлоралгидрат являются наркотиками. Они сначала возбуждают, а затем парализуют нервную систему; -
четыреххлористый углерод действует на организм подобно хлороформу, но медленнее и вызывает значительные нарушения в органах: в печенке, почках наблюдается жировое перерождение; -
дихлорэтан по наркотическим действиям — самый сильный из ядовитых галоидпроизводных.
Отравление этими веществами сопровождается рвотой, поносом, вздутием живота, увеличением и болезненностью печени, анурией.
Метаболизм изучен недостаточно, конечным результатом метаболических пpoцесов является углерод диоксид и хлористоводородная кислота:
Особенностью изолирования галогенпроизводных ядов алифатического ряда является способность перегнаться уже в neрвые порции дистиллята. При значительных количествах ядов (> 1 грамма) в дистилляте наблюдаются капли жидкости, которые несмешиваются с водой.
Анализ начинают из общей (неспецифической) и низькочувствительной реакции на Сl из AgN03 после отделения органически связанного хлора, которую дают все галоидпроизводные.
На протяжении 4 часов нагревают в запаянной ампуле. Наблюдается белый осадок или белая муть в растворе:
Если не отмечается появление мути или осадка, то проводится реакция Фудживара, основанная на образовании полиметина, — чувствительная, неспенифическая.
Методика перегонки с водяным паром
Измельченный биоматериал помещают в колбу и смешивают с водой до однородной массы. Подкисляют винной или щавелевой кислотой. Через присоединенный парообразователь насыщают паром. После этого пар поступает через водяной холодильник в приемник.
Этим методом перегоняются как вещества растворимые в воде:
- синильная кислота, метанол, этанол, уксусная кислота и т.д.
так и труднорастворимые:
- хлороформ, четыреххлористый углерод, дихлорэтан, изоамиловый спирт и др.
В первых порциях дистиллята, при их наличии будут присутствовать:
- синильная кислота, метанол, этанол.
Галогенводороды нашли применение в промышленности, медицине, быту. Поэтому мы изучили наиболее характерные представители этой группы: хлороформ, четыреххлористый углерод, дихлорэтан, хлоралгидрат.
Общей качественной реакцией для всех перечисленных галогенуглеводородов является реакция отщепления органически связанного хлора и определения ионов хлора нитратом серебра.
Исследование галогенпроизводных углеводородов. Хлороформ
Хлороформ
Качественное определение
1. Отщепление хлора и определение ионов хлора нитратом серебра:
CHCl3 + 4NaOH 2NaCl + HCOONa + 2H2O
NaCl + AgNO3 AgCl↓ + NaNO3
2. Как видно из предыдущей реакции, при отщеплении органически связанного хлора, одним из продуктов реакции является формиат натрия, который определяют с реактивом Фелинга:
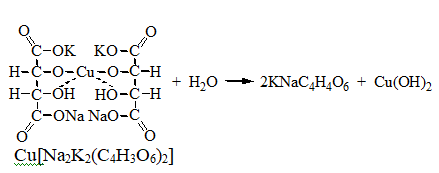
2Cu(OH)2 + HCOONa Cu2O↓ + CO2 + 2H2O + NaOH
желтый → красный цвет
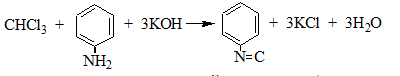
3. Образование изонитрила.
Проводят с первичными аминами с последующим прибавлением щелочи при нагревании – неприятный запах:
4. Реакция с пиридином в щелочной среде. Образуется глутаконовый альдегид – красного цвета:
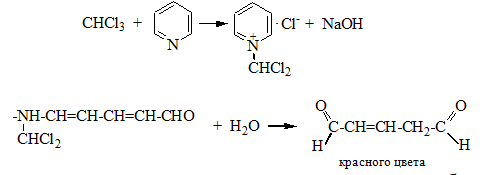
Эта реакция применяется для предварительного обнаружения галогенуглеводородов.
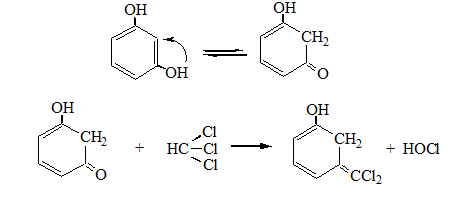
5. С резорцином – малиновое окрашивание.
Количественное определение
Все галогенуглеводороды количественно определяют аргентометрически по хлорид-иону.
Токсикологическое значение
Применяется в промышленности как растворитель и экстрагент.
Отравления – при вдыхании через пищеварительный тракт.
Легкая степень – сознание затемнено, понижение слуха, косоглазие с диплопией.
Средняя тяжесть – тоже, что и при легкой, только с тошнотой, рвотой, болями головы, поносом.
Тяжелая – судороги, кома, нефропатия, перерождение печени. Смерть наступает от оттека легких.
Антидотов нет.
Метаболизм – СО2 и НCl.
Выделяют в неизменном виде из легких – 9%.
Четыреххлористый углерод
Прозрачная жидкость со своеобразным запахом (т. кип. 75—77 °С). Он смешивается в любых соотношениях с ацетоном, бензолом, бензином, сероуглеродом и другими органическими растворителями. В воде при 20 °С растворяется около 0,01 % четыреххлористого углерода. Четыреххлористый углерод не огнеопасен, его пары в несколько раз тяжелее воздуха.
Обнаружение четыреххлористого углерода
Реакция отщепления хлора. Четыреххлористый углерод можно обнаружить по наличию в его молекуле атомов хлора. Выполнение этой реакции описано выше.
CCl4 + 4NaOH = 4NaCl + CO2 + 2H2O
NaCl + AgNO3 = AgCl (осадок белого цвета) + NaNO3
Реакция Фудживара. При нагревании СCl4 с пиридином в присутствии щелочи появляется красная окраска.
Реакция образования изонитрила. Четыреххлористый углерод при взаимодействии с анилином образует изонитрил, имеющий неприятный запах.
Реакция с резорцином. При нагревании ССl4 с резорцином в присутствии щелочи появляется розовая или малиново-красная окраска.
С 2,7-диоксинафталином: Светло-бурое → зелено-желтое окрашивание. Отличительные реакции представлены в таблице (Крамаренко).
Токсикологическое значение
CCl4 – растворитель, экстрагент. Попадает – на кожу, ЖКТ, легкие. Накапливается – жировая ткань, печень, мозг, костный мозг, почки. Выделяется – через легкие, с мочой. Далее перерождение клеток печени, почек. Легкая степень отравления: раздражение глазных яблок, головокружение, головная боль.
Массивное отравление: тошнота, рвота, понос, боли в животе, желудочно-кишечные кровотечения, головная боль, головокружение, спутанное сознание, сонливость, расстройство зрения, судороги, кома – смерть за счет остановки дыхания, сердца. Антидотов нет.
Хлоралгидрат
Хлоралгидрат
Качественное определение
1. Отщепление хлора.
CCl3СОH + NaOH НСCl3 + HCOONa
Как видно из этой реакции хлоралгидрат при отщеплении атома хлора образует хлороформ, поэтому он дает все те же реакции, что и хлороформ.
2. С реактивом Несслера.
Эта реакция позволяет отличить хлоралгидрат от остальных галогенуглеводородов.
CCl3СОH + K2[HgI4] + 3KOH Hg↓ + СCl3COOK + 4KI + 2H2O
Обличить его можно экстракцией из дистиллята диэтиловым эфиром. При его присутствии в дистилляте в выпарительной чашке характерное кристаллическое вещество – сухой остаток хлоралгидрата.
Токсикологическое значение
Применяется в медицине – успокаивающее, снотворное, противосудорожное.
Накопление, симптомы – похожи на действие хлороформа.
Метаболизм – трихлорэтанол, трихлоруксусная кислота.
Выводится – с мочой в виде глюкуронида.
Антидотов нет.
Дихлорэтан
Дихлорэтан
Качественное определение
1. Реакция отщепление органически связанного хлора. В зависимости от условий проведения этой реакции образуется разные продукты, на которые проводят соответствующие реакции.
Выделившийся формальдегид определяют реакциями:
1. С хромотроновой кислотой:
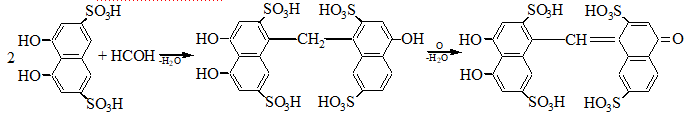
фиолетовая
2. С фуксинсернистой кислотой:
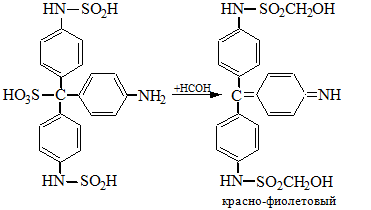
3. С резорцином:
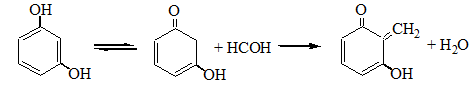
4. С метиловым фиолетовым – синее окрашивание.
5. С кодеином и серной кислотой – синее окрашивание.
6. С реактивом Фелинга – сказано выше.
7. С аммиачным раствором нитрата серебра.
2[Ag(NH3)2]NO3 + HCOH + H2O 2Ag + HCOONH4 + 2NH4NO3 + NH3
Токсикологическое значение
С2Н4Cl2 – применяется – как растворитель, экстрагент, в кожевенной промышленности.
Системный яд. Попадает через легкие, кожу, ЖКТ.
Поражает: ЦНС, печень, почки, сердечную мышцу.
Расстройства: нервные, кишечные.
Метаболиты – неизвестны.
Антидотов нет.
Обнаружение и определение спиртом имеющих токсикологическое значение
К спиртам, которые имеют значение при отравлениях, относятся – метанол, этанол, изоамиловый, этиленгликоль (двухатомный спирт).
Схема анализа дистиллята химическим методом на ацетон, метанол, этанол
Обнаружение ацетона
Ацетон СН 3 —СО—СН 3 (диметилкетон, пропанон) — бесцветная подвижная жидкость (т. кип. 56,3 °С) с характерным запахом. Он смешивается с водой, этиловым спиртом и диэтиловым эфиром во всех соотношениях. Из водных растворов ацетон высаливается хлоридом натрия, хлоридом кальция, карбонатом калия (жидкость разделяется на два слоя). Ацетон хорошо растворяет соли многих неорганических кислот и ряд органических соединений. Ацетонполучают при сухой перегонке дерева, каменного угля, а также путем синтеза.

