Файл: Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.04.2024
Просмотров: 158
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
B. Колбу с водой дистиллирует
C. Пустую колбу
D. Раствор кислоты хлористоводневої
E. Охлажден приемник
Эталоны ответов: 1-С, 2-С, 3-В, 4-D, 5-A, 6-В
Соединения, которые изолируются из биологического материала перегонкой с водяной паром (летучие яды). Анализ дистиллята химическим методом на синильную кислоту, формальдегид.
Методы изолирования веществ из биологического материала
Для изолирования «летучих» ядов в химико-токсикологическом анализе существуют такие методы:
— перегонка (дистилляция) с водяным паром при атмосферном давлении;
— перегонка с водяным паром при уменьшенном давлении;
— перегонка с водяным паром при повышенном давлении;
— методы микродиффузии;
— суховоздушная отгонка;
— парофазный метод.
В судебно-химических лабораториях изолирования «летучих» ядов из биологического материала чаще всего осуществляют методом перегонки (дистилляции) с водяным паром при атмосферном давлении по методике: 100 граммов биологического материала измельчают, смешивают с дистиллированной водой (Vколби = 1/3 Vсмеси) и помещают в колбу, которую ставят на холодную водяную баню. Потом нагревают парообразователь до появления пара воды, исследуемую смесь подкисляют насыщенным водным раствором щавелевой или винной кислоты к рН = 2—2,5, немедленно соединяют все части (парообразователя, колбу, холодильник и приемник) и только потом нагревают водяную баню.
Bcе «летучие» яды делятся по способности смешиваться с водой на:
1. Вещества, которые несмешиваются или плохо смешиваются с водой (бензол, хлороформ), дают после перегонки два четких слоя: вода и вещество, которые легко разделить.
2. Вещества, которые дают с водой смеси, в которых состав пара и жидкости одинаковый (фенол, этанол), — азеотропные смеси. В дистилляте не разделяются. Для разделения азеотропных смесей используют перегонку при снижении или повышении давления (азеотропная смесь этанола с водой — 96 % С2H5OH + 4 % Н20 — перегоняеться при атмосферном давлении при 78 °С. Со снижением давления до 100 мм рт. ст. (« 13,3 кПа) во время дистиляции смесь имеет состав 99,62 % С2H5OH + 4 % Н20 и переганяеться при 34 °С).
Если после перегонки с водяным паром состав ядов в дистиллятах малый или в дистилляты попадают вещества, которые образовались в результате гниения биологического материала, то для очищения их поддают фракционной перегонке.
При нагревании двукомпонентной смеси, состоящей из практически нерастворимых друг в друге веществ, каждое из них увеличивает упругость своих паров независимо от другого. Когда упругость паров смеси достигает атмосферного давления – жидкость закипает и оба вещества начинают перегоняться с водяным паром.
Так как сумма упругостей паров обоих веществ равна атмосферному давлению, температура перегонки каждого вещества в смеси будет ниже температуры кипения каждого компонента в чистом виде
ОБЩАЯ СХЕМА АНАЛИЗА ДИСТИЛЛЯТОВ ХИМИЧЕСКИМ МЕТОДОМ АНАЛИЗ ПЕРВОГО ДИСТИЛЛЯТА
Анализ начинают с первого дистиллята на наличие синильной кислоты.
Синильная кислота
Физические свойства— это жидкость без цвета, имеет запах горького миндаля, летучая, температура кипеня — 25,6 °С.
Очень слабая кислота Ка = 4,8 • Ю-10, соли ее в воде неустойчивы
Токсичное действие. Синильная кислота поражает дыхание, то есть блокирует дыхательный фермент — цитохромоксидазу, при этом кислород от гемоглобина не поступает в ткани.
HCN + белок – R – Fe3+ = белок – R – Fe3+ - CN + H+
цитохромоксидаза стойкий комплекс
Анализ дистиллята на синильную кислоту начинают с предварительной, высокочувствительной и специфической реакции образования берлинской лазури.
Методика проведения перегонки (дистилляции) с водяным паром
Исследуемый объект (100 г биологического материала) измельчают, смешивают с водой до получения однородной массы и помещают в колбу. Когда все части прибора соединены, содержимое колбы быстро подкисляют раствором щавелевой кислоты или виннокаменной кислоты до рН = 2. Затем подсоединяют парообразователь и проводят перегонку (дистилляцию) с водяным паром. Объект исследования нельзя подкислять минеральными кислотами, т.к. в случае наличия в исследуемом материале легколетучей циановодородной (HCN) кислоты – она будет выделяться, что может привести к отравлению и смерти.
НСN – газ или бесцветная жидкость, температура кипения – 25,6 °С. В воде происходит ее гидролиз:
HCN + 2H2O =НCОONH4
Соли циановодородной (синильной) кислоты на воздухе и в растворе реагируют с о диоксидом углерода (СО
2) и водой:
КCN + СO2 + H2O =КНCО3 + HCN
КCN + 2H2O =NН3 + HCООК
Обнаружение:
1. Образование берлинской лазури:
FeSO4 + 6KCN = K4[Fe(CN)6] + K2SO4
3K4[Fe(CN)6] + 4FeCl3 = Fe4[Fe(CN)6]3 + 12KCl
2. Образование роданида железа:
КCN + (NH4)2S2=КSCN + (NH4)2S
3КSCN + FeCl3 + 3H2O =Fe(SCN)3(H2O)3
красное окрашивание
3. Образование бензидиновой сини:
Cu(CH3COO)2 + 2HCN = Cu(CN)2 + 2CH3COOH
2Cu(CN)2 = (CN)2 + 2Cu(CN)
(CN)2 + H2O = HCN + HCNO
HCNO = HCN + O
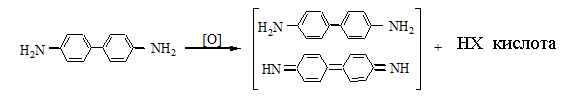
4. Образование соли изопурпурной кислоты по реакции с пикриновой кислотой.
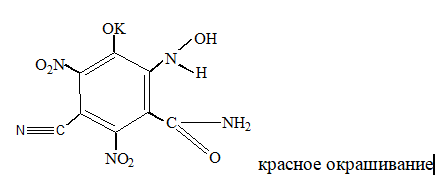
Микрокристаллоскопическая реакция образования цианида серебра
Количественное определение:
1. При исследовании свежего трупного материала применяют объемное определение НСN по избытку 0,1 н. раствора AgNO3, избыток которого оттитровывают аммония роданидом – NH4SCN. Индикатором является – железо аммонийные квасцы.
2. При исследовании несвежего трупного материала – весовой метод (описан в учебнике М.Д. Швайковой "Токсикологическая химия"):
При исследовании не вполне свежего трупного материала титриметрический метод анализа неприемлем, т.к. Н2S, содержащийся в объекте исследования, будет реагировать с серебра нитратом с образованием сульфида серебра, который будет искажать результаты анализа. В таких случаях обычно применяют гравиметрический (весовой) метод определения цианидов – CN.
Весовое (гравиметрическое) определение синильной кислоты сводится к отгонке синильной кислоты из навески объекта исследования, собиранию дистиллятов в 2-3 приемника, содержащие 0,2% раствор серебра нитрата, отделению после подкисления азотной кислотой (не содержащей цианидов – СN) осадка АgСN с возможной примесью Ag2S, обработке полученного осадка избытком раствора аммиака в целях отделения растворимого в нем цианида серебра от нерастворимого сульфида серебра, выделению из раствора с помощью азотной кислоты цианида серебра
и определению металлического серебра после высушивания, сжигания и прокаливания фильтра с осадком.
Токсикологическое значение
Токсикологическое значение НСN объясняется ее сильной ядовитостью; тем, что она связывается с Fe2+ гемоглобина крови и дыхательными ферментами (Fe3+), а также ее широком применении в народном хозяйстве.
Соли HCN применяются для получения Au и Ag из руд – цианамидный способ:
4Au + 8KCN + O2 + 2H2O
 4K[Au(CN)2] + 4КОН
4K[Au(CN)2] + 4КОНзатем действуют металлическим цинком и получают чистые металлы.
Этот метод был предложен в 1843 году Багратионом Петром Романовичем для извлечения золота – Аu из руд методом цианирования.
Цианиды применяют в фотографии, в производстве фармацевтических препаратов, в сельском хозяйстве для борьбы с грызунами.
В период второй мировой войны фашисты травили людей в газовых камерах ЦИКЛОНОМ (пористый материал, пропитанный HCN).
Источником отравления в быту являются ядра горького миндаля, абрикоса, вишни и других плодов семейства розоцветных содержащих гликозид АМИГДАЛИН:
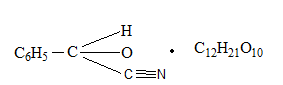
который в кислом растворе расщепляется на виноградный сахар , бензальдегид и HСN.
В организме, в тканях трупа, во внешней среде цианиды подвергаются биотрансформации:
1. Гидролиз : НСN + 2Н2О=HCOONH4
2. Превращением в роданиды под влиянием ронидазы (фермент):
KCN + S=KSCN
3. Соединяется с гемоглобином крови, образуя циангемоглобин.
4. Связывается с цистеином.
5. Присоединяется к альдегидной группе сахаров:
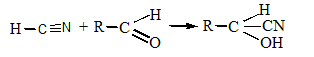
Цианиды на воздухе превращаются в гидрокарбонаты:
КСN + СO2 + H2O =KHCO3 + HCN
Ввиду всего вышеизложенного химико-токсикологическое определение (идентификация и количественное определение) в биологическом материале проводят в день поступления объектов на анализ.
В качестве помощи при отравлении цианидами используют внутривенное введение натрия тиосульфата – Na2S2O3.
Синильная кислота (НСN) взаимодействует с дыхательным ферментом, содержащим Fе3+, с которым образует прочное комплексное соединение. В результате тканевое дыхание приостанавливается, несмотря на то, что кровь содержит О
2. Смерть наступает в результате паралича дыхания.
Антидоты – внутривенно вводят раствор метиленовой сини, дают нюхать амилнитрит (амиловый эфир азотистой кислоты), назначают в виде лекарственных средств – нитриты (в частности натрия нитрит).
Обнаружение формальдегида
В химико-токсикологическом анализе для обнаружения формальдегида Η—СНО применяют реакции с хромотроповой кислотой, фуксинсернистой кислотой, с раствором кодеина в серной кислоте, с резорцином и др.
Реакция с хромотроповой кислотой. Хромотроповая кислота с формальдегидом в присутствии серной кислоты дает фиолетовую окраску. При взаимодействии формальдегида с хромотроповой кислотой концентрированная серная кислота одновременно является водо-
отнимающим средством и окислителем. Вначале серная кислота вызывает конденсацию формальдегида с хромотроповой кислотой, а затем окисляет образовавшийся продукт конденсации:
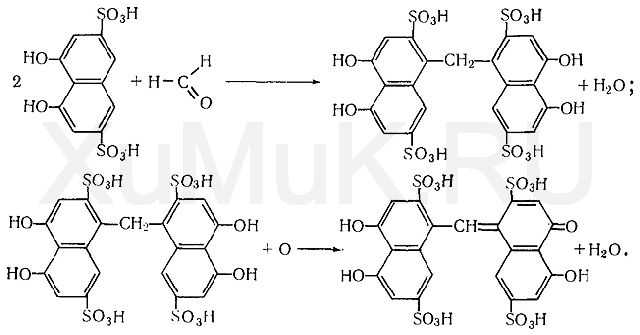
Для успешного протекания указанной выше реакции требуется серная кислота, концентрация которой должна быть не ниже 72 %.
Не дают этой реакции альдегиды уксусной, пропионовой и масляной кислот, хлоралгидрат и др. Эту реакцию дают вещества, которые при гидролизе, дегидратации или окислении образуют формальдегид.
Реакция с фуксинсернистой кислотой.
Фуксинсернистая кислота (реактив Шиффа) с формальдегидом дает синюю или сине-фиолетовую окраску.
Для приготовления фуксинсернистой кислоты берут раствор парафуксина (I), имеющий красную окраску, прибавляют водный раствор оксида серы (IV) или пропускают газообразный SO 2. При этом образуется фуксинсернистая кислота(II), не имеющая окраски. Эта кислота с альдегидами образует хиноидный краситель (III) розового цвета:
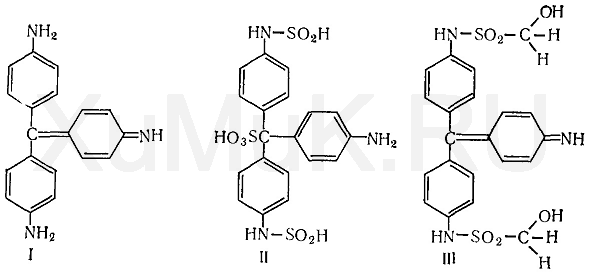
Реакция с кодеином и серной кислотой. При нагревании формальдегида с кодеином в присутствии концентрированной серной кислоты появляется синяя окраска. Эта реакция основана на том, что под влиянием концентрированной серной кислоты от кодеина отщепляется метоксильная группа, в результате чего

