Файл: Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.04.2024
Просмотров: 160
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Фотоколориметрический метод.
Дитизоновый метод является наиболее подходящим для определения кадмия в биологическом материале.
Дитизонат кадмия, красного цвета, количественно экстрагируется четыреххлористым углеродом при рН 12. точность определения невелика, т.к. дитизонат кадмия не очень устойчив и поэтому превращает комплекс в свободный дитизон, взбалтывая раствор с хлороводордной кислотой. Оптическую плотность дитизона определяют при 620 нм.
При количественном определении ионов кадмия в присутствии обычно всех встречающихся вместе с ним элементов (цинк, кобальт, никель, свинец, висмут, серебро и медь) применяется следующий вариант дитизонового метода.
Сначала проводят экстракцию дитизоната кадмия из щелочного раствора, затем разрушают дитизонат кадмия, и переводят ионы кадмия в водный раствор обработкой хлороводородной кислотой и затем снова экстрагируют дитизонат кадмия из щелочной среды хлороформом. Оптическую плотность раствора определяют при 520 нм.
Следы ионов кадмия определяют методом атомной абсорбционной спектроскопии.
Следует обратить внимание на то, что при обнаружении и количественном определении ионов кадмия в объектах исследования обязательным является необходимость наличие и содержание данного металла в лабораторном стекле, реактивах и растворителях.
ЦИНК.
ЦИНК.
Распространение и применение.
История цинка не отличается точностью дат. Известно, что в Индии его получали ещё в V веке до нашей эры. Получение металлического цинка описано у римского историка Страбона (60-20 годы до нашей эры). Позже, однако, искусство выплавки цинка в Европе было утрачено. Лишь в 1743 году в Бристоле заработал первый в Европе цинковый завод.
Цинк интенсивно используется, как составная часть латуни (сплав цинка с медью), типографского шрифта (сплав цинка, магния и алюминия), при гальванизации металлов. В пиротехнике цинковую пыль применяют, чтобы получить голубое пламя. Цинковая пыль используется в производстве редких и благородных металлов. Главная составная часть краски, используемой для окрашивания крупногабаритных изделий из металла – всё та же цинковая пыль. Оксид цинка нужен не только для получения краски, им широко пользуется стекольная промышленность для увеличения термостойкости стекол. Препараты на основе цинка эффективны при кожных заболеваниях. Селениды, теллуриды, антимониды и арсениды цинка широко применяются в качестве полупроводниковых материалов. Сульфид цинка применяется доя покрытия светящихся экранов телевизоров, осциллографов, рентгеновских аппаратов. Хлорид цинка используется химическими генератами дыма в военных и других целях.
Цинк – один из важных биологически активных микроэлементов. Его ежедневная доза для человека составляет 10-15 мг. Он присутствует во многих пищевых продуктах в виде глюконатов. Цинк – обязательная составная часть фермента крови карбоангидразы. Этот фермент ускоряет выделение углекислого газа из легких. Цинк участвует в обмене нуклеиновых кислот и синтезе белков.
Со времен Парацельса до наших дней в глазной практике находит применение 0,95% раствор сульфата цинка. Как присыпка издавна применяется стеарат цинка. Фенолсульфонат цинка – хороший антисептик. Суспензия, в которую входит инсулин, протамин и хлорид цинка – эффективное средство против диабета.
И вместе с тем многие соединения цинка, прежде всего сульфат и хлорид, токсичны.
Предельно допустимая концентрация цинка в промышленной зоне производственных помещений 5 мг/м3.
Содержание в крови.
Концентрация цинка в сыворотке крови у здоровых людей составляет в среднем 0,83 мг/л. в эритроцитах концентрация цинка составляет 12,25 мг/л. содержание цинка в цельной крови и в её плазме у рабочих занятых на литейном производстве на 46% больше чем у людей контрольной группы, не связанной с производством цинка.
Метаболизм и выделение.
Приблизительно 20-30% потребляемого цинка всасывается желудочно-кишечным трактом. Из этого количества около 20% выводится из организма человека с мочой и до 60% с фекалиями. Цинк распределяется по всем тканям организма, но больше всего в печени, мышечной ткани и костях. В норме содержание цинка в моче составляет 0,3-0,4 мг/за 24 часа, но у пациентов страдающих протеинурией (выделение белка с мочой) этот показатель более чем 2,1 мг/за 24 часа. При содержании оксида цинка в рабочей зоне производственных помещений на уровне 3-5 мг/м3 его концентрация в моче 0,6-0,7 мг/л.
Токсичность. Отравление соединениями цинка – это прежде всего результат острой непреднамеренной интоксикации в силу того, что растворимые соединения цинка вызывают сильную рвоту. При вдыхании пыли или дыма, содержащих мелкодисперсные соединения цинка возникают типичные признаки металлической лихорадки: раздражение дыхательных путей, боль в груди, кашель, похолодание конечностей, слабость, головная боль, тошнота, затрудненное дыхание, мышечные боли. Эти симптомы редко продолжаются более 24 часов и не вызывают фатального исхода. При отравлении оксидом цинка наблюдается умеренное воспаление желудочно-кишечного тракта.
Острое отравление оксидами цинка вызывает лихорадку, тошноту, рвоту, диарею, сонливость, мышечные боли, слабость, цианоз, отек легких, острый панкреатит и острую почечную недостаточность, повышение температуры, слизистые оболочки полости рта белого цвета и сморщены. Смерть при этом является результатом острого отека легких, бронхопневмонии и фиброза легочной ткани.
Длительный прием пищи, содержащей чрезмерное количество соединений цинка, приводит к сидеробластической анемии, т. е. к чрезмерному увеличению незрелых ядерных клеток красного костного мозга.
Описаны случаи хронического отравления при дермальном контакте с хлоридом цинка и возникающих болях в ногах, общей слабости, потери аппетита и потере веса.
В ряде случаев Наблюдается явления летаргии, тошнота, рвота и эрозия желудочно-кишечного тракта. Применение ЭДТА кальция в качестве антидота было успешным. Лечение симптоматическое и поддерживающее. Карпозийный гастрит и некроз почек, которые являются следствием попадания хлорида цинка в организм приводит к летальному исходу.
Имеются сообщения о случаях смерти после внутривенного введения 7,4 г цинка сульфата в результате возникающей гипотензии, отёка лёгких, рвоте, диареи, желтухи и почечной недостатточности.
Обнаружения цинка в минерализате.
Обнаружение ионов цинка в минерализате основано на его реакции с дитизоном. При наличии цинка наблюдается изменение зелёной окраски хлороформного слоя в красно-фиолетовый. Чувствительность реакции 2,5•10–5 мг/мл. Реакция позволяет определить цинк в количестве в 5 мг в 100 г биологического материала.
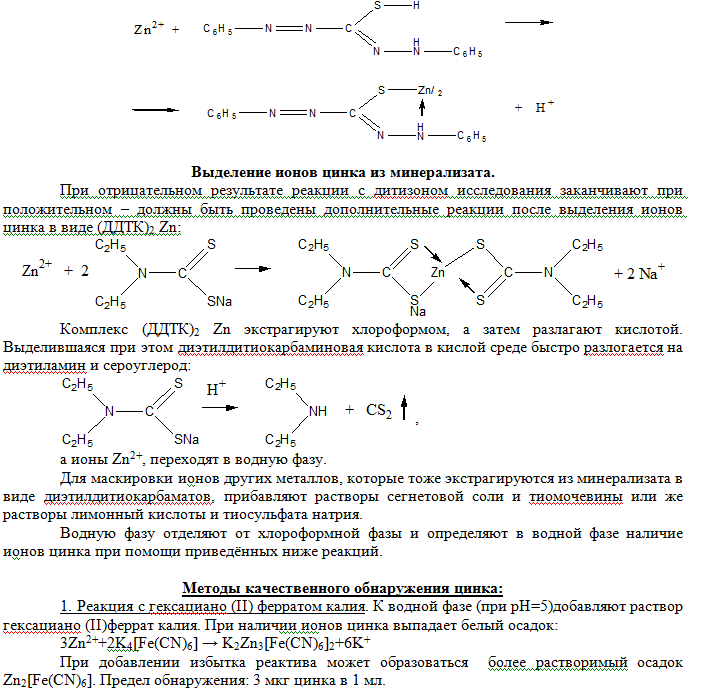
2. Реакция с сульфидом цинка. К водной фазе (рН≈5) добавляют раствор свежеприготовленного сульфида натрия. Образование белого осадка ZnS указывает на наличие ионов цинка в водной фазе. Предел обнаружения: 1,5 мкг цинка в 1 мл.
Zn2++S2- → ZnS↓
3. Реакция с тетрароданомеркуратом аммония. На придметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. К сухому остатку добавляют каплю 10% раствора уксусной кислоты и каплю раствора родано (II) меркурата аммония (NH4)2[Hg(SCN)4]. В присутствии ионов цинка образуются бесцветные одиночные клиновидные кристаллы или дендриты Zn[Hg(SCN)4]:
Zn(CH3COO)2+(NH4)2[Hg(SCN)4] → Zn[Hg(SCN)4]↓+2CH3COONH4
Предел обнаружения: 0,2 мг цинка в 1 мл.
Дополнительные реакции обнаружения ионов цинка в минерализате.
1. Реакция с раствором резорцина в аммиачной среде. На капельной пластинке смешивают каплю спиртового раствора резорцина с каплей 6н. аммиака и с каплей анализируемого раствора. При наличии ионов цинка в минерализате раствор окрашивается в голубой цвет. Предел обнаружения: 2 мкг в 1 мл.
2. Реакция образования зелени Ринмана. После сжигания кусочка фильтровальной бумаги, смоченной раствором соли цинка и нитрата кобальта получается зола, окрашенная в зеленый цвет:
Zn(NO3)2+Co(NO3)2 → CoZnO2+4NO +O2.
Предел обнаружения: 0,6 мг в 1 мл.
3. Реакция с роданомеркурат аммонием. Роданомеркурат аммония осаждает из нейтральных или слабокислых растворов солей цинка белый осадок тетрароданомеркуриат цинка:
(NH4)2[Hg(SCN)4]+ZN2+→ Zn[Hg(SCN)4]↓+2NH4+
Предел обнаружения: 2 мкг в 1 мл.
4. реакция с двузамещенным фосфатом натрия. Двузамещенный фосфат натрия осаждают из растворов солей цинка в присутствиии гидроксида аммония белый кристаллический осадок:
Zn2++NH4OH+Na2HPO4 →ZnNH4PO4↓+NH4++H2O
Предел обнаружения: 6 мкг в 1 мл
Микрокристаллоскопическое определение ионов цинка.
1. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят каплю хлорида цезия, каплю хлорида в хлороводородной кислоте. При наличии ионов цинка образуется красная призма – CsZn(AuCI6).
2. Реакция с пикриновой кислотой. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят несколько капель пикриновой кислоты. При наличии ионов цинка образуются желтые тонкие иглы – (C6H2N3O7)2Zn. Открываемый минимум: 0,2 мкг.
3. Реакция с карбонатом натрия. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят каплю раствора карбоната натрия. При наличии ионов цинка образуются бесцветные тетраэдры, треугольные призмы – 3Na2CO3 • 8ZnCO3 • H2O.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ.
1. Титрование раствором ЭДТА. Растворы солей цинка можно титровать раствором ЭДТА при рН 4,5, применяя в качестве индикатора дитизон и прибавляя спирт или ацетон для повышения растворимости дитизона и дитизоната цинка. Титруют раствором ЭДТА до перехода окраски из красной в серую. Граница определения 1 мкг.
2. Экстракционное титрование дитизоном. К анализируемому раствору соли цинка прибавляют маленькими порциями титрованный раствор дитизона и сильно взбалтывают. Конец титрования наступает тогда, когда прекращается экстракция красного дитизоната цинка.
Это очень чувствительный метод. Точность определения ±1%

