Файл: Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.04.2024
Просмотров: 159
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
КОЛОРИМЕТРИЧЕСКИЕ МЕТОДЫ.
1. Дитизоновый метод. Это очень чувствительный и достаточно точный метод. Дитизонат цинка, красного цвета, извлеккают четыреххлористым углеродом при рН 6,5-7,5, т.к. в хлороформе эта реакция протекает медленнее и дитизонат цинка в четыреххлористом углероде со временем не претерпевает заметного разложения. Оптическую плотность определяют при 535 нм.
Zn2++2HDz → Zn(HDz)2
2. количественное определение цинка по реакции с дифенилкарбазоном. Дифенилккарбазон с ионами цинка образует соединение при соотношении Ме:Re=1:2:
 Оптическую плотность раствора определяют при 530 нм.
Оптическую плотность раствора определяют при 530 нм.Количественное определение ионов цинка в сыворотке крови и моче обычно выполняется методом атомной абсорбционной спектроскопии.
Эмиссионный спектральный метод может быть выполнен без предварительного концентрирования минерализата при концентрации цинка 10-3-10-5%.
Лекция 2. Вещества, которые изолируются из биологического материала перегонкой с водяным паром (летучие яды). Схема анализа дистиллята химическим методом. Анализ дистиллята и биологических жидкостей на летучие яды методом газо– жидкостной хроматографии.
Группа веществ, изолируемых дистилляцией с водяным паром
Из ядовитых веществ, имеющих токсикологическое значение из объектов биологического происхождения перегонкой с водяным паром изолируются следующие вещества:
1. Кислота циановодородная (синильная) – НСN;
2. Галогенопроизводные алифатического ряда (CHCl3, хлоралгидрат дихлорэтан, ССl4);
3. Альдегиды и кетоны – СН2О и ацетон;
4. Спирты алифатического ряда – СН3ОН, С2Н5ОН, изоамиловый спирт, этиленгликоль;
5. Органические карбоновые кислоты – СН3СООН;
6. Одноатомные фенолы – карболовая кислота, крезол, лизол.
Бытовые отравления чаще всего происходят этиловым спиртом и другими спиртами, уксусной кислотой, дихлорэтаном.
Методом дистилляции с водяным паром изолируются из биологического материала вещества, хорошо растворимые в воде (HCN, СН3СООН, С2Н5ОН и др.) и вещества, трудно растворимые или практически нерастворимые в воде (CHCl3, CCl4, дихлорэтан).
При этом, и для первой и для второй группы веществ, существуют свои закономерности.
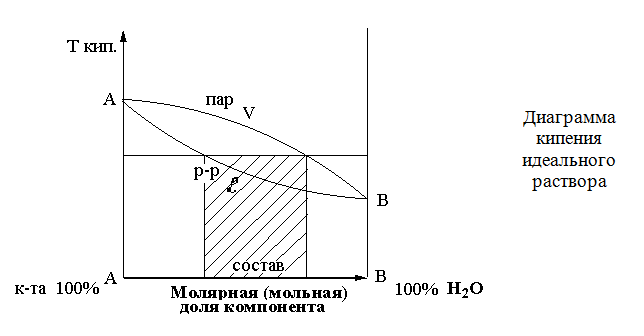
При нагревании двукомпонентной смеси, состоящей из практически нерастворимых друг в друге веществ, каждое из них увеличивает упругость своих паров независимо от другого. Когда упругость паров смеси достигает атмосферного давления – жидкость закипает и оба вещества начинают перегоняться с водяным паром.
Так как сумма упругостей паров обоих веществ равна атмосферному давлению, температура перегонки каждого вещества в смеси будет ниже температуры кипения каждого компонента в чистом виде.
Пример: Температура кипения хлороформа – 61,2 °С, а при перегонке с водяным паром – 56,1 °С; изоамиловый спирт соответственно – 132 °С и 95 °С.
Изолирование веществ дистилляцией с водяным паром удобно в тех случаях, когда изолируемое вещество разлагается при температуре кипения. Например: Тетраэтил свинец разлагается при температуре 200 °C. Поэтому его удобно изолировать перегонкой с водяным паром.
Связь между летучестью вещества и молекулярной массой для веществ, нерастворимых друг в друге, выражается уравнением:
 =
=  , где
, гдеWo и Wn – вес органического вещества и воды в дистилляте;
Мо и Мn – соответствующие молекулярные массы;
Ро и Рn – соответствующие давления паров компонентов.
В основе дистилляции с водяным паром лежит закон Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе.
Для веществ, растворимых в воде, также имеются свои закономерности при перегонке их с водяным паром.
Методика перегонки с водяным паром
Измельченный биоматериал помещают в колбу и смешивают с водой до однородной массы. Подкисляют винной или щавелевой кислотой. Через присоединенный парообразователь насыщают паром. После этого пар поступает через водяной холодильник в приемник.
Этим методом перегоняются как вещества растворимые в воде:
- синильная кислота, метанол, этанол, уксусная кислота и т.д.
так и труднорастворимые:
- хлороформ, четыреххлористый углерод, дихлорэтан, изоамиловый спирт и др.
В первых порциях дистиллята, при их наличии будут присутствовать:
- синильная кислота, метанол, этанол
Синильная кислота

1. При исследовании свежего трупного материала применяют объемное определение НСN по избытку 0,1 н. раствора AgNO3, избыток которого оттитровывают аммония роданидом – NH4SCN. Индикатором является – железо аммонийные квасцы.
2. При исследовании несвежего трупного материала – весовой метод (описан в учебнике М.Д. Швайковой "Токсикологическая химия"):
При исследовании не вполне свежего трупного материала титриметрический метод анализа неприемлем, т.к. Н2S, содержащийся в объекте исследования, будет реагировать с серебра нитратом с образованием сульфида серебра, который будет искажать результаты анализа. В таких случаях обычно применяют гравиметрический (весовой) метод определения цианидов – CN.
Весовое (гравиметрическое) определение синильной кислоты сводится к отгонке синильной кислоты из навески объекта исследования, собиранию дистиллятов в 2-3 приемника, содержащие 0,2% раствор серебра нитрата, отделению после подкисления азотной кислотой (не содержащей цианидов – СN) осадка АgСN с возможной примесью Ag2S, обработке полученного осадка избытком раствора аммиака в целях отделения растворимого в нем цианида серебра от нерастворимого сульфида серебра, выделению из раствора с помощью азотной кислоты цианида серебра и определению металлического серебра после высушивания, сжигания и прокаливания фильтра с осадком.
Токсикологическое значение
Токсикологическое значение НСN объясняется ее сильной ядовитостью; тем, что она связывается с Fe2+ гемоглобина крови и дыхательными ферментами (Fe3+), а также ее широком применении в народном хозяйстве.
Соли HCN применяются для получения Au и Ag из руд – цианамидный способ:
4Au + 8KCN + O2 + 2H2O
 4K[Au(CN)2] + 4КОН
4K[Au(CN)2] + 4КОНзатем действуют металлическим цинком и получают чистые металлы.
Этот метод был предложен в 1843 году Багратионом Петром Романовичем для извлечения золота – Аu из руд методом цианирования.
Цианиды применяют в фотографии, в производстве фармацевтических препаратов, в сельском хозяйстве для борьбы с грызунами.
В период второй мировой войны фашисты травили людей в газовых камерах ЦИКЛОНОМ (пористый материал, пропитанный HCN).
Источником отравления в быту являются ядра горького миндаля, абрикоса, вишни и других плодов семейства розоцветных содержащих гликозид АМИГДАЛИН:
который в кислом растворе расщепляется на виноградный сахар , бензальдегид и HСN.
В организме, в тканях трупа, во внешней среде цианиды подвергаются биотрансформации:
1. Гидролиз : НСN + 2Н2О
 HCOONH4
HCOONH42. Превращением в роданиды под влиянием ронидазы (фермент):
KCN + S
 KSCN
KSCN3. Соединяется с гемоглобином крови, образуя циангемоглобин.
4. Связывается с цистеином.
5. Присоединяется к альдегидной группе сахаров:
Галогенводороды
Галогенводороды нашли применение в промышленности, медицине, быту. Поэтому мы изучили наиболее характерные представители этой группы: хлороформ, четыреххлористый углерод, дихлорэтан, хлоралгидрат.
Общей качественной реакцией для всех перечисленных галогенуглеводородов является реакция отщепления органически связанного хлора и определения ионов хлора нитратом серебра.
ХлороформКачественное определение
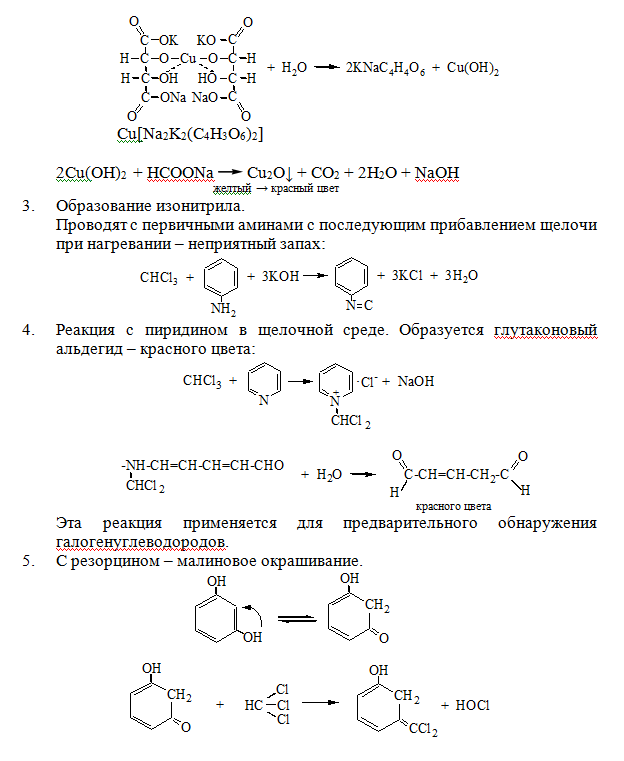
1. Отщепление хлора и определение ионов хлора нитратом серебра:
CHCl3 + 4NaOH= 2NaCl + HCOONa + 2H2O
NaCl + AgNO3= AgCl↓ + NaNO3
2. Как видно из предыдущей реакции, при отщеплении органически связанного хлора, одним из продуктов реакции является формиат натрия, который определяют с реактивом Фелинга:
Количественное определение
Все галогенуглеводороды количественно определяют аргентометрически по хлорид-иону.
Токсикологическое значение
Применяется в промышленности как растворитель и экстрагент.
Отравления – при вдыхании через пищеварительный тракт.
Легкая степень – сознание затемнено, понижение слуха, косоглазие с диплопией.
Средняя тяжесть – тоже, что и при легкой, только с тошнотой, рвотой, болями головы, поносом.
Тяжелая – судороги, кома, нефропатия, перерождение печени. Смерть наступает от оттека легких.
Антидотов нет.
Метаболизм – СО2 и НCl.
Выделяют в неизменном виде из легких – 9%.
галогенводороды
CCl4
Качественное определение
1. Отщепление органически связанного хлора c последующим определением хлорид-ионов.
CCl4 + 4NaOH 4NaCl + CO2 + 2H2O
2. Реакция Фудживара – аналогично CHCl3.
3. Образование изонитрила – аналогично CHCl3.
4. С 2,7-диоксинафталином:
Светло-бурое → зелено-желтое окрашивание.
Отличительные реакции представлены в таблице (Крамаренко).
Токсикологическое значение
CCl4 – растворитель, экстрагент.
Попадает – на кожу, ЖКТ, легкие.
Накапливается – жировая ткань, печень, мозг, костный мозг, почки.
Выделяется – через легкие, с мочой.
Далее перерождение клеток печени, почек.
Легкая степень отравления: раздражение глазных яблок, головокружение, головная боль.
Массивное отравление: тошнота, рвота, понос, боли в животе, желудочно-кишечные кровотечения, головная боль, головокружение, спутанное сознание, сонливость, расстройство зрения, судороги, кома – смерть за счет остановки дыхания, сердца.
Антидотов нет.
Хлоралгидрат
Качественное определение
1. Отщепление хлора.
CCl3СОH + NaOH НСCl3 + HCOONa
Как видно из этой реакции хлоралгидрат при отщеплении атома хлора образует хлороформ, поэтому он дает все те же реакции, что и хлороформ.
2. С реактивом Несслера.
Эта реакция позволяет отличить хлоралгидрат от остальных галогенуглеводородов.
CCl3СОH + K2[HgI4] + 3KOH Hg↓ + СCl3COOK + 4KI + 2H2O
Обличить его можно экстракцией из дистиллята диэтиловым эфиром. При его присутствии в дистилляте в выпарительной чашке характерное кристаллическое вещество – сухой остаток хлоралгидрата.
Токсикологическое значение
Применяется в медицине – успокаивающее, снотворное, противосудорожное.
Накопление, симптомы – похожи на действие хлороформа.
Метаболизм – трихлорэтанол, трихлоруксусная кислота.
Выводится – с мочой в виде глюкуронида.
Антидотов нет.
Дихлорэтан
Качественное определение
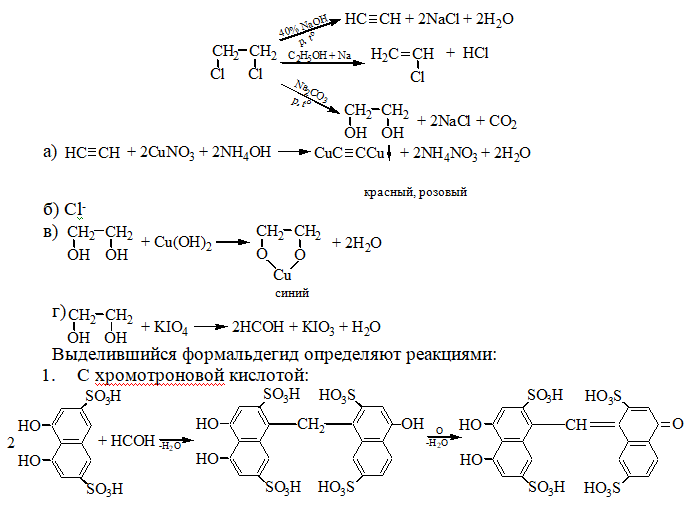
1. Реакция отщепление органически связанного хлора. В зависимости от условий проведения этой реакции образуется разные продукты, на которые проводят соответствующие реакции.
Токсикологическое значение
С2Н4Cl2 – применяется – как растворитель, экстрагент, в кожевенной промышленности.
Системный яд. Попадает через легкие, кожу, ЖКТ.

